结肠癌组织中USP22、FoxM1蛋白表达变化及其与患者临床病理特征、预后的关系
张婧,苟园园,张林,刁攀娅
重庆市江津区中心医院,重庆 402260
结肠癌是消化系统常见的恶性肿瘤之一,直肠与乙状结肠交界处是其好发部位[1]。结肠癌发病率位于我国癌症发病率第二位[2],且病死率较高。结肠癌患者平均5年生存率约为50%,而晚期患者5年生存率则低于10%[3]。因此,积极寻找有意义的结肠癌生物学指标,研究其与结肠癌发生发展的关系,对结肠癌患者早发现、早治疗及预后判断有重要意义。去泛素化酶(USP22)是一种泛素特异性蛋白酶,属于去泛素蛋白酶家族[4],在人体脑、骨骼肌、心脏细胞中均有表达,而在肝脏和肺脏中的表达水平较低。USP22具有多种生物学功能,如调节细胞生长周期、细胞分化及细胞信号转导等[5]。有研究报道,USP22在多种肿瘤(胃癌、肝细胞癌、非小细胞肺癌等)细胞中也呈高表达状态[6-8]。叉头框蛋白M1(FoxM1)属于Forkhead转录因子家族,该家族蛋白结构内有一个螺旋的DNA结构域。有文献报道,FoxM1在基底细胞癌、肝细胞癌、肺癌及乳腺癌细胞中均呈高表达状态[9],并且具有调节细胞生长周期、促进肿瘤细胞增殖及分化的作用[10]。本研究探讨结肠癌组织中USP22、FoxM1蛋白表达变化及临床意义,为患者治疗及预后评估提供科学依据。
1 资料与方法
1.1 临床资料 选取2016年3月—2017年12月在本院住院治疗的结肠癌患者198例,男135例,女63例;年龄41~68(55.1±3.9)岁,≥55岁128例,<55岁70例;肿瘤直径<5 cm90例,≥5 cm 108例;结肠癌中低分化119例,高分化79例;Duke's分期:A期69例,B期53例,C期48例,D期28例;肿瘤浸润深度:T1~283例,T3~4115例;有淋巴结转移72例。纳入标准:未接受过抗肿瘤治疗;临床资料完整,患者或家属签署知情同意书。排除标准:合并其他系统恶性肿瘤;合并重要脏器疾病;免疫系统功能障碍。本研究经医院医学伦理委员会批准。
1.2 结肠癌组织及癌旁组织中USP22、FoxM1蛋白表达检测 采用免疫组化法。取结肠癌组织及距离肿瘤边缘大于5 cm的癌旁组织,用甲醛固定后石蜡包埋,使用切片机将组织切成厚度为4μm的切片。切片脱蜡,再经过无水乙醇等梯度水化后PSB缓冲液清洗3次,每次5 min。再将切片放入柠檬酸盐缓冲液(pH 6.0,北京中杉金桥生物技术有限公司)中,100℃加热维持25 min,室温冷却,PSB清洗3次,每次5 min。3%过氧化氢浸泡10 min,去除内源性过氧化氢酶,PSB清洗。分别滴加100μL USP22、FoxM1的一抗(稀释比例1∶100,Abnova公司),4℃过夜,复温30 min后PSB清洗,再滴加100μL二抗,37℃温育30 min,PSB清洗。擦干切片后DAB(DAKO公司)显色5 min,流水冲洗后苏木素复染1 min,流水冲洗后再次乙醇梯度脱水,二甲苯透明,中性树脂封片,晾干。运用Leica DC200图像分析系统收集图像并分析(×400)。随机选取5个视野,每个视野选取100个细胞,根据细胞的染色强度及细胞阳性百分数进行综合评分。染色强度评分:无色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分。细胞阳性百分比评分:≤10%计1分,>10%~50%计2分,>50%~70%计3分,>70%计4分,两项评分相乘得0~2为阴性,≥3为阳性[6]。
1.3 随访 从患者出院起,每2~3个月随访1次,包括电话随访或门诊随访两种方式,随访3~36个月,直至2020年12月或患者死亡,收集患者生存数据。
1.4 统计学方法 采用SPSS22.0统计软件。计数资料比较采用χ2检验;预后分析采用Kaplan-Meier生存分析法。P<0.05为差异有统计学意义。
2 结果
2.1 结肠癌组织与癌旁组织中USP22、FoxM1蛋白表达比较 结肠癌组织与癌旁组织中USP22蛋白阳性表达率分别为52.5%(104/198)、31.8%(63/198);结肠癌组织与癌旁组织中FoxM1蛋白阳性表达率分别为59.5%(118/198)、32.3%(64/198)。与癌旁组织比较,结肠癌组织中USP22、FoxM1蛋白阳性表达率高(P均<0.05)。
2.2 结肠癌组织中USP22、FoxM1蛋白表达阳性与患者临床病理特征的关系 见表1。
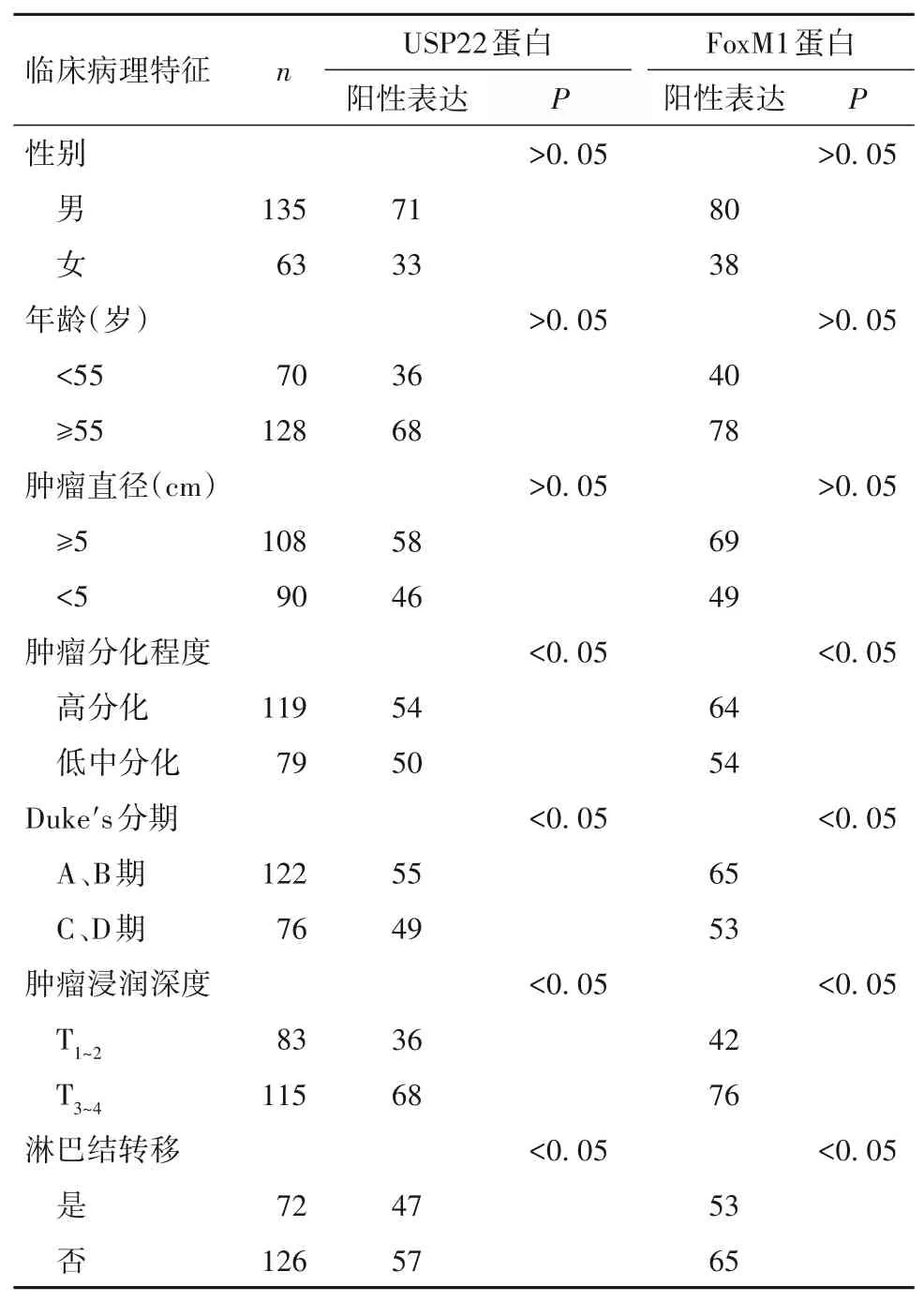
表1 结肠癌组织中USP22、FoxM1蛋白表达阳性与患者临床病理特征的关系(例)
2.3 结肠癌组织中USP22、FoxM1蛋白表达与患者预后的关系 198例结肠癌患者均随访成功。3年内,共有60例患者死亡,3年生存率为69.70%。USP22蛋白表达阳性患者3年生存率为60.58%(63/104),阴性患者3年生存率为79.79%(75/94),比较差异有统计学意义(P<0.05)。FoxM1蛋白表达阳性患者3年生存率为63.56%(75/118),阴性患者3年生存率为78.75%(63/80),比较差异有统计学意义(P<0.05)。
3 讨论
目前结肠癌的治疗方式主要有手术切除及放化疗。虽然医疗技术已经取得重大进步,但是结肠癌患者的发病率和病死率仍不容乐观。我国晚期结肠癌患者的5年生存率仅为8%,早发现、早治疗是提高结肠癌患者预后的有效手段[11]。因此,更深入了解结肠癌的发病机制对于患者治疗及预后有重要意义。
USP22是去泛素蛋白酶家族的新成员,位于人类第17号染色体上,由14个外显子组成,负责编码500多个氨基酸[12]。USP22是SAGA(Spt-Ada-Gcn5-乙酰转移酶)的亚基,可使组蛋白H2A和H2B去泛素化和乙酰化以调节基因的转录和表达[13]。有研究发现,USP22基因是与肿瘤密切相关的11个基因之一,在胃癌及乳腺癌肿瘤细胞中呈高表达状态,并且可以有效预测癌症的治疗效果[14]。USP22在调节细胞生长周期、胚胎发育等过程中发挥着重要的作用。高表达的USP22与结肠癌的预后密切相关[15]。本研究结果发现,结肠癌组织中USP22蛋白阳性表达率远高于癌旁组织。可能因为USP22的去泛素化作用导致抑癌基因p53乙酰化程度降低,进一步抑制了p53介导的细胞凋亡,使得肿瘤细胞增殖速度加快,促进肿瘤细胞的生长[16]。本研究结果还显示,结肠癌组织中的USP22表达与肿瘤Duke's分期、分化程度有关。其原因可能为USP22通过抑制靶基因BMI-1、c-Myc、p53,同时上调p16INK4a、p14ARF的表达来介导肿瘤细胞的生长,促进肿瘤细胞的恶性进展,使Duke's分期增高[17]。研究结果还显示,结肠癌组织中的USP22表达与肿瘤浸润深度、淋巴结转移有关,机制可能为USP22上调BMI-1、Cyclin D2的表达,而BMI-1通过调节E-cadherin的表达来促进肿瘤细胞迁移和侵袭[18]。
FoxM1位于人类染色体12p13.3,由10个外显子组成,在全身各个组织具有增殖能力的细胞中均表达。FoxM1具有多种生物学功能,例如调节细胞周期、抑制癌细胞的增殖和迁移等[19]。FoxM1在多种肿瘤细胞中呈高表达状态,如宫颈癌、胰腺癌、前列腺癌等[12]。近年来有研究发现,FoxM1参与肿瘤细胞的增殖及转移过程,如FoxM1的过表达会导致间充质细胞活化进一步激活胰腺癌细胞上皮—间质转化与癌症干细胞标志物转录过程[20]。本研究结果发现,结肠癌组织中FoxM1蛋白表达上调。机制可能为FoxM1与β-catenin结合并激活了Wnt/β-catenin信号通路,促进癌细胞的增殖,使得肿瘤恶性程度增高[12]。本研究结果还显示,结肠癌组织中的FoxM1蛋白表达与肿瘤Duke's分期和分化程度有关。原因可能是FoxM1通过上调SKP1-Cullin1-F-box泛素连接酶复合物表达来诱导p27、p21的降解,促进肿瘤的恶性进展,使得肿瘤细胞的Duke's分期进一步增高[21]。研究结果还显示,结肠癌组织中的FoxM1表达与肿瘤浸润深度、淋巴结转移有关,机制可能为下调结肠癌组织中E-cadherin蛋白及其mRNA的表达[22],促进肿瘤细胞的浸润、迁袭和淋巴结转移,缩短了结肠癌患者生存时间。
本研究中USP22与FoxM1蛋白表达阳性患者的3年生存率均低于阴性患者,表明了两指标均具有促进肿瘤发生发展的作用。USP22可使β-catenin去泛素化,而去泛素化的β-catenin又与FoxM1结合促进肿瘤细胞的增殖、迁袭及转移[12]。
综上所述,结肠癌组织中的USP22与FoxM1的表达均升高,与肿瘤细胞Duke's分期、浸润深度及淋巴结转移相关,这为结肠癌的诊断、治疗及评估预后的过程中提供可靠的依据。但是两指标在结肠癌发展过程中的具体作用机制尚不明确,还需大样本的研究来进一步证实。

