双酚A对合果芋叶片气体交换参数、叶绿素荧光参数和氧化损伤的影响
刘梦,董欣越,杨爱珍,黄艳虹,高凡,郭家选
农业农村部华北都市农业重点实验室/北京农学院资源与环境系,北京 102206
双酚A(2,2-二(4-羟基苯基)丙烷,bisphenol A,BPA),通常用于合成环氧树脂、酚类树脂和聚碳酸酯等工业产品[1],同时BPA具有内分泌干扰特性,可能会威胁胎儿和儿童的健康[2]。近年来,随着BPA生产以及使用量的增加,其在环境中的直接或间接排放也随之增加。BPA已成为一种全球性的环境污染物,在环境、食品、人体血液和尿液等不同基质中被广泛检出[3-6],欧洲和韩国土壤中BPA浓度分别高达140 μg·kg-1和48.68 μg·kg-1[7];日本垃圾填埋场渗滤液中的BPA浓度高达17.2 mg·L-1[8]。环境中BPA的污染修复方法主要有物理法、化学法和生物法等,其中物理、化学法运转费用高昂[9],并可能产生二次污染,对生态系统健康产生进一步的破坏,而植物修复技术属于原位修复技术,其维护成本低、操作简单、二次污染易于控制,具有良好的生态环境效益[10-11]。隋春晓和王琳[12]在人工湿地实际应用中发现,香蒲床湿地对BPA的去除率在74%~96%之间,芦苇床湿地对BPA的去除率基本维持在70%~83%。植物修复技术主要是利用自然生长植物根系(或茎叶)吸收、富集、降解或者固定污染土壤、水体和大气中的污染物,达到净化环境污染物的目的。然而,植物在吸收、富集污染物的生物过程中,污染物的毒性可能会影响到植物的生长发育。已有研究表明光合作用的改变是环境污染物影响植物生长发育的关键性因素[13],而植物叶片氧化损伤与其解毒能力密切相关[14-15]。因此,研究BPA对植物叶片气体交换参数、叶绿素荧光参数和氧化损伤的影响对于科学评价BPA胁迫下植物耐受和富集能力非常重要。
目前关于BPA对植物光合生理影响的研究主要集中在水稻、玉米和大豆等粮食作物[13, 16-17],而对污染修复植物鲜见报道[18]。合果芋(SyngoniumpodophyllumSchott),是天南星科代表性景观叶植物,环境适应能力强[19],具有较强的耐污和去污能力,对甲醛、苯的吸收效果十分显著,是一种理想的富集植物[20-21]。王艳英等[22]发现合果芋等植物对城市河道的化学需氧量(COD)、氨氮和磷都有较好的降解效果。檀笑等[23]发现合果芋是一种具备去碳、脱氧、除磷和积累重金属的高效修复植物,在有机物和重金属复合污染水体的修复中应用潜力较大。因此,合果芋也可能是一种对BPA污染具有较强耐受和富集能力的植物。然而,目前关于合果芋对BPA的耐受和富集能力,以及BPA对其叶片光合生理和氧化损伤的影响研究还非常缺乏[24]。基于此,本文以合果芋为研究对象,研究BPA对合果芋叶片气体交换参数、叶绿素荧光参数和氧化损伤的影响,以期为BPA污染的植物修复提供基础实验数据与参考。
1 材料与方法(Materials and methods)
1.1 试验材料
试验于2021年3—4月在北京农学院科技园区进行。试验所用BPA购自北京酷来搏科技有限公司,BPA试剂配制以甲醇(色谱纯,北京迈瑞达科技有限公司)为助溶剂。供试材料白蝶合果芋幼苗购自广西钦州合果芋生产基地,随后在人工气候室中蒸馏水培养1个月,控制生长环境昼夜温度为25 ℃/15 ℃,光暗时间为12 h/12 h,空气相对湿度为60%。采用水培试验,塑料水培箱体积为10 L,尺寸为380 mm×280 mm×140 mm。
1.2 试验设计
为了分析BPA对合果芋叶片气体交换参数、叶绿素荧光参数和氧化损伤的影响,选择株高约为40 cm、具有5~6片功能叶、茎秆粗细和根系等长势一致的合果芋144株,使用0.5% NaClO溶液消毒20 min,蒸馏水清洗3~5次后种植于水培箱中,内装1/2强度Hoagland营养液,用穿孔塑料板固定,封盖。营养液预培养7 d后,分别加入0.0、10.0、30.0和50.0 mg·L-1(浓度选择基于世界各地环境中的BPA污染水平、其他植物的BPA毒性研究以及前期预试验数据)的BPA进行胁迫处理,共计4个处理水平;每个处理3个平行水培箱,每个平行水培箱种植12株,种植行距为60~80 mm。在BPA添加后的第0、1、3、5、7、10天随机选取每个平行水培箱中植株的完全舒展叶(从顶端起向下取其完全展开的叶子)数片混匀,用液氮速冻且储藏于-80 ℃冰箱内。
1.3 测定方法
1.3.1 光合色素含量、气体交换参数和叶绿素荧光参数的测定
随机选取每个处理的合果芋若干,从顶端起向下取其完全展开的叶子混匀后,采用丙酮提取法[25-26]测定叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量,最终计算3次上述测定指标的平均值。
气体交换参数采用便携式光合仪(CIRAS-3,汉莎科技仪器有限公司)测定。在上午9:00—11:00,测定合果芋顶芽向下数第2片完全展开叶片的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci),并设定数据采集时间为200 s,稳定后记录,每个处理测定3株取平均值。
叶绿素荧光参数采用植物效率分析仪(Handy PEA,汉莎科技仪器有限公司)测定。暗适应30 min后,测定合果芋顶芽向下数第2片完全展开叶片的初始荧光(F0)、最大荧光产量(Fm)和PSⅡ最大光能转化效率(Fv/Fm)值,每个处理测定3株取平均值。
1.3.2 过氧化氢、丙二醛和电解质渗透率的测定
随机选取每个处理的合果芋若干,从顶端起向下取其完全展开的叶子混匀后,采用二甲酚橙法[27]测定过氧化氢(H2O2)含量;采用改进的硫代巴比妥酸法[28]测定丙二醛(MDA)含量;采用电导率仪(DDSJ-308F,上海仪电科学仪器股份有限公司)测定电解质渗透率(EC),最终计算3次上述测定指标的平均值。
1.4 数据处理及分析
试验数据采用Excel 2019统计,SPSS 23.0分析处理间的差异显著性,所有数据均以平均数±标准差表示,采用双因素方差方法分析显著性(P<0.05),使用Origin 2019b软件绘图。
2 结果与分析(Results and analysis)
2.1 BPA胁迫下合果芋叶片光合色素含量
由图1可知,在同一培养阶段,不同BPA处理(10、30和50 mg·L-1)的合果芋叶片叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均低于对照处理(CK, 0 mg·L-1)。在10 mg·L-1处理下,合果芋叶片光合色素含量在3 d内略有下降,但在3 d后变化相对稳定。在30 mg·L-1和50 mg·L-1处理下,合果芋叶片光合色素含量随着胁迫时间的增加显著降低,其降低趋势在前5 d显著,后5 d趋于平缓。在第10天,10、30和50 mg·L-1处理下的叶绿素a分别比CK降低了6.4%、21.5%和30.1%;叶绿素b分别降低了7.0%、19.5%和32.5%;总叶绿素分别降低了6.6%、21.0%和31.1%;类胡萝卜素分别降低了10%、19%和30.2%。

图1 双酚A(BPA)处理对合果芋叶片叶绿素a (a)、叶绿素b (b)、总叶绿素(c)和类胡萝卜素(d)含量的影响注:不同大写字母表示同一浓度下不同时间水平下差异性显著(P<0.05);不同小写字母表示同一时间不同浓度水平下差异性显著(P<0.05);下同。Fig. 1 Effects of bisphenol (BPA) treatment on the content of chlorophyll a (a), chlorophyll b (b), total chlorophyll (c) and carotenoid (d) in leaves of Syngonium podophyllum SchottNote: Different capital letters indicate significant differences at the same concentration and different time levels (P<0.05); different lowercase letters indicate significant differences at the same time and different concentration levels (P<0.05); the same below.
2.2 BPA胁迫下合果芋叶片气体交换参数
不同BPA处理下合果芋叶片Pn、Tr、Gs和Ci的变化情况如图2所示。随着BPA浓度的增加,合果芋叶片Pn逐渐下降,10 mg·L-1处理下变化相对稳定,处理10 d内略有下降但是变化不大,而30 mg·L-1、50 mg·L-1处理下前5 d内变化显著,5 d后变化趋缓(图2(a));在10、30和50 mg·L-1处理下合果芋叶片Tr显著低于对照处理(CK, 0 mg·L-1),在第10天分别降低8%、14%和25%,其中50 mg·L-1处理变化最显著(图2(b));10、30和50 mg·L-1胁迫10 d后,Gs分别比CK降低了21%、31%和48%(图2(c));当BPA浓度高于30 mg·L-1时,合果芋叶片Ci显著增加,分别比CK增加了8%、27%和28%(图2(d))。
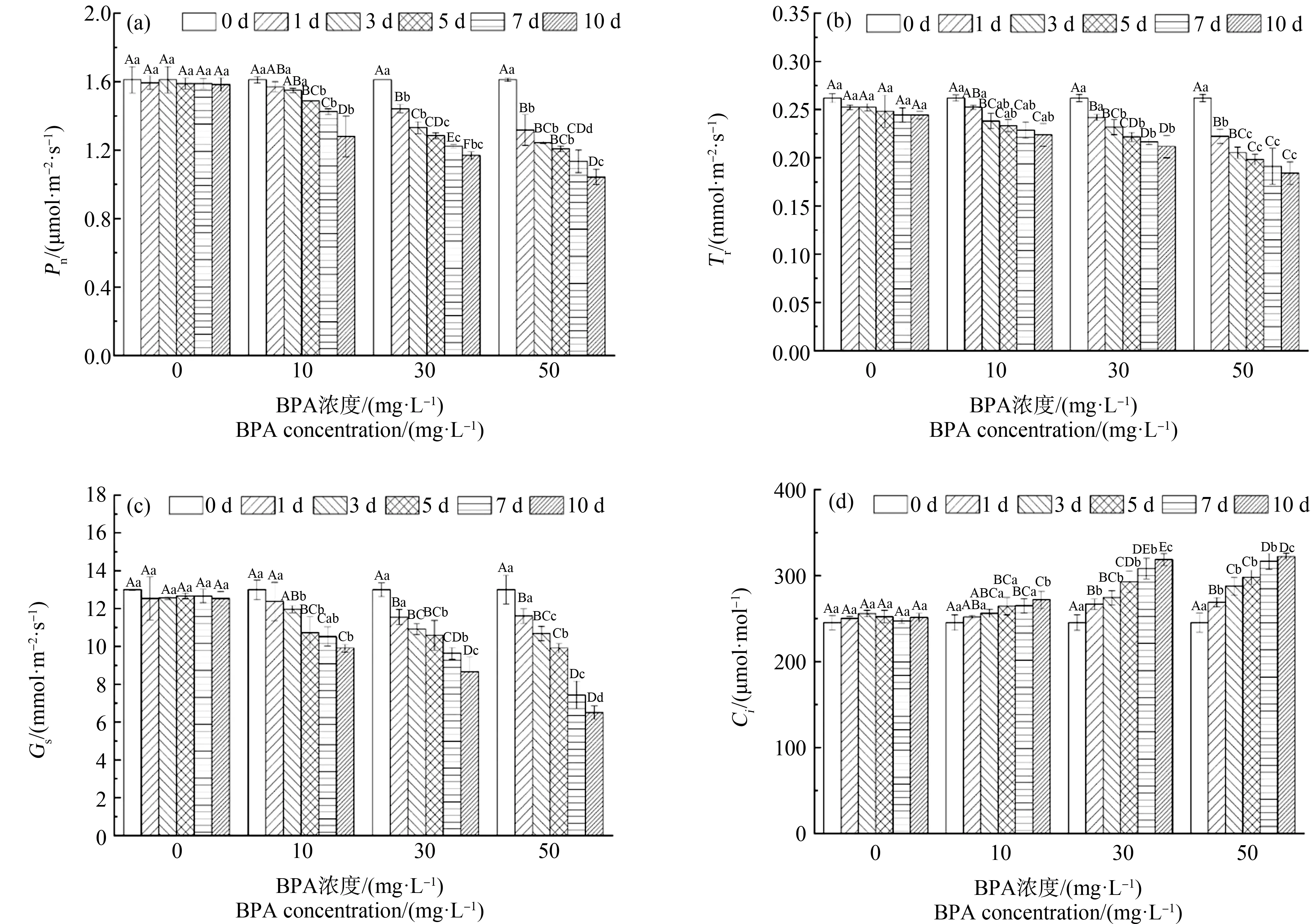
图2 BPA处理对合果芋叶片净光合速率(Pn) (a)、蒸腾速率(Tr) (b)、气孔导度(Gs) (c)和胞间二氧化碳浓度(Ci) (d)的影响Fig. 2 Effects of BPA treatment on net photosynthetic rate (Pn) (a), transpiration rate (Tr) (b), stomatal conductance (Gs) (c) and intercellular carbon dioxide concentration (Ci) (d) in leaves of Syngonium podophyllum Schott
2.3 BPA胁迫下合果芋叶片叶绿素荧光参数
不同BPA处理下合果芋叶片F0、Fm和Fv/Fm值的变化特征如图3所示。10、30和50 mg·L-1处理下F0均高于对照处理(CK, 0 mg·L-1),其中在第10天分别为696、730和746(图3(a));在同一培养阶段,10、30和50 mg·L-1处理下Fm均低于CK,且在50 mg·L-1处理下达到最显著水平(图3(b));10 mg·L-1处理下Fv/Fm值变化相对稳定,处理10 d内略有下降但是变化不大,而50 mg·L-1处理显著下降,其中在第10天,10、30和50 mg·L-1处理下Fv/Fm值分别为0.763、0.745和0.737(图3(c))。
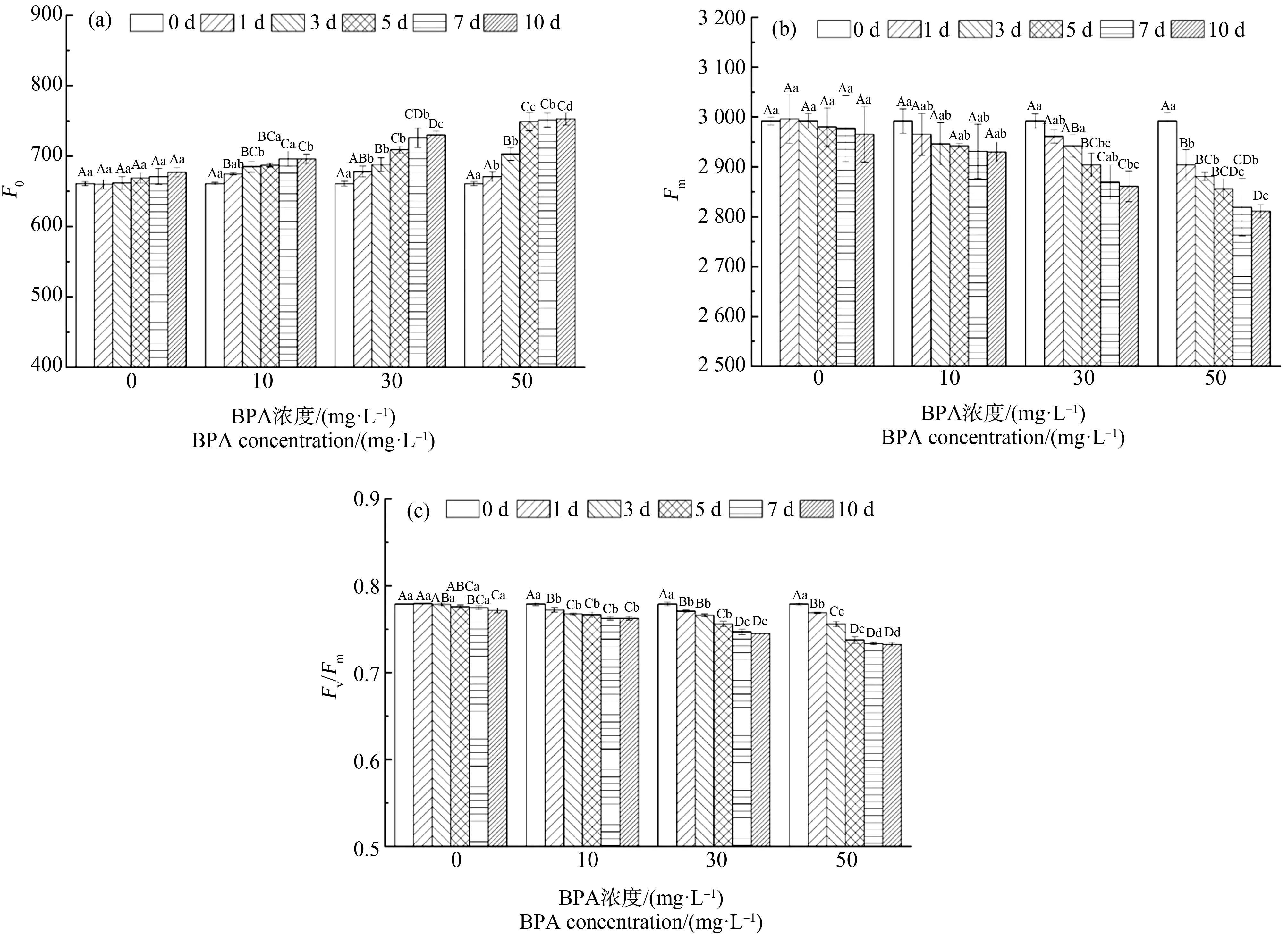
图3 BPA处理对合果芋叶片初始荧光(F0) (a)、最大荧光产量(Fm) (b)和PSⅡ最大光能转化效率(Fv/Fm) (c)的影响Fig. 3 Effects of BPA treatment on initial fluorescence (F0) (a), maximum fluorescence yield (Fm) (b) and maximum light energy conversion efficiency (Fv/Fm) (c) of PSⅡ in leaves of Syngonium podophyllum Schott
2.4 BPA胁迫下合果芋叶片氧化损伤
由图4可知,不同BPA处理下合果芋叶片H2O2、MDA含量和EC值均高于CK(0 mg·L-1)。在30 mg·L-1、50 mg·L-1处理下,随着胁迫时间的增加,H2O2和MDA含量和EC值呈现不同程度的递增,在第10天,H2O2分别比CK增加了16%和27.8%(图4(a)),MDA含量分别比CK增加了12.2%和17.1%(图4(b)),EC值分别比CK增加了3.6%和5.3%(图4(c))。在10 mg·L-1处理下,H2O2、MDA含量和EC值在3 d内略有上升,而在3 d后的变化趋于稳定。
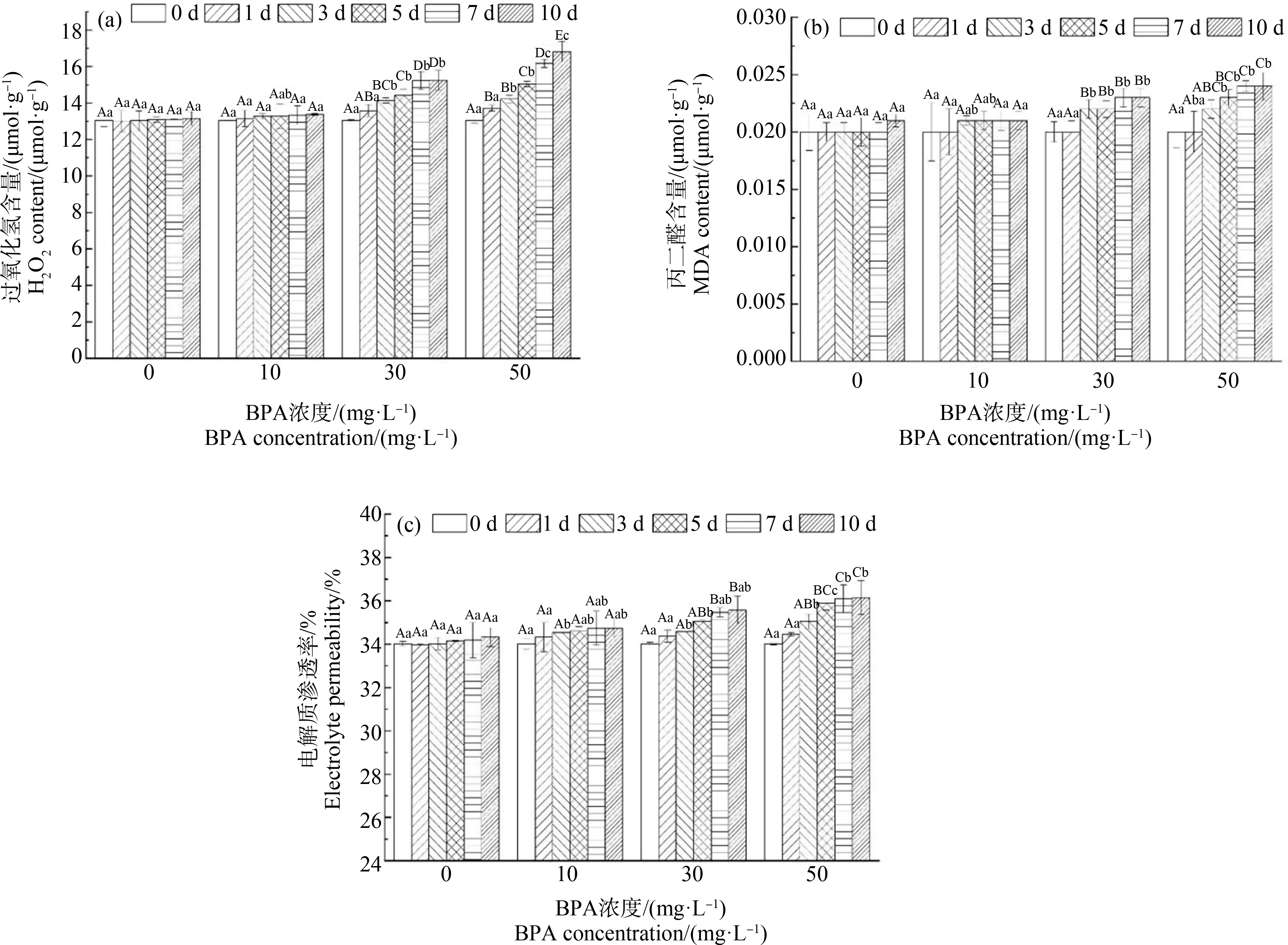
图4 BPA处理对合果芋叶片过氧化氢(H2O2) (a)、丙二醛(MDA)(b)和电解质渗透率(EC)(c)的影响Fig. 4 Effects of BPA treatment on hydrogen peroxide (H2O2) (a), malondialdehyde (MDA) (b) and electrolyte permeability EC (c) in leaves of Syngonium podophyllum Schott
3 讨论(Discussion)
3.1 BPA胁迫对合果芋叶片光合作用的影响
植物生长发育依赖有机物的合成与积累,而有机物合成与累积依赖于植物的光合作用,因此光合作用的改变是环境污染物影响植物生长发育的关键性因素。其中叶绿素和类胡萝卜素是植物光合作用的主要色素,其含量高低直接反映植物光合作用能力的强弱,当植物受到逆境胁迫后可导致光合色素含量下降[18, 29-30]。有研究表明,高浓度的BPA能降低叶绿素的含量,干扰植物的正常生理活动,对有机物积累过程产生影响[24]。Zhang等[31]研究指出,高剂量BPA暴露会损害PSⅡ反应中心,抑制光化学反应,并导致多余的能量以热量的形式释放。本研究结果显示,随着BPA浓度的增加,合果芋叶片的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均呈下降的趋势,当BPA浓度达到50 mg·L-1时,合果芋叶片叶绿素的合成能力影响最严重,其中叶绿素a对胁迫处理更为敏感。推测其原因,可能是因为BPA胁迫抑制了合果芋光合作用中的电子传递,叶绿体结构遭到破坏,叶绿素合成酶的活性受到较大程度的影响。
植物的光合作用主要受气孔因素和非气孔因素的限制,在叶片气体交换动态变化过程中,当Ci与Gs同时下降时,Pn下降主要是由气孔限制引起的,如果Pn的降低伴随着Ci升高,光合作用的主要限制因素则是光合机构活性降低的非气孔因素引起的[32]。在逆境胁迫下,植物通常表现出气孔导度降低,蒸腾减弱,CO2吸收和同化阻力增加,导致光合速率降低,同化产物供应较少。赵继武等[33]发现铀胁迫会使黑麦草的Pn和Gs显著降低,但未对Ci产生显著影响,表明黑麦草的光合参数对铀具有较好的耐受性,而Pn的降低可能是光抑制引起的。本研究中,Pn、Tr、Gs与叶绿素的变化趋势基本一致,BPA浓度>30 mg·L-1时,合果芋叶片Gs显著减小,Tr和Pn显著降低,Ci逐渐增加,表明BPA导致光合作用降低应是属于非气孔限制因子造成的,即叶肉消耗CO2的能力降低,光合作用过程受到BPA的抑制和损伤,进而使光合代谢受到严重影响。这与李泽等[34]在重度干旱胁迫下2种油桐的Pn、Gs和Tr等显著下降、Ci显著升高的结果相似。
叶绿素荧光是探测和分析植物光合功能的重要手段之一,为研究光系统及其电子传递过程提供了丰富信息,常被用于评价环境胁迫对植物生长的影响[16, 35]。其中F0是PSⅡ反应中心全部开放时的荧光,它可以表示逆境对作物叶片PSⅡ永久性伤害;Fm是PSⅡ反应中心处于完全关闭时的荧光产量,可反映通过PSⅡ的电子传递情况;Fv/Fm为PSⅡ最大光化学量子产量,常用于度量植物叶片PSⅡ原初光能转换效率和PSⅡ潜在活性[33, 36-37]。徐小逊等[30]发现豨莶叶片Fv/Fm、电子传递的量子产率(ΦPSⅡ)、表观光合电子传递速率(ETR)随Cd浓度的升高而逐渐降低,而非光化学淬灭系数(NPQ)则呈现先升高后降低的趋势,表明豨莶光合机构对Cd胁迫有一定的耐受能力。在本研究中,合果芋叶片F0随BPA浓度和胁迫时间的增加呈上升趋势,Fm、Fv/Fm值呈下降趋势,表明BPA处理组合果芋叶片捕获光能中用于光化学反应的光能减少,降低了PSⅡ反应中心开放程度和光化学活性,影响了合果芋内部生理功能的正常代谢。Jiao等[38]研究在大豆不同生长阶段BPA胁迫对光合作用的影响发现,随着BPA胁迫浓度的增大,大豆的Fv/Fm值呈不断降低趋势,对其光合作用的抑制作用也更明显。
3.2 BPA胁迫对合果芋叶片氧化损伤的影响
在正常生长环境下,植物体内活性氧(ROS)产生和清除保持动态平衡,但不同的环境胁迫会导致ROS代谢紊乱。当ROS过量积累,直到超过植物抗氧化清除能力的程度时,会在叶绿体、质膜、线粒体和过氧化物酶体中产生氧化应激,从而引起植物细胞膜脂质过氧化损伤。其中,H2O2是ROS的重要代表物质,MDA是膜脂过氧化作用的主要产物之一,是反映细胞膜脂过氧化作用强弱和质膜破坏程度的重要指标[39-40]。此外,EC反映细胞外渗物质的多少,可作为膜受损程度的辨别指标,其生物膜结构和功能的稳定性与植物的抗逆性密切相关,在逆境胁迫下细胞膜受到了损伤,会导致渗透物质大量外流,从而会引起EC升高[41]。郭晖等[41]发现随着盐浓度的增大,合果芋、绿萝、蔓绿绒和龟背竹的MDA、EC整体上均不同程度增加。Ali等[42]发现,高剂量的BPA增加了细胞的膜通透性,并导致ROS浓度增加和脂质过氧化作用加强。本研究发现,除10 mg·L-1处理外,30 mg·L-1和50 mg·L-1的BPA处理下H2O2、MDA含量均随BPA浓度和胁迫时间的增加呈稳定上升的趋势,这与本试验中EC的变化趋势一致,表明低剂量BPA诱导产生的ROS具有降解少量BPA的能力,高剂量BPA会使合果芋叶片膜脂过氧化程度加剧,膜的透性增大,稳定性降低,细胞内含物外渗,影响植物的正常代谢,从而加大植物的毒害作用,这与Wang等[43]的试验结果相似。
综上所述,所有BPA胁迫处理中,30 mg·L-1和50 mg·L-1处理的合果芋叶片的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素量都显著低于对照组(6.4%~32.5%),且叶绿素a的破坏作用高于叶绿素b;同时,BPA胁迫还抑制了合果芋叶片对光能的吸收、转化和利用,明显降低了Pn、Tr、Gs、Fm和Fv/Fm值,且下降幅度随着BPA处理浓度和时间的增加而增大。相对来说,10 mg·L-1的BPA胁迫处理对合果芋叶片气体交换参数、叶绿素荧光参数的影响较小。此外,30 mg·L-1和50 mg·L-1处理的合果芋叶片H2O2和MDA含量、EC值均有不同程度的增加,且叶片膜脂过氧化严重,明显受到损伤;而10 mg·L-1处理的合果芋叶片氧化损伤没有显著影响。

