葛根多糖抗氧化性及其降血糖作用研究
王秋丹,赵凯迪,林长青
(延边大学医学院中医系,吉林延吉 133000)
葛根(Pueraria,DC),又名葛藤、葛麻叶、野葛等,属豆科多年生缠绕藤本植物[1],其主要分布在我国辽宁、河北、河南、山东、安徽等地,约占世界品种的50%[2]。于2000年葛根正式被国家卫生部批准列入“既是食品又是药品”名录[3−4]。此外,在《中国药典》、《中药大辞典》、《中华本草》等典籍中也有记载[5]。葛根含有黄酮类、三萜类、皂苷类和多糖类等多种化学成分,具有生津止渴、醒脾解酒、升阳止泻、降脂等功效,对心脑血管疾病、糖尿病、神经保护、解酒保肝和骨质疏松均有一定疗效,此外,其还能够调节肠道菌群[6−8]。许多植物多糖均具有生物活性,包括调节免疫力[9]、调节血糖血脂[10]、抗肿瘤[11]等内在的保健作用。
糖尿病(DM)是21世纪最重要的健康问题之一。1型糖尿病(T1DM)也称为胰岛素依赖型糖尿病(IDDM),从T1DM开始就依赖于胰岛素治疗,糖尿病作为近年来引起代谢紊乱的最常见疾病,其发病率在多数国家呈上升趋势[12]。糖尿病具有多种副作用,可导致组织损伤,体内脂质代谢紊乱,并最终降低糖尿病患者的生活质量[13−14]。
由于葛根富含多种营养活性成分,现已有多种以葛根或其提取物为原料制备的保健食品,如葛根解酒茶、葛根片、葛根口服液等。葛根对治疗糖尿病有良好的效果,葛根、葛根素单独应用或葛根与降糖药、胰岛素联合应用均可以显著降低2型糖尿病大鼠的血糖[15−16]。其主要通过改善胰岛素抵抗、保护胰岛β细胞发挥降糖作用,葛根醇提物具有较强的蛋白酪氨酸磷酸酯酶1B(PTP1B)活性抑制作用,可改善胰岛素抵抗人肝癌细胞HepG2的胰岛素敏感性并增强其葡萄糖摄取能力[17]。近年来,对葛根多糖的研究多集中于提取方法和纯化工艺的优化[18]、降血脂活性的研究[19]以及体外降血糖作用[20],但对葛根多糖在治疗1型糖尿病方面的报道较少,因此,本试验中采用DPPH·、ABTS+·、·OH、PTIO清除率来测定葛根多糖的抗氧化性,采用腹腔注射STZ建立1型糖尿病模型,并对其各项指标进行测定,旨在为开发葛根成为新抗氧化和降血糖产品提供理论参考。
1 材料与方法
1.1 材料与仪器
葛根 吉林省益丰大药堂;抗坏血酸(VC) 中国医药集团有限公司;SD大鼠 50只雄性无特定病原体(SPF)级,体重(250±20)g,许可证号:SCXK(辽)2015-0001,长春亿斯试验动物中心,严格遵守《延边大学试验动物的保护和使用指南》中的要求,符合动物试验伦理要求;高脂高糖饲料、普通饲料 上海帆泊生物技术有限公司;盐酸二甲双胍片 北京万辉双鹤药业有限责任公司;链脲佐菌素(STZ) 美国Sigma公司;二苯代苦味肼基自由基(DPPH·) 上海化成工业有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+·) 北京索莱宝科技有限公司;一氧化氮清除剂(PTIO) 北京绿源伯德生物科技有限公司;总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和过氧化氢酶(CAT)试剂盒 江苏南京建城生物工程研究所。
HWS-24型电热恒温水浴锅 上海一恒科学仪器有限公司;ScoutSE-SE202FZH型电子天平 常州奥豪斯仪器有限公司;TG16A-WS型离心机 上海卢湘仪器有限公司;CCA-1111-CE 型旋蒸冷凝器东京理化器械株式会社;LyoQuest-55实验型冷冻干燥机 西班牙Telstar集团公司;DTC-22B型真空泵
日本ULUACKIKO公司;九安AG-605血糖仪及血糖试纸 天津九安医疗电子股份有限公司;BKEL10C酶标仪 山东博科生物产业有限公司。
1.2 实验方法
1.2.1 葛根多糖的提取 将葛根破碎,用40目型粉碎机进行粉碎,收集葛根粉末。参考马伟等[21]的方法,采用水提醇沉法对葛根多糖进行提取。按料液比1:20 g/mL,提取时间4 h,100 ℃水提2次,合并2次清液,抽滤,旋蒸,将浓缩液用85%乙醇进行醇沉,收集沉淀,蒸馏水复溶,旋蒸浓缩,采用Sevage法除蛋白,用冻干机进行冻干,收集粉末,按公式(1)计算多糖得率,4 ℃保存备用。
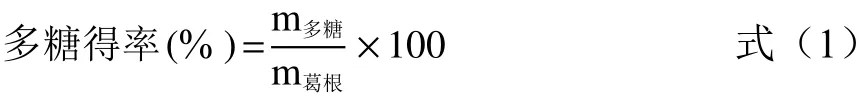
1.2.2 葛根多糖含量的测定 参考纪宝玉等[22]的方法,采用苯酚硫酸法进行多糖含量的测定。将葡萄糖配制成0.02、0.04、0.06、0.08、0.1 mg/mL的浓度梯度,按苯酚硫酸法步骤进行操作,测定490 nm处不同浓度葡萄糖的OD值,以葡萄糖浓度为横坐标,吸光度为纵坐标绘制标准曲线。称量葛根多糖粉末3 mg,蒸馏水定容至10 mL,取1 mL,加入1 mL 5%苯酚和5 mL的浓硫酸,混合后室温放置20 min,测定490 nm处的OD值。并计算葛根多糖含量。
1.2.3 葛根多糖抗氧化性的测定 按朱家庆等[18]的方法稍作修改,将葛根多糖溶于水配制成50、100、200、400、800、1000 μg/mL的溶液,以VC作为对照组,测定葛根多糖DPPH·、ABTS+·、·OH、PTIO的清除能力。
1.2.4 试验动物分组及给药 选取50只SPF级雄性SD大鼠,适应性喂养7 d,喂养7 d后,10只作为正常组,其余40只以30 mg/kg·BW剂量进行腹腔注射STZ,建立T1DM大鼠模型,72 h后进行血糖测定,尾尖取血,弃掉第一滴血,将第二滴血滴到血糖试纸上进行测定,FBG水平>16.7 mmol/L则造模成功[23],将此时定为灌胃0周。将造模成功大鼠随机分为4组,每组10只,包括模型组、葛根多糖高剂量组(100 mg/kg)、葛根多糖低剂量组(50 mg/kg)、阳性对照组(100 mg/kg盐酸二甲双胍),剂量设定参照蔡春沉等[24]的方法。每天进行灌胃,连续灌胃8周,除试验组外,正常组和模型组每天以等量的蒸馏水灌胃,每周记录所有大鼠的体重和FBG。
1.2.5 大鼠OGTT的测定 在灌胃给药8周后,进行OGTT试验,以1 g/kg·BW灌胃葡萄糖,然后以0、30、60、90 min为时间点分别测定大鼠血糖水平,并记录其数值。严格遵守《延边大学试验动物的保护和使用指南》中的要求,符合动物试验伦理要求。
1.2.6 大鼠TC、TG、HDL-C、LDL-C的测定 TC、TG:心脏取血,以4000 r/min,离心10 min,离心后取大鼠血清,依次按试剂盒说明书步骤进行操作,所有反应液混匀后,37℃孵育10 min,于510 nm测定吸光值,根据公式进行计算。HDL-C、LDL-C的测定:取大鼠血清,依次按试剂盒说明书步骤进行操作,所有反应液混匀后,分别孵育5 min,在546 nm测定2次吸光值,根据公式进行计算。
1.2.7 大鼠SOD、GSH、CAT、MDA的测定 心脏取血,以4000 r/min,离心10 min,离心后取大鼠血清,按照试剂盒说明书中操作表进行操作,并用酶标仪测定各指标吸光度,最后按照公式进行计算。
1.3 数据处理
本试验使用SPSS 23.0对整理后的试验数据进行统计学分析,计算各组均值与标准偏差,进行单因素方差分析,所得的数据以图表和均值±标准偏差(X±SD)的形式表示,P<0.05表示有显著性差异。
2 结果与分析
2.1 葛根多糖含量的测定
多糖得率为9.87%,图1为多糖标准曲线,标准曲线方程为y=11.161x+0.001(R2=0.9965),计算出多糖含量为87.80%。
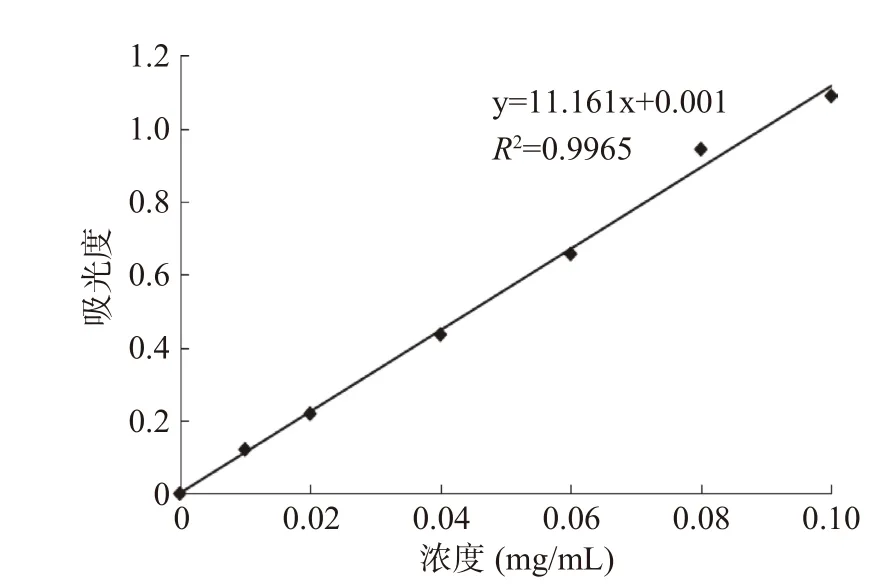
图1 多糖标准曲线Fig.1 Standard curve of polysaccharides
2.2 葛根多糖对DPPH·、ABTS+·、·OH、PTIO的清除能力
通过DPPH·、ABTS+·、·OH、PTIO清除率实验可判断物质的抗氧化能力。图2为葛根多糖在50、100、200、400、800、1000 μg/mL浓度下对DPPH·、ABTS+·、·OH、PTIO的清除能力,葛根多糖对DPPH·、ABTS+·、·OH、PTIO的清除能力与浓度呈正相关,在1000 μg/mL浓度下对DPPH·、ABTS+·、·OH、PTIO的清除能力分别为90.2%、83.3%、81.3%、89.0%。抗氧化性接近VC。可见,葛根多糖有一定的抗氧化性。

图2 葛根多糖对DPPH·、ABTS+·、·OH、PTIO的清除能力Fig.2 The ability of Pueraria lobata polysaccharide to remove DPPH·, ABTS+·, ·OH, PTIO
2.3 葛根多糖对大鼠体重、FBG的影响
由表1可知,在灌胃8周后,与正常组相比,T1DM大鼠的体重均显著降低(P<0.05),经葛根多糖治疗后的糖尿病大鼠体重下降得到有效的缓解,并与二甲双胍显示出相似的治疗效果。表2显示,灌胃8周后,实验组大鼠的FBG均显著高于正常组(P<0.05),但经葛根多糖治疗的T1DM大鼠FBG与模型组相比显著下降(P<0.05),与阳性组间差异不显著(P>0.05)。说明葛根多糖能够有效缓解T1DM大鼠体重的下降,降低其血糖水平。
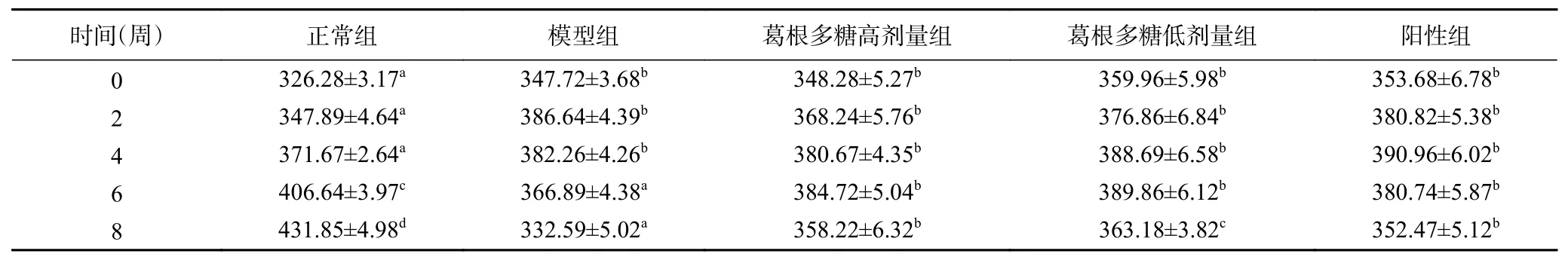
表1 T1DM大鼠体重(g)Table 1 Body weight of T1DM rats (g)
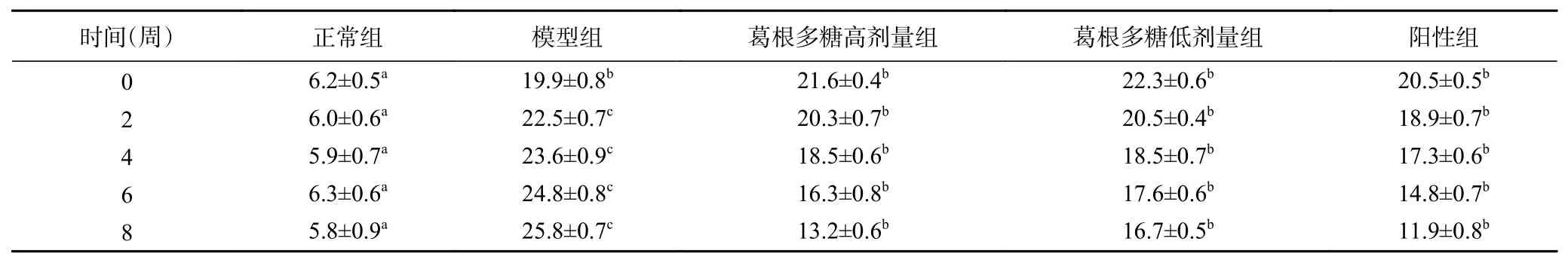
表2 T1DM大鼠空腹血糖值(mmol/L)Table 2 Fasting blood glucose of T1DM rats (mmol/L)
2.4 葛根多糖对大鼠OGTT的影响
糖耐量作为糖尿病的一种重要指标,能够在一定时间内反映出机体对体内血糖浓度的调节能力,反映其葡萄糖耐受能力。图3为OGTT试验结果,结果显示,与正常组相比,T1DM大鼠的FBG水平在0、30、60和90 min时极显著增加(P<0.01),与模型组相比,经葛根多糖治疗后的大鼠血糖水平在30、60和90 min时极显著降低(P<0.01)。这表明葛根多糖能够有效控制大鼠的血糖水平,提高其糖耐量。
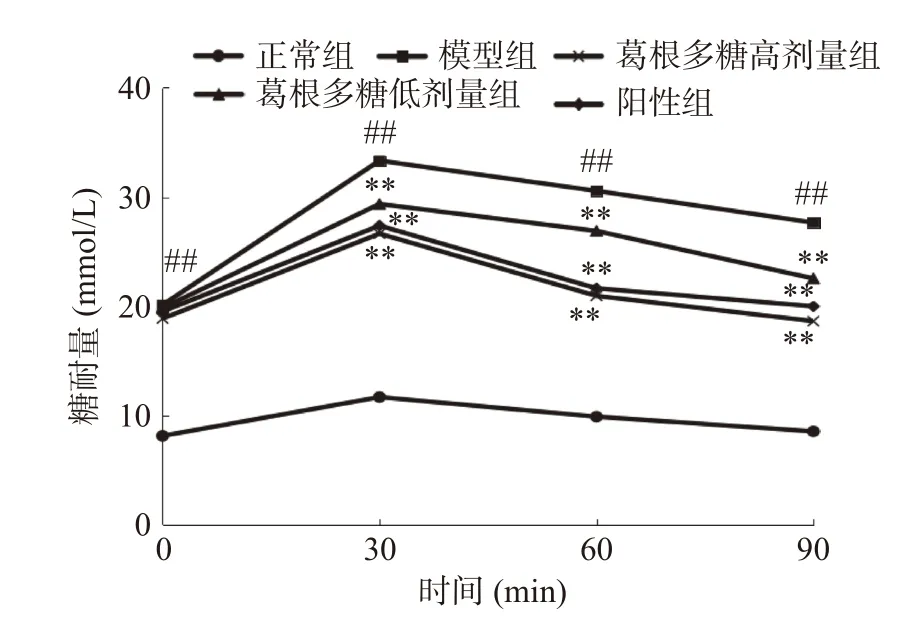
图3 葛根多糖对OGTT水平的影响Fig.3 Effects of Pueraria lobata polysaccharide on OGTT level
2.5 葛根多糖对大鼠TC、TG、HDL-C、LDL-C的影响
血脂异常是胰岛素代谢失调引发的一种现象,胰岛素的缺乏会加速机体内脂肪的分解,脂肪分解所产生的游离脂肪酸进入肝脏生成TG和酮体,会使TC、HDL-C、LDL-C发生变化,最终导致体内血脂异常[25]。如图4所示,经葛根多糖治疗后,能够极显著降低T1DM大鼠TC、TG、LDL-C水平(P<0.01),极显著提高HDL-C水平(P<0.01)。由此可见,葛根多糖能够调节T1DM大鼠的异常脂代谢情况。
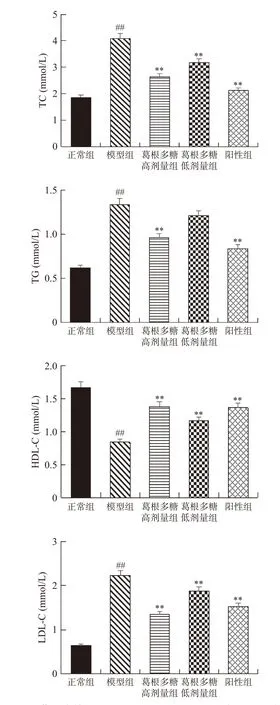
图4 葛根多糖对TC、TG、HDL-C、LDL-C水平的影响Fig.4 Effects of Pueraria lobata polysaccharide on TC、TG、HDL-C and LDL-C level
2.6 葛根多糖对大鼠SOD、GSH、CAT、MDA的影响
研究指出通过调节氧化应激相关酶的活力能够改善胰岛细胞的功能,促进葡萄糖代谢,减少对肝组织的损伤[26−27]。SOD、GSH、CAT和MDA的水平能够间接反映出脂代谢和氧化应激水平。如图5所示,与正常组相比,模型组中SOD、GSH、CAT含量均极显著下降(P<0.01),MDA含量极显著升高(P<0.01),经葛根多糖治疗后可有效恢复T1DM大鼠的SOD、GSH、CAT水平,有效降低MDA水平,且与模型组比较,高剂量葛根多糖组能够极显著提高SOD、GSH、CAT水平(P<0.01),极显著降低MDA水平(P<0.01)。
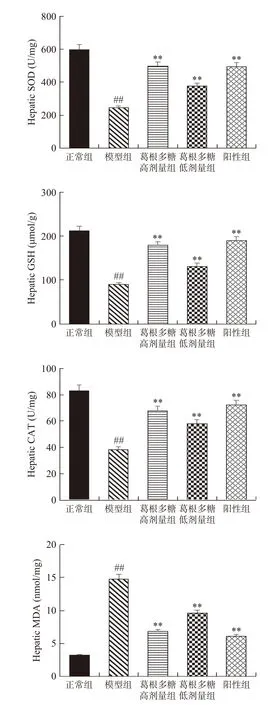
图5 葛根多糖对SOD,GSH,CAT和MDA水平的影响Fig.5 Effects of Pueraria lobata polysaccharide on SOD,GSH, CAT and MDA level
3 结论与讨论
植物多糖又称植物多聚糖,是植物细胞代谢产生的聚合度超过10的化合物,内部存在若干个α-或β-糖苷键,多糖广泛地存在于植物体内,是植物体内重要的活性物质,所以常被应用于食品、保健品中[28]。本试验中葛根多糖的得率为9.87%,测得多糖提取物中葛根多糖的含量为87.80%。
正常情况下,机体氧化还原系统处于动态平衡,当机体处于应激、病理状态时,会产生·OH、DPPH·等强氧化自由基[29]。植物多糖可通过直接或间接清除自由基、提高抗氧化酶活性或降低氧化酶活性起到抗氧化作用。刘雅娜等[30]利用水提醇沉法对沙棘多糖进行了提取,并测定了DPPH自由基清除率和ABTS+·自由基清除率,试验结果表明,沙棘多糖具有良好的抗氧化作用。另有学者研究了芽球菊苣根多糖和山药多糖的抗氧化性,均显示有很强的自由基清除能力[31−32]。本实验中,显示葛根多糖在50~1000 μg/mL范围内对DPPH·、ABTS+·、·OH、PTIO均有一定的清除能力,且与浓度呈正相关,在1000 μg/mL浓度下对DPPH·、ABTS+·、·OH、PTIO的清除能力分别为90.2%、83.3%、81.3%、89.0%。本研究结果与前人研究结果均显示植物多糖具有很好的抗氧化性。
目前公认的病因为在遗传及环境因素共同作用下,由T细胞免疫介导的胰岛β细胞破坏。胰岛β自身免疫破坏过程历时数月到数年,当胰岛β细胞破坏到一定程度时,糖尿病症状出现[33]。植物多糖因其特殊结构,使其具有多途径、多靶点、多向性、毒副作用小的药理优点,能够通过多种机制、多环节作用于糖尿病[34]。植物多糖降血糖的机制主要是增加胰岛细胞数量、促进胰岛素分泌或释放、增加胰岛素敏感性、改善糖代谢等[35]。
T1DM会导致机体内异常脂代谢情况的发生,导致体内TC、HDL-C、LDL-C发生变化[36−38],其中,甘油三酯水平显著升高为1型糖尿病最为突出的脂代谢紊乱表现[39]。研究指出,葛根多糖有着良好的降血脂活性[19]。在本试验中,与正常组相比,T1DM大鼠血清的TC、TG、LDL-C浓度显著增加(P<0.01),而HDL-C浓度显著降低(P<0.01),表明T1DM大鼠出现了异常的脂代谢情况,其原因可能是T1DM大鼠对葡萄糖利用失调,脂肪分解增加,从而产生了大量的游离脂肪酸,组织吸收脂肪酸的能力降低,FFA大量释放到血液和肝脏中,导致TC、TG、LDLC的含量增多。与模型组比较,经葛根多糖灌胃后的T1DM大鼠的TC、TG、LDL-C显著降低(P<0.01),HDL-C显著升高(P<0.01)。葛根多糖促进了组织对脂肪酸的吸收,从而缓解了一场脂代谢的情况。
糖尿病患者机体内氧自由基含量增多,过多的氧自由基与脂质相互作用产生过氧化反应[40]。CAT与SOD在机体中具有较强的抗氧化能力,在体内能够抑制氧自由基的生成,能够减少氧自由基对细胞造成的伤害,并且能够降低MDA的生成量[41]。在本试验中,与正常组相比,T1DM大鼠血清的MDA浓度显著增加(P<0.01),而SOD、GSH、CAT浓度显著降低(P<0.01),表明T1DM大鼠出现了氧化应激反应。与模型组大鼠相比,葛根多糖治疗后能够显著抑制这些标志物的变化,可能是通过调节体内相关酶的水平从而提高了清除自由基的效果。
由此,我们认为,葛根多糖具有良好的抗氧化活性,并可以通过调节T1DM大鼠脂代谢及氧化应激反应,从而降低T1DM大鼠血糖。

