汾河太原段沉积物氮、铜、铝含量及酶活性的分布及动态
裴海光,贾自强,杨静,吕俊平,刘旭东,谢树莲,冯佳
(山西大学 生命科学学院,山西 太原 030006)
0 引言
沉积物既是水生态系统中氮元素转化和储存的重要场所,同时也是金属等污染物的汇聚场所[1-4]。氮元素是水生态系统重要的营养限制因子,也是水体富营养化的重要物质基础,其含量也可以反映水质的好坏。沉积物金属具有不可降解、高毒性、易富集的特点,是水环境体系最主要的污染物之一。当沉积物中部分金属含量释放到水体中,会对水生态系统产生危害[5-6]。沉积物中的微生物分泌出具有催化作用的酶类,是沉积物中能量流动和物质循环的重要参与者。酶活性可用于表征沉积物生物活性,也可以作为沉积物生态过程和环境胁迫的敏感指标,相关研究显示沉积物中酶活性与氮素含量呈正相关[7-9]。外源金属会对沉积物中的酶活性产生一定的活化或抑制作用,间接地对氮源的转化产生影响[10-13]。测定沉积物中氮、金属含量的累积程度以及各区域酶活性等参数,来研究沉积物中氮源、金属及酶活性的空间分布规律并判断外源性输入的高低,对于评估汾河沉积物健康状况具有重要意义。
汾河太原河段处于汾河流域中段,自北向南穿过太原城,对城区的纳污泄洪、调节小气候、提供水资源等方面具有不可替代的作用。随着工业发展和城市人口的迅速膨胀,沿线工农业废水、汛期地表雨污等污染物不断排入,导致水质恶化,其污染程度大大超出了水体的自净能力,水体富营养化日益严重,且多年的污染物沉积到河底,汾河周边企业在水处理过程中使用的净水剂主要成分为硫酸铜和聚合氯化铝,长期排放沉积在底泥中,使汾河沉积物受到了严重污染。因此,本文通过对汾河太原段沉积物中氮含量、铜含量、铝含量以及酶活性的研究,掌握它们在汾河太原段的空间分布特征,结合相关性分析,为汾河流域的水体富营养化防治提供一定的科学基础和数据支持。
1 材料与方法
1.1 研究区域及采样点的设置
汾河太原段自北向南横穿太原市区,属于汾河水系,全长30 km,水深平均2 m~3 m,最深6 m,为人工复式河槽,排泄上游洪水和水库灌溉输水。东西两岸各布置一条箱形排污暗涵,接纳沿线城市排污管道和边山支沟来水,送至下游污水处理厂进行净化处理。
分别于2018年3月、6月、9月、12月的中旬,在汾河太原段上游至下游依次设置的7个采样点采样,分别为胜利桥北(S1),胜利桥-漪汾桥(S2),漪汾桥-迎泽桥(S3),迎泽桥-南内环桥(S4),南内环桥-长风桥(S5),长风桥-南中环桥(S6),南中环桥-祥云桥(S7)七个区域(图1),其中S1采样点是汾河进入太原市区的最北端,S7采样点是汾河在太原市区的最南端,用蚌式采样器分别采集7个区域的河流底泥表层样品,放入塑料袋中,标记保存。
图1 汾河太原段采样点分布Fig.1 Distribution of sampling area in the Taiyuan Section of Fenhe River,Shanxi
1.2 样本的处理与指标测定
将采集的底泥分为两份,一份在4℃下冷藏保存用于沉积物的酶活性测定,另一份在低于40℃的鼓风干燥箱中干燥,研磨,过100目土壤筛[14],置于塑封袋中,标记、保存。总氮采用过硫酸钾消解法测定,铵态氮采用KCl浸提蒸馏法测定,硝态氮采用紫外分光光度法在220 nm和275 nm处测定[15-22]。蛋白酶活性采用福林-酚法在紫外分光光度计上于波长680 nm测定,脲酶活性用靛酚蓝比色法在波长578 nm测定[23-25]。
金属铜和铝的检测:准确称取0.2 g样品,放入消解罐中,加入2 mL氢氟酸和6 mL盐酸和硝酸,充分混匀,放置,冷却,MASTER-40型微波消解仪消解,等离子电感耦合质谱仪进行沉积物中金属铜和铝的检测[26]。
变异系数分析:变异系数=标准差/均值×100%[21]。所有样品测定重复3次,且实验数据均取3次结果平均值,误差控制在5%以内。
1.3 数据分析
使用Excel 2016、Origin 2018软件对数据进行整理和作图,应用SPSS 21.0软件进行数据方差分析和相关性分析。
2 结果与讨论
2.1 氮元素含量的区域特征及季节变化
氮是城市水体富营养化的限制因子之一[27],氮含量在很大程度上可以反映出沉积物的营养水平[28]。汾河太原段属于典型的城市富营养化水体,沉积物总氮含量为6.289 8 mg/g~69.252 7 mg/g(图2a)。根据美国环境保护署(EPA)制定的分类标准,TN平均值在1 mg/g以下,属轻度污染或清洁区域;在1 mg/g~2 mg/g间属中度污染,2 mg/g以上属重度污染[29]。汾河太原段各区域总氮含量均值大于2 mg/g,属重度污染,相比宜兴市横山水库底泥总氮平均含量2.778 mg/g[30],以及衡水湖沉积物总氮平均含量1.850 mg/g[31],汾河太原段沉积物的总氮含量相对较高。汾河沉积物季节间的总氮平均含量差异显著(P<0.05),各季节总氮平均含量大小依次为春季>夏季>秋季>冬季,随季节变化呈递减趋势(图2b)。不同采样点总氮含量分布具有明显的空间差异性,从上游到下游,四个季度的总氮含量都呈先升高后降低再升高的趋势。上游S2-S3区域总氮含量要高于S1,这是由于在S2区域有一条支流北沙河汇入汾河太原段,北沙河沿岸大片居民区,生活污水排入北沙河而进入汾河,使得S2-S3区域全年总氮含量相对较高。在汾河太原段下游S5区域,有一条支流九院沙河汇入,夹杂着上游处理未达标的生活污水,导致下游的总氮含量高于汾河太原段的中心区域[32]。这与洱海流域沉积物总氮含量的分布是外源污染物输入后在水体动力作用下不同区域沉降的结果相似[7]。
各区域沉积物硝态氮含量在0.004 6 mg/g~0.137 4 mg/g之间(图 2c),属于重度污染[31]。各季节硝态氮平均含量变化依次为春季>夏季>冬季>秋季。沉积物夏、秋、冬季间的硝态氮平均含量差异不显著,春季的硝态氮平均含量显著高于其他三季(P<0.05)(图2d)。各区域沉积物铵态氮含量为0.021 5 mg/g~0.327 1 mg/g(图2e),各季节铵态氮平均含量大小依次为春季>夏季>秋季>冬季,随季节变化呈递减趋势。沉积物夏季、秋季、冬季之间的铵态氮平均含量差异不显著,而春季的铵态氮平均含量显著高于其他三季(图2f)。

图2 汾河太原段沉积物总氮(a和b)、硝态氮(c和d)、铵态氮(e和f)含量的时空分布,图中不同字母代表组间差异显著(P<0.05)Fig.2 Temporal and spatial distribution of total nitrogen(a and b),nitrate nitrogen(c and d),ammonium nitrogen(e and f)in sediments of Taiyuan Section of Fenhe River,Shanxi.Different letters represent significant differences between groups(P<0.05)
通过对汾河太原段沉积物氮元素分析,并与其他典型富营养化湖泊对比[33-34],表明汾河太原段底泥受到了严重的氮源污染。春季各区域沉积物氮元素含量均显著高于其他季节(P<0.01),由于含氮污水主要通过暗涵排入汾河沉积在底泥表层,冬季河面大部分时间处于冰封状态,河道淤泥得不到清理,使得沉积物氮含量在冬季大量积累[32,35]。随着春夏雨季的到来,汾河水位的抬升导致厌氧环境受到限制,也是汾河太原段沉淀物氮含量随季节变化的重要原因。每个季节的沉积物总氮含量受外源污染物输入的影响,在空间分布上有一定的规律,而硝态氮和铵态氮没有明显的规律。通过变异系数分析,四个季节都是硝态氮含量的区域变异系数最高,铵态氮次之,作为可以被藻类直接吸收的氮源,其含量在区域间的差异是造成汾河太原段区域间水体差异性的主要原因。沉积物中各种水解酶的活性差异可能是造成区域间硝态氮和铵态氮含量差异的主要原因[7]。闫兴成等[2]研究表明沉积物的疏浚不仅能消减沉积物内源氮的负荷,还能有助于减少湖泊近岸CO2等温室气体的排放。因此,可以适当对汾河底泥进行疏浚。
2.2 汾河太原段沉积物酶活性的季节特征
沉积物中的动植物、微生物在其生命活动过程中向胞外分泌具有催化作用的酶类,会参与沉积物中生源要素的生物循环、腐殖质合成及其他有机质分解[36-37]。此次研究我们对汾河太原段沉积物中的酶活性进行了检测(图3)。
蛋白酶主要参与沉积物中含氮有机化合物转化,其水解产物是高等植物的氮源之一[7,9]。汾河太原段各区域沉积物蛋白酶活性为0.020 8 mg/g~0.789 5 mg/g(图 3a),蛋白酶活性大小依次为秋季>夏季>春季>冬季。夏季和秋季的酶活性都显著高于冬季(P<0.05)。在夏季和冬季,中下游间的蛋白酶活性显著低于周边区域(P<0.05)。

图3 汾河太原段沉积物蛋白酶(a)、脲酶(b)活性的区域分布及季节分布(c),图中不同字母代表组间差异显著(P<0.05)Fig.3 Regional distributions of protease(a)and urease(b),seasonal distribution(c)of protease and urease activities in the sediments of the Taiyuan Section of Fenhe River(c).Different letters represent significant differences between groups(P<0.05)
脲酶是一种水解性酶,能够提高沉积物氮素利用率,促进沉积物氮素循环[7-9]。各区域沉积物脲酶活性为0.091 6 mg/g~3.397 3 mg/g(图3b),各季节脲酶活性依次为夏季>春季>秋季>冬季,中心区域的酶活性相对较低。冬季各区域沉积物脲酶活性均比其他三个季度低(P<0.01),因为沉积物脲酶活性来源于微生物,水生植物密度的分布会影响沉积物中微生物种类和数量,从而对脲酶的活性产生一定的影响[9]。
图3c为汾河太原段沉积物酶活性的季节特征,其中脲酶活性在四季均比蛋白酶高,表明脲酶参与生源要素的生物循环效率相对较高,蛋白酶在季节间变化相对稳定。通过对各季节沉积物酶活性区域变异系数分析,冬季蛋白酶活性区域差异要高于脲酶。不同季节,沉积物中酶活性的高低与季节间温度的差异有很大关系,两种酶在冬季活性均为最低,表明酶活性在冬季均受到低温影响。甘茂林等[9]对大亚湾的研究认为,植物对沉积物中微生物的种类和数量有重要影响,酶活性与沉积物中分布的植物密切相关。在汾河太原段,由于人工清理水草,密度较低,导致沉积物中微生物活动相对较低,酶活性较弱。此外,汾河太原段还承担着城市泄洪排涝功能,沿岸还有分布不均的污水处理厂,大量处理未达标废水排入汾河[32],其中掺杂着金属元素沉积到底泥中,与酶分子的巯基、胺基和羧基的结合,抑制酶的活性[10-11]。
2.3 汾河太原段沉积物铜、铝含量季节特征
沉积物是底栖生物的主要生活场所和食物来源,其中的金属会直接或间接地对水体和底栖生物致毒致害,并通过生物富集、生物链放大等途径进一步影响到其他生物及人类[38-39]。汾河太原段各区域沉积物中铝含量检测结果为2.559 6 mg/g~20.693 mg/g(图 4a),比云南阳宗海表层沉积物的均值0.045 4 mg/g要高[3],各季节铝元素的平均含量依次为春季>秋季>夏季>冬季。春季汾河太原段的铝平均含量显著高于其他季节(P<0.01),夏季和冬季间差异不明显(图4b)。在春季,上游S1区域及中心区域的含量显著高于其他区域(P<0.05);秋季中心区域的含量显著高于其他区域(P<0.05)。
汾河太原段各区域沉积物中铜含量检测结果为 0.053 4 mg/g~0.300 7 mg/g(图 4c),介于重金属污染二级和三级标准之间,属弱-中等污染[40],各季节铜平均含量依次为秋季>夏季>冬季>春季。汾河太原段沉积物铜含量在秋季要显著高于其他季节(P<0.05)(图4d),而其他季节大部分区域间并无显著性差异。
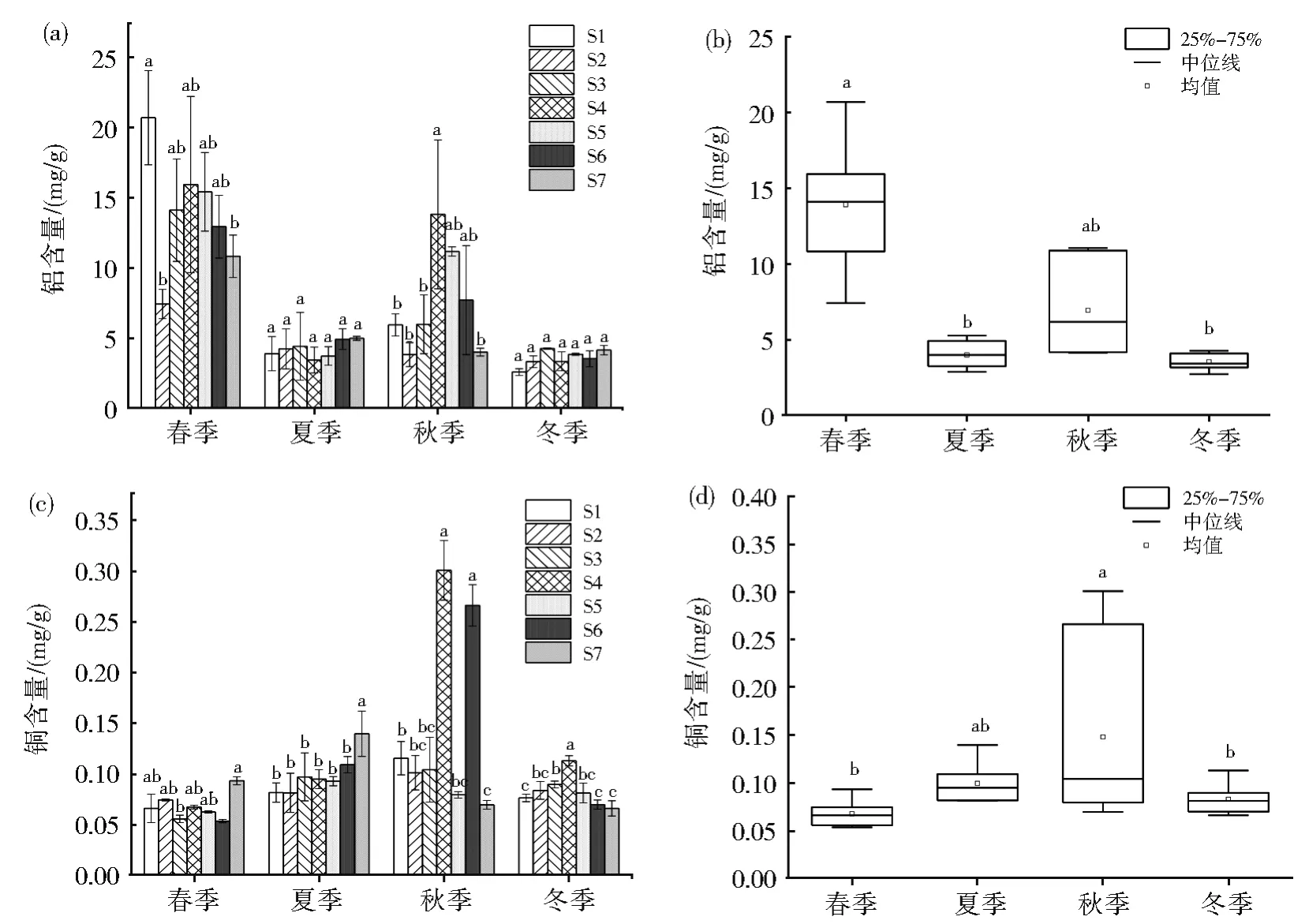
图4 汾河太原段沉积物金属铝(a和b)、铜(c和d)含量的时空分布,图中不同字母代表组间差异显著(P<0.05)Fig.4 Temporal and spatial distribution of aluminum(a and b)and copper(c and d)contents in the sediments Taiyuan Section of Fenhe River,Shanxi.Different letters represent significant differences between groups(P<0.05)
对春秋季节铝含量和铜含量的区域变异系数分析表明,两种金属区域间的变化和分散水平比较显著,人类活动对金属区域分布作用明显[41]。受地区经济发展影响,太原市区汾河干流入河排污口有22个,其中工业及混合排污口有5个[32],春秋季汾河水位较低,河段间流动性较差,当含重金属的工业废水排入汾河,使排污口附近区域的底泥金属含量超标[42],区域间差异明显。与云南阳宗海沉积物相比[3],汾河太原段沉积物中金属铝和铜含量更高,除了常年的自然积累,最主要金属污染物来源于边山支沟及污水的排入。据统计,太原市年均排污量达8.85亿t,由于太原市排污管网不完善、污水处理厂的数量以及处理能力有限,其中不达标排放的就有2.59亿t,约占1/3,多年的排放,长期积累沉积在底泥中,影响水体环境质量[32,35]。
2.4 汾河太原段沉积物氮元素、酶活性与金属含量相关性特征
脲酶和蛋白酶是参与沉积物氮循环的关键酶[43]。脲酶主要催化水解进入沉积物中的尿素及动物尿为氨等,蛋白酶主要参与沉积物中蛋白氮及其他含氮有机物的转化,诸多研究表明沉积物中酶活性随氮含量输入的增减而增减[7-9]。酶需要一定量的金属离子作为辅基,金属的加入能促进酶活性中心与底物间的配位结合,进而增强酶的活性;相反,如果金属与酶分子的巯基、胺基和羧基的结合,酶的活性会受到抑制。本研究表明铝含量远高于铜含量,且铜含量与酶活性之间没有显著的相关性,而脲酶活性和蛋白酶活性均与铝含量呈显著负相关(表1,P<0.05),表明沉积物中的铝抑制了酶的活性[10]。
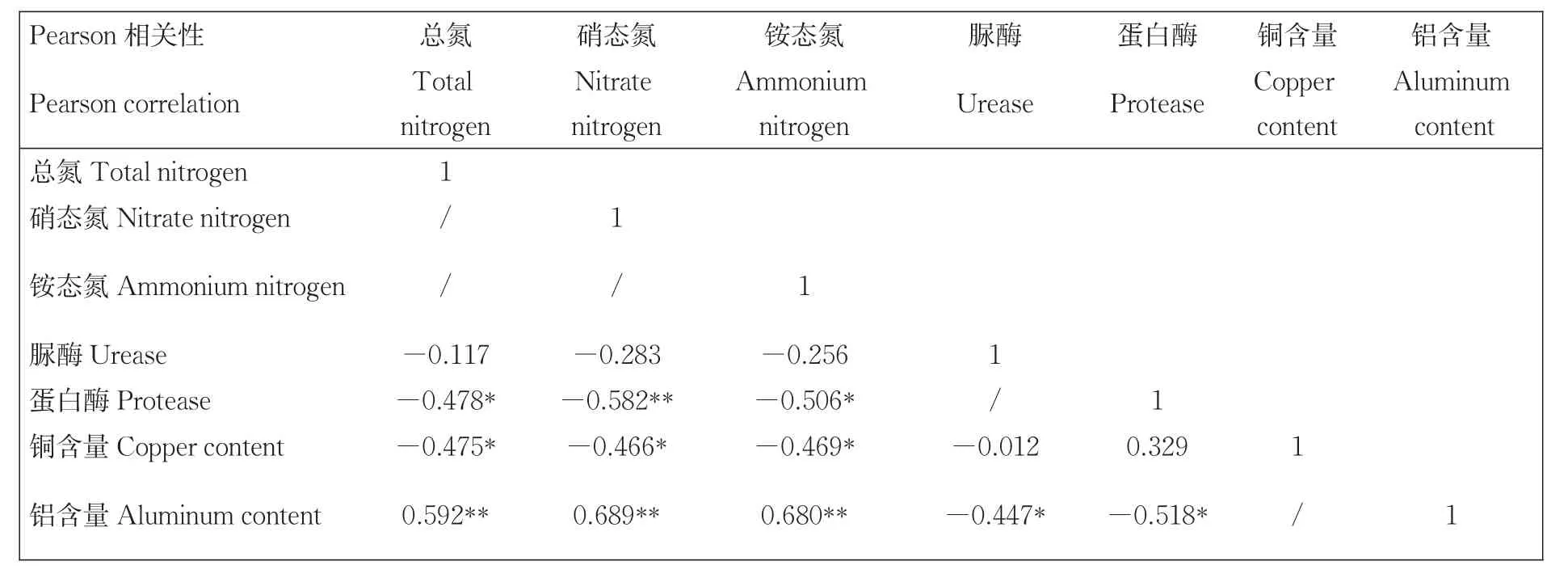
表1 沉积物中氮元素、酶活性与金属含量相关分析Table1 Correlation analysis of nitrogen elements,enzyme activities and heavy metal contents in sediments
金属铜与氮含量呈显著负相关(P<0.05),金属铝与氮含量呈极显著正相关(P<0.01)。这说明各沉积物中氮与金属铝的累积程度关系更为密切,与李照全等[44]研究结果相似。脲酶活性与总氮、硝态氮、铵态氮等3种氮含量间均呈负相关;蛋白酶活性与总氮、硝态氮、铵态氮三种氮含量均为显著负相关(P<0.05),是因为水体在输入污染物时,随着氮含量的升高,污水中掺杂的金属抑制了酶的活性,导致酶活性与氮含量呈负相关。
3 结论
通过对2018年度汾河太原段沉积物的研究显示:
(1)在空间分布上,汾河太原段总氮含量从上游至下游呈先升高后降低再升高的趋势,硝态氮和铵态氮含量,以及沉积物中铝和铜含量无明显分布规律。蛋白酶和脲酶活性在汾河太原段中心区域要低于其他区域。
(2)在季节上,三种氮素含量均在春季最高;铝含量在春季最高,铜含量在秋季最高;蛋白酶活性在秋季最高,脲酶活性在夏季最高,两种酶活性均在冬季最低。
(3)受外源输入影响,汾河太原段沉积物受到氮源和铜污染,同时由于沉积物中铝含量相对较高,对沉积物中的酶活性产生一定抑制作用,降低了沉积物中水解酶对氮源的转化,氮素、铜和铝在沉积物中的长期积累,有引起二次污染的风险,建议相关部门加强对汾河的监管。

