BRs在植物响应非生物胁迫中的作用
李文姣 张忠峰 刘青 孙洁 杨利 王兴军 赵术珍
(1. 山东师范大学生命科学学院/山东省逆境植物重点实验室,济南 250014;2. 山东省农业科学院农作物种质资源研究所/山东省作物遗传改良与生态生理重点实验室,济南 250100;3. 山东农业工程学院,济南 250100;4. 山东省利津县北宋镇人民政府,利津 257439)
植物在生长发育过程中会受到各种生物和非生物胁迫,通过多种信号分子(如植物激素)以及它们的信号级联反应对胁迫进行响应,调整其生长和发育状态。研究表明,油菜素甾体(brassinosteroids,BRs)不仅在种子萌发、根冠生长、开花,以及果实发育等过程中起着重要的调控作用,还参与了植物对干旱、高盐、高温、低温和重金属等非生物胁迫的应答。本文重点阐述了BRs参与非生物胁迫应答的分子机制,并对BRs今后的研究方向进行了展望,为深入理解BRs介导的非生物胁迫调控网络、提高作物抵抗非生物胁迫的能力提供参考。
1 BRs的生物合成
1970年,油菜素首先在油菜(Brassica napus L.)花粉中被分离[1],之后发现它能够促进大豆和其他植物的生长[2]。1979年,Grove等[3]鉴定了其分子结构,确定其结构属于甾醇类化合物,并将其命名为油菜素内酯(brassinolide,BL),成为第六大类植物激素。BRs主要是指具有生物活性的BRs的生物合成中间体和分解代谢产物,如BL和油菜素甾酮(castasterone,CS)。其中BL由一种称为环蒿醇的甾醇前体经过甲基化、还原和去饱和等一系列的化学反应,形成BRs特有的前体芸苔甾醇(campesterol,CR)[4]。CR 首先转化为油菜烷醇(campestanol,CN)[5],然后通过2条平行的途径转化为BL。这两条途径分别称为早期和晚期C-6氧化途径(图1)。在早期C-6途径中,CN转化为6-氧油菜烷醇(6-oxoCN),然后,羟化形成长春花甾酮(cathasterone,CT),再转化为茶甾酮(teasterone,TE),进一步形成香蒲甾醇(typhasterol,TY),随后被氧化为CS[6]。晚期的C-6途径中,CN首先在C-22处羟基化形成6-脱氧CT(6-deoxoCT),然后转化为早期C-6氧化途径中以C-6脱氧形式存在的相应中间体,最后经过C-6氧化作用形成CS和BL。而在早期的C-22途径与CR到CN同时发生,又被称为CN独立途径。DWF4(DWARF4)是催化C-22位羟化作用的关键酶,CR到CN的许多中间产物可在C-22位羟化形成相应的C-22羟基形式,该步骤受DWF4催化,也是BR生物合成的限速步骤。其产物再通过一系列的反应进入晚期C-6氧化途径,最终形成CS和BL[7]。

图1 BRs的生物合成途径模式图Fig. 1 Biosynthetic pathway pattern of BRs[6-7]
2 BRs的信号转导途径
BRI1(brassinosteroid insensitive 1) 是 一 个 富含亮氨酸重复序列的类受体蛋白激酶(leucine-rich repeat receptor-like protein kinase,LRR-RLKs),也是BRs信号转导的受体,可以在细胞外感知BRs信号[8]。当植物体内缺乏BRs时,BKI1(BR-signaling kinase 1)结合并抑制BRI1的功能,同时,BRs信号通路关键负调控因子BIN2(brassinosteroid-insensitive 2) 磷 酸 化 BZR1(brassinazole resistant 1)/BES1(BRI1-emssuppressor 1)蛋白并使其失活,促进其与14-3-3蛋白的结合,并导致其在细胞质滞留和降解[9]。而当植物体内存在BRs时,BRs结合并激活BRI1, 触 发 BRI1-BAK1(brassinosteroid insensitive 1-associate-dreceptor kinase 1,也称为 SERK3(somatic embryogeneptor kinase 3))异二聚体的形成,进而增强了BRI1的活性。激活的BRI1与BRs信号抑制因子BKI1分离,并通过一系列磷酸化反应将BRs信号传至BSK1(BR-signaling kinase 1)和CDG1(constitutive differential growth 1),BSK1激 活 磷 酸酶BSU1(BRI1-suppressor 1),从而磷酸化BIN2并使其失活,最终促进植物特异性转录因子BZR1和BES1的活性和稳定性,直接控制BRs下游基因的转录[10],从而调节植物的生长发育过程以及逆境胁迫的应答。
3 BRs在非生物胁迫应答中的作用机制
BRs广泛存在于植物体内,不但参与种子萌发、开花、根冠生长、以及果实发育等生物学过程,还可以通过提高植物的光合能力进而提高作物的产量和品质,在农业生产上有广泛的应用[11]。然而,近年来,BRs参与逆境胁迫(特别是非生物胁迫的应答反应)及其机理(图2)研究成为研究BRs的热点领域[12]。
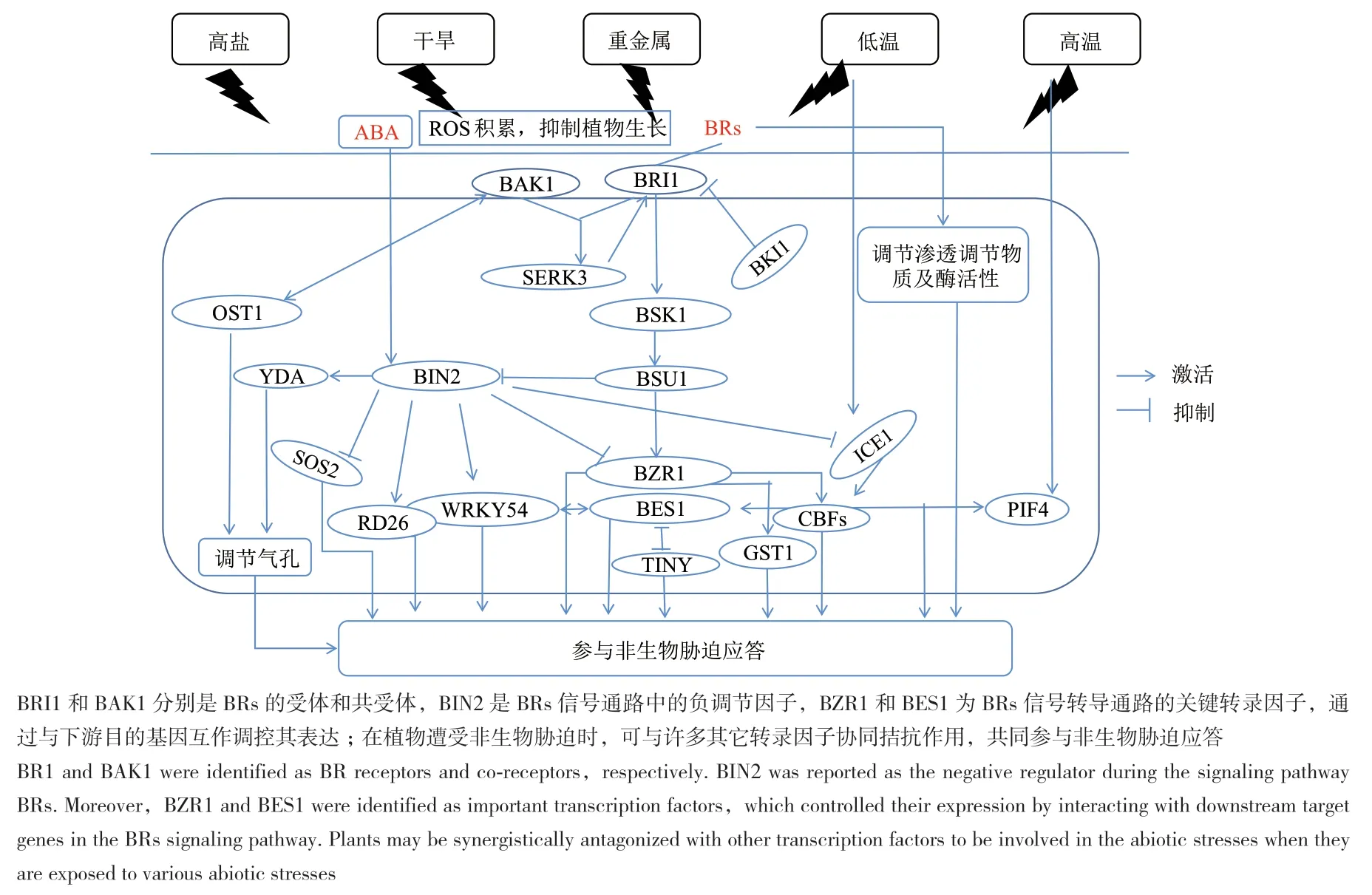
图2 BRs对非生物胁迫的应答Fig. 2 Response of BRs to abiotic stress
3.1 BRs调控盐胁迫应答机制
盐胁迫是最常见的非生物胁迫之一,影响植物的种子萌发及生长发育全过程,是限制世界各国农作物产量的重要因素。全球20%以上的耕地受到盐胁迫的影响,土壤盐分首先引起渗透胁迫,抑制植物幼苗的生长,然后产生离子毒害,从而加速叶片衰老[13]。在盐胁迫条件下,植物通过调节自身的生理生化状态以及相关基因的表达来维持自身的正常生长。BRs信号可以通过调节气孔密度和气孔导度来调控高盐条件下的失水。丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路在气孔发育中起着关键作用。当BRs水平较低时,BIN2磷酸化YDA(MAPKKK)并使其失活,进而启动气孔发育;当BRs水平较高时,BRs信号通过BRI1、BSK1和BSU1使BIN2失活,抑制MAP激酶途径的激活和气孔的发育[14]。BRs共受体BAK1可以与OST1(OPEN STOMATA1)相互作用正向调节ABA诱导的气孔关闭;脱落酸(abscisic acid,ABA)信号分子ABI1可以与BAK1相互作用并抑制BAK1和OST1的相互作用,最终抑制气孔关闭[15]。研究表明,BRs可以通过调节乙烯生物合成来提高植物耐盐性。在盐胁迫条件下,BRs预处理通过增强乙烯合成酶的活性来诱导乙烯的产生,从而提高植物的耐盐性;阻断乙烯合成会抑制BRs诱导的抗氧化酶活性,从而降低植物的耐盐性[16-17]。拟南芥DET2编码一种BRs生物合成酶,催化C-22途径中的还原反应,det2-1突变体在种子萌发和生长早期均对盐胁迫敏感,外源添加10 nmol/L EBR可部分缓解其盐胁迫伤害,这说明合适的BRs含量能够提高拟南芥的耐盐性[18]。BRs信号调节耐盐性的作用可能是由BRI1介导的,拟南芥泛素结合酶UBC32通过影响BRI1的积累参与了BRs介导的盐胁迫反应。拟南芥bri1-9突变体对盐胁迫敏感,而bri1-9UBC32双突变体部分缓解了bri1-9对盐胁迫的敏感性,UBC32突变体的耐盐能力提高可能是由于BRI1蛋白的积累增强了BRs信号[19]。BIN2可以通过抑制SOS2激酶活性,进一步抑制盐胁迫反应[20],BZR1正向调控番茄的耐盐性,并上调多种胁迫相关基因的表达[21]。另外,在盐胁迫下,拟南芥植株通过BZR1在细胞质中的脱酰胺化,促进BZR1靶向SUMO蛋白酶ULP1a的积累,从而抑制植物的生长。而BRs处理使ULP1a降解,使SUMO化BZR1积累并促进植物生长[22]。以上研究表明,BRs通过BRI1、BIN2、BZR1不仅与其他激素信号(如乙烯)协同作用调控植物的耐盐性,而且通过泛素化途径调控逆境胁迫相关蛋白水平对盐胁迫作出响应。但是,目前BR调控植物对盐胁迫的响应通路并未完全解析,哪个因子起决定性作用仍不清楚。
3.2 BRs调控干旱胁迫应答机制
水分在植物的生长发育过程中至关重要,干旱胁迫严重威胁农作物的产量和品质[23]。Wang等[24]研究揭示,BRs在植物抗旱性中的作用主要是与ABA信号的互作。BIN2是BRs信号通路关键负调控因子,ABA信号通过抑制ABI1和ABI2对BIN2的去磷酸化来抑制BRs信号。在胁迫条件下或ABA存在时,ABA与其受体的结合激活SnRK2s和BIN2,从而激活ABA信号并抑制BRs信号,抑制植物生长发育[24]。小麦BES/BZR家族转录因子TaBZR2通过激活TaGST1(T. aestivum glutathione s transferase 1)来清除超氧阴离子(O2-),从而提高小麦耐旱性,并介导BRs和干旱信号通路之间的互作。与野生型相比,干旱条件下BRs介导的O2-清除能力在TaBZR2过表达植株中增强,而在TaBZR2 RNAi植株中降低,说明TaBZR2通过减少O2-的积累部分参与BRs介导的干旱反应[25]。研究发现,WRKY54是BRs途径的正调节因子,与BES1相互作用,共同调控BRs靶基因的表达,并且通过抑制脱水诱导基因表达负调控植物的抗旱性。在干旱条件下,WRKY54被BIN2磷酸化,抑制WRKY54对干旱响应基因的诱导,从而提高植物抗旱性[26]。TINY是拟南芥AP2/ERF家族中的脱水反应元件结合蛋白,在胁迫反应中起着重要作用。在干旱条件下,TINY促进ABA诱导的气孔关闭、激活干旱响应基因的表达,并通过TINY-BES1拮抗作用抑制BRs介导的生长[27]。RD26是BES1的一个靶基因,负调控BRs信号通路。在正常条件下,BRs信号通过抑制RD26的表达来抑制干旱响应途径;在干旱胁迫下,RD26上调以抑制BRs诱导的生长,从而增加耐旱性。这种相互抑制机制不仅保证了干旱条件下BRs诱导的生长受到抑制,而且防止了植物在BRs诱导生长时激活不必要的干旱响应[28]。此外,RD26的功能由GSK3样激酶BIN2和ABI1调节,BIN2可以磷酸化并稳定RD26以促进干旱胁迫响应[29]。BRs对于干旱胁迫的调控是多方面的,包括与ABA的互作、胁迫响应基因的应答以及气孔关闭等。总之,BRs介导的干旱反应是复杂的,未来的研究需要分析各个BRs信号分子的作用,并解析它们如何在正常条件与干旱适应之间的转换平衡。
3.3 BRs调控温度胁迫应答机制
温度是影响植物生长发育的重要环境因素。对于许多植物来说,温度的轻微变化就能引起其生长发育的变化。在植物生长允许范围内,温度升高导致的幼苗下胚轴和叶柄伸长、叶柄发育不良、开花成熟加速,统称为热形态发生[30]。而超过植物生长允许范围的温度会导致冷胁迫或热胁迫,从而引发应激反应。近期研究表明,BRs的生物合成和信号传导受到温度的影响,并参与热形态发生和对温度变化的适应。
低温胁迫是影响植物生长发育的重要环境因子。一些温带植物物种,可以通过冷适应过程来提高其抗冻性[31]。冷调节基因(cold regulated,COR)在植物对冷胁迫的耐受性中起着重要作用,其中许多基因编码保护细胞免受冻害的低温保护蛋白。拟南芥COR的冷诱导表达是由一种称为C重复(C-repeat,CRT)/脱 水 反 应 元 件(dehydration responsive element,DRE)的DNA调控元件介导的,CRT/DRE结合因子1(C-repeat binding factor 1,CBF1)是调节冷适应反应的调节因子,控制COR表达水平,进而提高抗冻性[32]。当植物暴露在低温下时,触发CBF转录因子家族的表达,CBF在15 min内迅速被诱导,随后下游靶基因COR被激活,进而激活许多调控植物耐冷和抗冻性的下游基因[33]。一些转录因子在冷应激下正或负调节CBF的表达。ICE1(inducer of CBF expression 1)是CBF3的正调控因子,在冷适应中起关键作用。研究表明,BRs信号参与了植物的抗寒性。冷应激对BIN2介导的转录因子ICE1、BZR1和CESTAs有抑制作用,BIN2的激酶活性在冷处理的早期(1 h内)受到抑制,随后恢复,使CBF基因在冷应激反应的早期阶段被诱导,而在冷胁迫反应期间BIN2促进了ICE1的降解,ICE1的功能缺失突变部分抑制了冷诱导的CBFs表达,从而提高了抗寒性[34]。另外,BZR1可以通过CBF依赖和非CBF依赖途径正向调节植物的抗寒性[35]。BZR1作用于CBF1和CBF2的上游,直接调节它们的表达;BZR1还调节与CBF不耦合的其他COR基因(如WKRY6、PYL6、SOC1、JMT和 SAG21),以调节植物对冷胁迫的反应[35]。NBR1是一种选择性自噬受体,在阻止冷诱导蛋白聚集体的积累中起着重要作用。在番茄中的研究结果表明,BRs及其信号分子BZR1通过诱导番茄植株自噬和NBR1的积累影响植物对冷胁迫的耐受性[36]。以上研究表明,BRs对低温胁迫的应答主要与CBF相关,将来对于各个BRs信号分子与CBF的互作研究是十分必要的。
高温(高于生长允许范围)导致热胁迫,是限制植物生长、代谢和生产力的主要环境胁迫因素。热胁迫影响植物萌发、生长、发育、繁殖和产量等各个方面,导致ROS的过度积累,以及脂质、蛋白质和DNA的氧化损伤[37]。近年来,人们尝试用不同的方法在植物中诱导耐热性,如诱导热休克蛋白(HSPs)的表达,对热胁迫的预处理和外源性渗透保护剂或植物生长调节化合物的应用[38]。研究表明,外源施用BRs可以通过促进光合作用、保持膜完整性和保持适当的氧化还原状态来增强耐热性[39]。BRI1是BRs信号的受体,长期的热胁迫下,植物会通过降低BRI1的水平来影响根系生长,bri1-301是一种对温度敏感的错误折叠蛋白,温度升高会降低bri1-301的蛋白质稳定性和生化活性[40]。与野生型及其他BRs突变体相比,bes1突变体对热胁迫最敏感,而且ABA含量更高,而施加EBR可以减轻bes1突变体的热胁迫伤害[41]。另外,温度升高导致PIF4的转录增加,使BES1与PIF4结合,PIF4-BES1复合物在BES1二聚体蛋白上占主导地位。大量的BES1-PIF4复合物激活参与热形态发生的基因[42]。BRs还可以通过转录因子BZR1在热胁迫中发挥作用,在高温下,BZR1聚集在细胞核中,诱导促生长基因的表达。BZR1还可与PIF4的启动子结合,诱导其表达,从而调节热胁迫[43]。BES1和BZR1均可与PIF4共同调控高温胁迫,可见BRs受体及其下游信号分子在调节温度胁迫的生长反应中具有明显作用,因此,解析各个BRs分子调控作物逆境反应的机制是今后研究的一个重要方向。
3.4 BRs调控重金属胁迫应答机制
人类活动和工业生产导致重金属对环境的污染越来越严重。重金属对植物的影响主要涉及细胞中的分子官能团,特别是蛋白质和多核苷酸的相互作用。最终会抑制植物生长、降低光合速率、降低碳水化合物和脯氨酸含量,增加丙二醛含量,会严重影响作物的产量[44]。研究表明,BRs可以缓解植物在重金属胁迫下受到的伤害[45]。碳酸酐酶(carbonic anhydrase,CA)的活性在很大程度上取决于二氧化碳浓度,镉胁迫诱导的气孔关闭降低了植物胞间CO2浓度(Ci),导致CA活性下降;BRs处理通过加速CO2的同化提高CA的活性[46]。在镉胁迫下观察到的28 kDa脱氢酶含量的显著增加可能是由于脱氢酶具有中和胁迫诱导的活性氧积累的作用,0.4 μmol/L 24-EBL处理镉胁迫下的小麦幼苗,增加了28 kD脱氢酶的积累,减少了植物组织中电解质的流出,缓解了镉胁迫带来的伤害[47]。BRs在缓解植物镍胁迫伤害中也起作用,添加0.01 μmol/L 28-高油菜素内酯(28-homobrassinolide,HBL)有助于小麦幼苗抵抗镍胁迫带来的伤害,主要是增加了脯氨酸含量、提高了NR、POX、SOD、CAT和CA的活性[48]。研究表明,施加BRs可显著缓解锑胁迫诱导的根系生长抑制,叶面喷施EBL可显著降低锑积累水平,降低膜脂过氧化程度,增加叶绿素和脯氨酸含量,进一步提高和增强抗氧化酶活性[49]。以上研究表明,BRs通过调节酶活性及渗透调节物质在缓解植物重金属胁迫反应中起着重要作用,然而其机制研究主要集中在作用效果及抗氧化方面,其中的生理机制以及分子机制还需要进一步研究。
4 结论与展望
自BRs被发现以来,在BRs的生物合成、信号转导、逆境胁迫应答方面取得了极大的进展。BRs的生物合成和信号转导因子,特别是调控因子BIN2和BES1/BZR1是应对胁迫的关键调节因子。另外,外源施用BRs也可以缓解植物遭受的多种胁迫。但是在BRs的研究方面仍存在许多问题有待解决,如应激期间BRs信号主要功能的研究还不够全面,需要应用多种方法识别新的BRs成员;外源施加BRs可以提高作物产量,缓解多种胁迫,但不同作物、不同胁迫适用的BRs浓度有所不同,需要进一步摸索合适的浓度,合理利用激素调控植物生长发育过程;BRs信号通路不是单独作用于植物的,BRs如何与ABA等其他途径相互作用影响植物的生长发育以及调控植物响应逆境胁迫过程还需要进一步研究;另外,关于BRs的研究主要是以拟南芥为模型,其他植物中的机制是否与拟南芥一致仍有待进一步探究。

