LAMP在阪崎克罗诺杆菌检测中的研究进展
王彦人,焦敬波,张钧森,康 青,李 萍,杜欣军*
(1.天津科技大学食品营养与安全国家重点实验室,天津 300457;2.天津科技大学食品科学与工程学院,天津 300457)
阪崎克罗诺杆菌为克罗诺杆菌属(Cronobacter)中最为典型的一类食源性致病菌种,易感染全年龄段人群[1],致死率高达40%~80%[2],见表1。其感染引发的主要疾病有新生儿脑膜炎、脑脓肿、血痢、败血症以及坏死性小肠结肠炎等[3-6],同时感染阪崎克罗诺杆菌后的幸存婴幼儿还可能伴随有严重的神经系统后遗症[7]。Urmenyi和Franklin[8]于1961年首次报告了两例由阪崎克罗诺杆菌引起的脑膜炎病例,随后全世界相继出现了相关的病例报告。近年来,国内外由该菌引发的食品安全事件仍屡有发生[9],如在2004年我国安徽阜阳发生的“大头娃娃”事件中,87份劣质奶粉样品中有11份样品被检出含有阪崎克罗诺杆菌[10],这也是我国首次从婴儿配方奶粉中分离到该菌株。该菌广泛分布于各类环境,如婴幼儿配方奶粉生产设施、医疗机构和家庭环境等[1]。目前还尚未确定克罗诺杆菌的宿主和传播途径,但有相关研究指出,克罗诺杆菌能够在婴幼儿配方奶粉等低水分含量的食品中长期存活[12],因此对于克罗诺杆菌的快速检测是预防相关食品安全事件发生的重要手段。
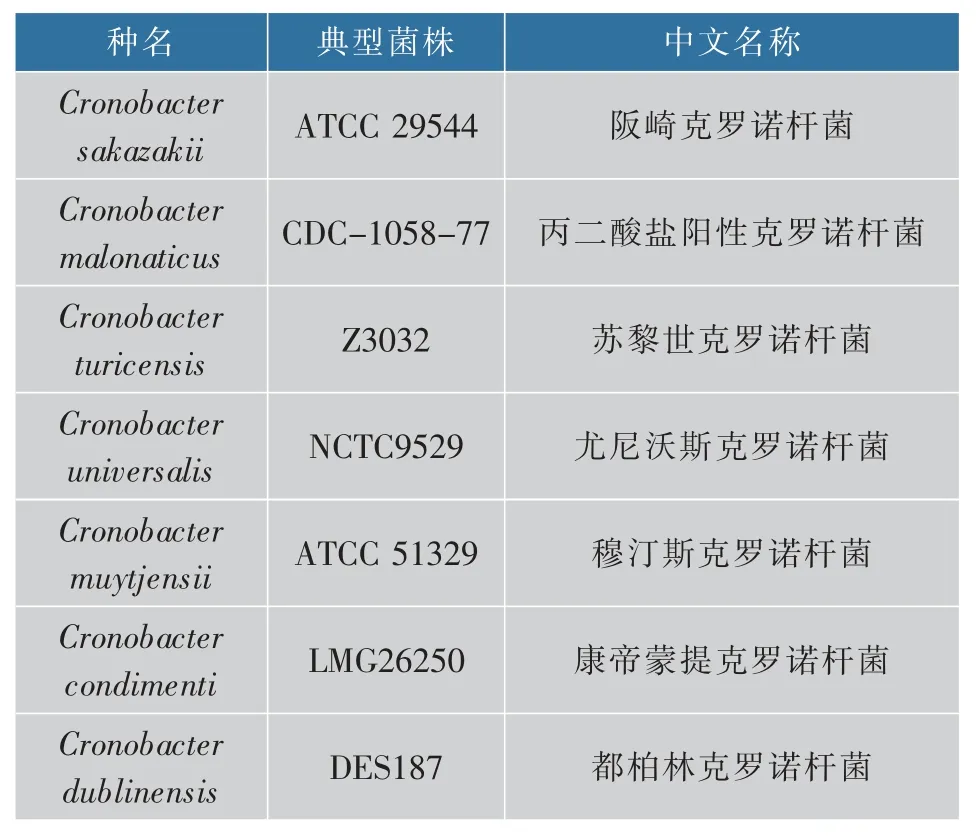
表1 克罗诺杆菌属种型及其典型菌株Table 1 Species types and typical strain in genus Cronobacter
传统的检测方法如酶联免疫、电镜观察、细胞培养等表现出较大的局限性,如耗时长、重复性差、分辨力低、易表现出假阳性结果等,使用更精准快捷的检测方法是未来食品安全检测的必然需求[13]。而传统PCR和qPCR技术虽能够在几小时内对靶标核酸序列进行特异性扩增,但由于PCR过程需要变性、退火、延伸等3个特定温度步骤的多次循环,故需要精密的控温仪器,不利于实地快速检测和基层实验室操作的推广应用。20世纪90年代以来,无须进行热变性的等温扩增技术开始发展,其中环介导等温扩增(Loop-mediated isothermal amplification,LAMP)由于具有快速稳定、特异性强以及不依赖复杂反应设备的特点,已经开始被广泛应用到复杂环境病原微生物的检测中。同时,LAMP技术由于扩增效率高,能够获得更多的扩增产物(扩增子),故其可与各类简便易行的检测方法结合。随着LAMP技术的广泛化,对于其扩增子的检测方法也不再仅仅受限于传统的电泳法或荧光PCR法。新型检测方法不仅具有更佳的时效性和便携性,更伴随着可观的应用前景,然而目前国内对于该方面的综述文章较少有系统性的体现。作者以克罗诺杆菌这一常见食源性致病菌作为切入点,着重于对结合了不同检测方法的LAMP技术的近年研究进行归纳总结,旨在为后续阪崎克罗诺杆菌的快速检测提供一定的理论参考。
1 LAMP技术
2000年,日本荣研化学株式会社Notomi[14]等人报道了一种新型的用于核酸高效扩增的环介导等温扩增技术。该项技术主要基于在起始步骤中产生双茎环结构DNA,并以此作为模版材料展开后续的LAMP过程[15]。目前该技术已被许多国家尤其日本广泛应用于各个领域中,同时,基于LAMP的试剂盒现已被广泛作为体外诊断的工具。
1.1 技术原理
与传统PCR不同,LAMP通过针对靶基因的6~8个不同位点设计了4~6条特异引物[16],依赖于具有链置换能力的Bst DNA聚合酶,在65℃左右的恒温条件下对靶基因进行扩增,在1 h内即可实现109~1010倍的核酸扩增。首先在引物设计方面,先确定靶标基因的6个特异性位点——F1、F2、F3、B1、B2、B3,以及2对特异性位点之间的区域位点(图1),其中F1c、F2c等位点分别与F1、F2等区域互补。根据上述位点设计下列引物:由F2和F1c组成的上游内引物FIP、由B2和B1c组成的下游内引物BIP、由F3区和B3区分别组成的上游外引物FOP和下游外引物BOP以及辅助加快循环效率的促环引物(loop-F/R,LF/R)[16]。
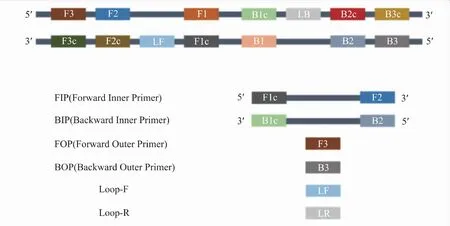
图1 靶基因特异性位点及LAMP体系引物组成Fig.1 Target gene-specific loci and primer composition of LAMP system
1.2 扩增过程
LAMP反应可分为茎环合成和循环扩增两个阶段。以上游引物为例,首先FIP与靶标基因F2c区结合,在链置换酶的作用下向3′方向启动延伸的同时解开双链。随即FOP与F3c区结合,并在新一轮延伸过程中将FIP合成的链替换下来,被替换下来的合成链会通过F1区与F1c区连接而在上游端形成自杂交的环状结构。同样,BIP和BOP则会引发合成链下游端的自杂交环状结构,最终获得两类上下游端均有着自杂交环状结构的双茎环状DNA作为后续LAMP扩增的模板。
两类双茎环状DNA具有多个扩增起始位点,如3′端的B1区、茎环上的F2c和B2区等。以FIP与处于茎环的F2c区为例:从FIP上的F2区向3′方向开始链置换合成延伸[17],形成2条新的双茎状DNA。BIP进而与其结合,开启新一轮扩增,且产物DNA长度增加1倍。LAMP扩增体系中的促环引物LF和LR则能够分别与茎环结构结合启动新一轮的链置换反应,进而加快反应速率。
LAMP技术能够以每小时109扩增子的倍增速度对靶DNA进行快速有效地扩增[14],研究表明,相比于大多数传统PCR或实时PCR技术,LAMP技术的DNA产量要高近20倍[18]。在临床和食品检测应用中,虽然LAMP在复杂食品或饲料中通常表现出较高的稳定性[19-20],但是也会在一定程度上受到检测抑制剂的干扰[21-22]。此外,由于LAMP的扩增效率远高于传统PCR,因此其后续对于扩增子的检测方法也具有多样性和时效性[23]。
2 基于LAMP技术的不同平台在克罗诺杆菌快速检测中的应用
LAMP技术能够快速有效地靶向扩增目的基因,从而获得大量的核酸扩增产物。除传统的琼脂糖凝胶电泳法外,LAMP能与多种检测方法结合,对扩增产物进行快速准确的检测,如肉眼观察法、实时荧光法、生物发光法、免疫法等,应用于克罗诺杆菌的检测研究见表2。
2.1 肉眼观察法
在早期研究中,肉眼观察法由于最直观、快速且对仪器设备需求低而被广泛应用于LAMP技术中,也是目前阪崎克罗诺杆菌LAMP检测的常用方法。由于LAMP反应的扩增效率远高于传统PCR反应,因此能够通过直接观察来判断LAMP产物的生成[24]。根据是否需要额外加入显色剂,将肉眼观察法分为浊度观察法和显色观察法。浊度观察法不需要额外加入显色剂,是基于LAMP反应体系中DNA聚合消耗ATP所产生的大量焦磷酸盐与体系中的镁离子反应,生成焦磷酸镁的白色沉淀[25]。显色法则需要额外加入显色剂,如常见的SYBR Green荧光染料,染料能够与体系中双链DNA的扩增产物结合进而释放出荧光信号,使得阳性反应体系能够在紫外照射下被清楚地观察到。荧光染料检测的灵敏度通常明显高于浊度法。胡等[26]利用阪崎克罗诺杆菌的16S~23S rRNA设计引物,对纯培养物和人工污染婴儿配方奶粉样本进行LAMP扩增,通过肉眼观察其反应体系中白色沉淀,检出限分别为0.101 CFU/mL和1.01 CFU/g,相比于常规PCR检测技术,该方法显示出较高的灵敏度,为常规PCR检测的1 000倍。此外,马等[27]根据阪崎克罗诺杆菌的16S rRNA和ompA基因分别设计LAMP引物,对纯培养物进行扩增,并通过显色法对LAMP产物进行检测,结果表明ompA引物对应的检出限为3 CFU/mL,为16S rRNA引物检出限的1/10。同时ompA引物的特异性达100%(9/9),而16S rRNA引物的特异性仅为78%(7/9)。因此较16S rRNA基因,根据ompA基因设计的LAMP引物得到的检测效果可能会更佳。表2归纳了不同技术平台基于LAMP技术在崎克罗诺杆菌检测中的应用[28-30]。
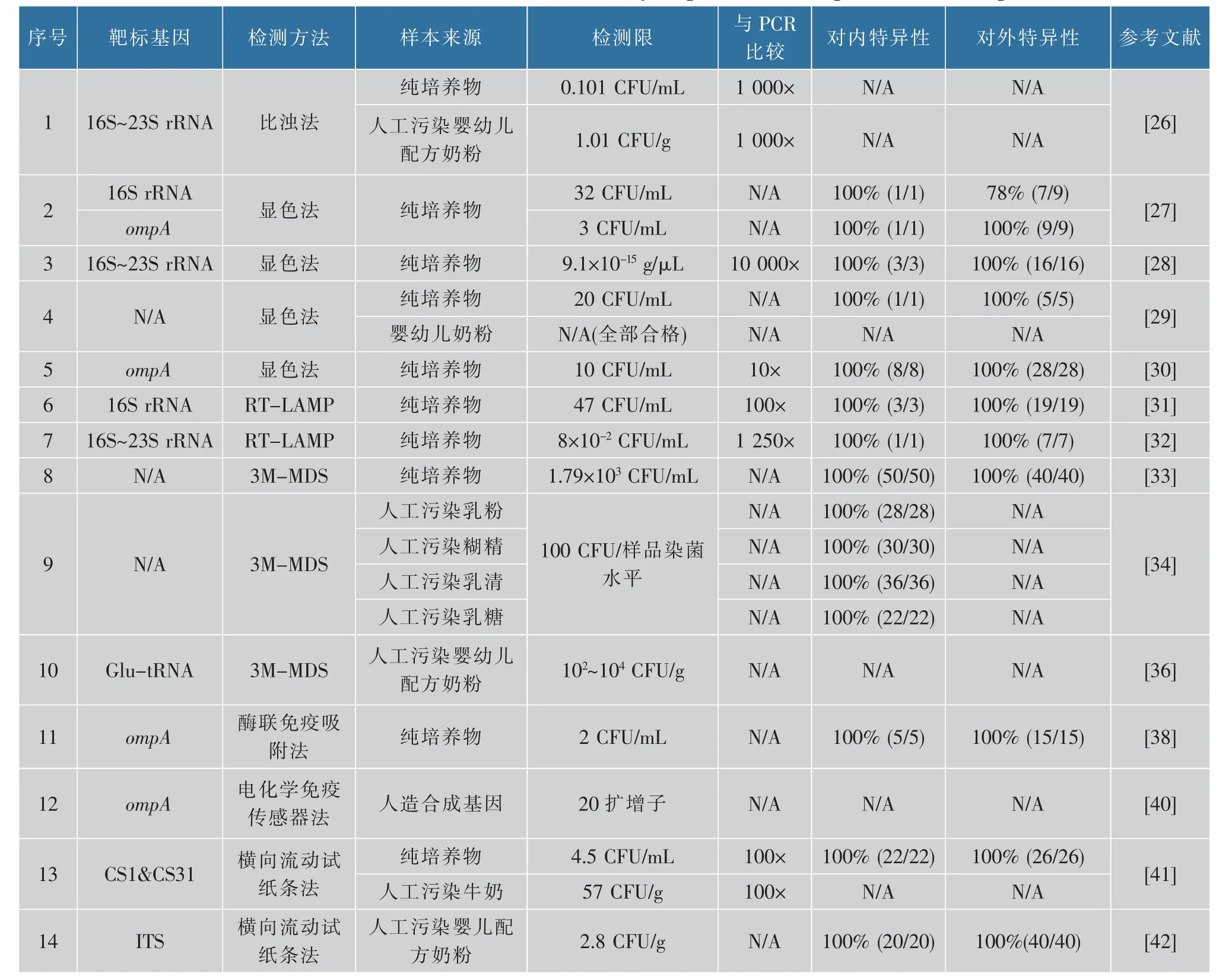
表2 环介导扩增技术检测阪崎克罗诺杆菌Table 2 Detection of Cronobacter sakazakii by loop-mediated amplification technique
2.2 实时荧光定量法
RT-LAMP与RT-PCR的原理相同,均是根据荧光染料与LAMP扩增产物结合所产生的荧光信号对扩增进程进行实时定量的检测。陈等[31]根据阪崎克罗诺杆菌的16S rRNA基因序列设计引物,进行RT-LAMP,结果表明其特异性达100%,无假阳性影响,检测限为47 CFU/mL,较常规PCR灵敏度提高了100倍。另外,石等[32]也对阪崎克罗诺杆菌纯培养物进行RT-LAMP,在保证特异性的同时,其检测限可达到了8×10-2CFU/mL,与同等条件下的常规PCR相比,灵敏度提高了1 250倍。
2.3 生物发光法
近年来,美国3M公司推出了一款快速检测致病菌的便携式分子检测系统(3MTM Molecular Detection System)。该设备的工作机理主要是通过加入腺苷-5′-磷酸硫酸、ATP磷酸化酶以及荧光素酶来耦合LAMP反应产生的焦磷酸盐进行生物发光来达到自动化检测目的,能够在75 min内输出1~96份样本的检测报告,对大批次高通量样本的检测具有显著优势。谢等[33]利用3M-MDS分别对阪崎克罗诺杆菌的纯培养物以及人工污染食品样本进行了检测,通过结果分析发现该系统对纯培养物的平均检测限为1.79×103CFU/mL,且对于非目标菌株的检测结果均为阴性,3M-MDS法的检验结果与传统的生化鉴定国标法(GB 4789.40-2016)高度一致,能够满足乳制品及常见食品样本的快速检测要求。同样,Patrick等[34]于2019年对改进后的3M-MDS技术进行评估,通过3M-MDS和国标上较新发布的平板划线检测标准(ISO 22964:2017)对人为控制污染的36组含益生菌婴儿配方奶粉进行检测,结果显示两者的阳性检出率(POD,probability of dection)也没有显著性差异(P>0.05),说明3M-MDS方法在食品检测应用上对传统培养的标准方法具有一定的替代潜力。另外有研究表明,在食品检测时等温扩增检测的灵敏度一般比传统常规PCR高1~3个数量级[35]。Kim等[36]对人为污染过阪崎克罗诺杆菌的婴儿配方奶粉分别用3M-MDS与RT-PCR进行检测,通过对比结果发现,3M-MDS对阪崎克罗诺杆菌的检测限为102~104CFU/mL,PCR中较为灵敏的RT-PCR则为102CFU/mL。虽然现有3M-MDS方法较于RT-PCR并未对阪崎克罗诺杆菌显示出更高的检测灵敏度,然而在其他食源性致病菌的相关研究中,发现3M-MDS法(99.46%)比RT-PCR(98.74%)有更高的准确率[37]。
2.4 免疫法
免疫法是一类利用抗原抗体免疫结合反应的高特异性、高灵敏性的检测方法。由于LAMP技术的问世时间较短,文献库中对阪崎克罗诺杆菌以LAMP免疫法作为检测方法的研究相当有限。
2.4.1 酶联免疫吸附法酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)是指将抗原抗体免疫反应和酶(或模拟酶)催化作用相结合的技术。Zhang等以Fe3O4磁性纳米粒子作为模拟酶探针,利用双抗夹心法对阪崎克罗诺杆菌的ompA基因进行检测,特异性达100%,检测限为2 CFU/mL,并且该方法对不同浓度模板的结果呈线性响应,适用于定量研究[38]。同时,该研究还通过单叠氮丙二钠(PMA)排除死菌的干扰,反映出体系内阪崎克罗诺杆菌的存活状态,对实际检测具有较高的潜在应用价值。
2.4.2 电化学免疫传感器法电化学免疫传感器是将电化学分析与免疫学技术相结合的一类分析器件,通过传感器件将分子识别标记物(抗原或抗体)免疫反应产生的化学信号转化为电信号,用于对靶标物质的痕量分析研究[39]。Guo等[40]通过将LAMP核酸信号放大、三元催化发夹结构自组装技术(catalytic hairpin assembly,CHA)以及血糖检测仪进行耦合,对人工合成的阪崎克罗诺杆菌ompA基因进行检测,最低检测值可低至20扩增子(1.32×10-18mol/L),在便携式检测领域具有很大的应用潜力。
2.4.3 横向流动试纸条法横向流动试纸条(lateral flow dipstick,LFD)包含检测线和质控线,其中两者分别了锚定了特定荧光素的抗体,能够与LAMP扩增子中的荧光素结合,实现颜色变化并进行检测判别,较大程度上摆脱了对设备的依赖性。Fu等[41]基于22个阪崎克罗诺杆菌的全基因组序列比对出的保守核心基因序列(CSK29544_00235及CSK29544_03484基因)设计引物,结合LAMP-LFD的方法对22株克罗诺杆菌的纯培养物进行检测,灵敏度达100%,且对其他菌株无假阳性出现,检测限为4.5 CFU/mL;而对人工污染克罗诺杆菌的牛奶样品的检测限则为57 CFU/g,比PCR-LFD检测限均高出2个数量级。Yang等[42]基于核糖体ITS基因对人为污染阪崎克罗诺杆菌的婴儿配方奶粉进行多重LAMP-LFD方法的检测应用,该方法对于80类不同奶粉样本特异性达100%,检测限达到2.8 CFU/g。
综上,LAMP能够结合各种后续扩增子检测方法且较好地应用于该致病菌最常见载体——乳制品奶粉中,比传统PCR普遍表现出了更高的灵敏度。然而LAMP所需的引物设计要求较严苛,6条引物严格对应靶标基因相应位置,比PCR引物复杂程度更大;同时由于LAMP带来的大量扩增子产物易在实验室等封闭环境形成气溶胶污染,进而对后续LAMP实验带来假阳性或灵敏度的干扰,这些存在的问题需要通过对操作人员的规范培训及通过加入某些LAMP辅助剂进行克服改进。
3 展 望
阪崎克罗诺杆菌作为一类常见的食源性致病菌,会对婴幼儿等免疫力低下的人群造成致命威胁,因此建立和改进针对阪崎克罗诺杆菌的快速检测方法和技术极为必要。当今国际社会普遍以FDA推荐的传统生理生化鉴定和PCR技术作为标准检测手段,相较于以上方法,LAMP具有时效性好、特异性强、灵敏度高、无须烦琐的温度控制、对设备的依赖性低等优点,且扩增效率远高于传统PCR。LAMP同时可以与各种不同扩增子的检测方法相结合,如具有高通量能力的3M-MDS法,便携性的LFD法等。但是,LAMP也存在气溶胶干扰严重、引物设计复杂、不能直接针对活菌检测等不足,未来的研究主要是解决以上问题,降低实验成本,实现现场实时检测。现今随着LAMP技术的不断发展完善和快速检测需求的提高,其必将在阪崎克罗诺杆菌的检测领域占有重要位置,具有广阔的应用前景。

