NtSPX4基因敲除对烟草苗期磷吸收和生长发育的影响研究
单玉静,王召军,程泽华,余婧,雷波,闫筱筱,张洪映,崔红*
生物技术
基因敲除对烟草苗期磷吸收和生长发育的影响研究
单玉静1,王召军1,程泽华1,余婧2,雷波2,闫筱筱1,张洪映1,崔红1*
1 河南农业大学,烟草学院,郑州市文化路95号 450002;2 贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵州贵阳龙滩坝路29号 550081
【目的】为探究基因在烟草磷吸收转运中的作用。【方法】同源克隆了烟草(L.)K326中基因,通过CRISPR/Cas9技术获得了和均发生纯合突变的K326株系S42,在不同磷浓度的Hoagland溶液培养条件下,对S42株系的生长发育、物质积累、磷吸收相关基因表达及有效磷含量变化进行研究。【结果】烟草基因组中存在两个同源基因,分别命名为和。其中CDS全长为924 bp,编码氨基酸序列与祖先种林烟草NsylSPX4相同;CDS全长为933 bp,编码氨基酸序列与祖先种绒毛烟草NtomSPX4相同。S42株系中和均在第52 bp处插入一个碱基T,导致NtSPX4蛋白翻译提前终止。在标准Hoagland溶液培养条件下, S42株系的生长发育与对照无明显差异;在高磷条件下,S42株系生长发育受到抑制,生物量较对照降低了约45%;在低磷条件下,S42株系生长势优于对照,生物量较对照提高了约39%。RT-PCR分析表明,在正常磷条件下,S42株系中磷转运蛋白基因和的表达水平与对照基本一致,在高磷和低磷条件下,S42株系中和基因表达水平均显著高于对照K326。有效磷检测分析表明,不同磷浓度条件下,S42株系中有效磷含量均极显著高于对照K326。【结论】基因敲除在低磷条件下可以促进烟株的生长发育,在高磷条件下对烟株生长发育有一定的抑制作用,在烟草磷吸收转运中具有负向调控作用。
烟草;;基因编辑;磷胁迫;磷转运蛋白
磷是植物生长发育的必需营养元素之一,参与植物体内多种代谢过程,缺磷会抑制细胞的分裂和增殖,造成植株生长发育迟缓甚至停止[1]。据调查统计,我国约有2/3的土壤缺磷,并且由于土壤对磷的强烈化学固化作用,土壤中可吸收利用的有效磷极度缺乏[2]。通过分子手段筛选培育磷高效基因型的植物是现代农业可持续发展的研究方向之一。
植物对磷的应答反应是一个复杂的过程,已经发现有一百多个基因参与了植物的缺磷反应[3-5]。研究表明含有SPX结构域的蛋白质参与磷酸盐稳态,包括磷转运和对磷缺乏的适应[6]。SPX结构域通常位于蛋白质的N端,含有三个高度保守的子结构域,每个子结构域包含30~40个氨基酸。根据是否含有其他保守结构域,SPX结构域蛋白分为四个亚家族[7-8],拟南芥和水稻中第一亚家族的成员分别有4个(AtSPX1-4)和6个(OsSPX1-6)。拟南芥中,AtSPX1蛋白以磷依赖的方式抑制转录因子AtPHR1的活性,参与磷稳态调节[9]。在水稻中研究发现,是磷吸收的负调控因子。在正常情况下,OsSPX4通过SPX结构域与转录因子OsPHR2蛋白的C端互作,抑制其进入细胞核,从而影响下游磷饥饿诱导基因的表达[10]。低磷胁迫能导致OsSPX4 蛋白泛素化,然后被26S蛋白酶体降解,从而释放出PHR2并进入细胞核行使转录调控功能,导致磷饥饿诱导基因表达上调,从而增强植株对磷的吸收和转运[11]。因此,基因在植物对磷的吸收转运过程中起着重要作用。
磷对烟株的抗性、烟叶品质起着重要的作用[12]。缺磷会造成烟株生长缓慢、根系发育不良、成熟期推迟、叶片狭小、叶色暗绿,调制后的叶片缺乏光泽、油分不足、主要化学成分的含量及比例受到影响[13-14]。研究表明,植物体对磷素的吸收、转运和再利用过程主要是由位于质膜上的磷酸盐转运蛋白基因(,)家族调控[15],低磷能够诱导家族的多数基因特异性表达或表达量上调。、是烟草中已经克隆出的磷转运蛋白基因,在缺磷水平下其转录本大量增加[16]。有研究表明在烟草中和的表达可能受到类似拟南芥和水稻中的SPX-PHR信号途径调控[17]。但目前关于基因在烟草磷吸收转运中的功能还未见报道。因此,本研究采用同源克隆的方法获得了烟草中的基因,创制基因敲除株系,通过研究不同磷浓度下烟苗的生长发育、磷吸收相关基因的表达和磷含量的变化,阐明对烟草磷吸收和转运的影响,为培育磷高效烟草品种奠定理论基础。
1 材料与方法
1.1 材料
供试材料为烟草主栽品种K326,培养于光照培养箱,培养条件为14 h光,(28±1)℃/10 h暗,(24±1)℃,湿度为60%±2%。
1.2 基因克隆及生物信息学分析
以水稻中的基因序列在烟草基因组数据库(https://solgenomics.net/organism/Nicotiana tabacum/ genome)中进行比对,获得同源基因序列。利用Primer Premier 5.0软件设计上下游引物(F1:5’-ATGAAATTC GGGAAAGAATTTA-3’,R1:5’-CTATTCTGGTGGAT GGGAATCC-3’),以K326叶片cDNA为模板扩增基因CDS序列,反应条件为98℃,5 min;98℃,30 s,58℃,30 s,72℃,45 s,35个循环;72℃,5 min,4℃保存。PCR产物经2%琼脂糖凝胶电泳检测,回收目标片段并连接到pMD19-T载体,转化DH5α大肠杆菌感受态细胞,筛选阳性菌斑,提取质粒后送金唯智公司进行测序。
NCBI(http://www.ncbi.nlm.nih.gov/cdd)在线分析基因的保守结构域。利用DNAMAN和MEGA5.0软件进行多序列比对和进化树分析。
1.3 组织表达模式分析
分别取K326的根、茎、叶和花4个组织样品,经液氮速冻后于-80℃保存。RNA提取按照TIANGEN公司试剂盒(DP441)说明书进行。反转录程序参照novoprotein公司的NovoScript® Plus All-in-one 1stStrand cDNA Synthesis SuperMix试剂盒说明书进行。
以烟草核糖体蛋白基因为内参(扩增引物为F2:5’-CCCCTCACCACAGAGTCTGC-3’,R2:5’-AAGGGTGTTGTTGTCCTCAATCTT-3’)[18],分别对(扩增引物为F3:5’-TGAGACGATGGGA ATACGTAA-3’,R3:5’-GCTTCCAAAGGAAATAGGA GC-3’)和(扩增引物为F4:5’-CAACCCTTC TTTACAACGGAG-3’,R4:5’-CCTCCTGTTGGCCC TTCTG-3’)进行RT-PCR分析。反应条件为95℃,2 min;95℃,15 s,60℃,15 s,72℃,20 s,40个循环;溶解曲线为:95℃,15 s,60℃,15 s,20 min内升至95℃,95℃,15 s。用2-△△Ct法进行数据分析[19]。
1.4 载体构建
根据和的CDS序列,在36-55 bp处设计gRNA靶位点序列(Targeting Sequence:5’-AGAAACCCTACCCGAATGGA-3’),该靶位点序列能同时敲除和两个基因,并在靶位点序列5’端添加I酶切位点,敲除载体与孟盈等人所用载体相同[20]。化学合成靶位点序列及其反向互补序列,退火后形成Oligo二聚体,Oligo二聚体与CRISPR/Cas9载体经I酶切后进行连接,反应体系如下:CRISPR/Cas9载体2.0 μL,Oligo二聚体1.0 μL,Enzyme Mix 1.0 μL,无菌水补充至10.0 μL,将连接产物转化至大肠杆菌DH5α中培养,挑选阳性菌斑,提取质粒进行测序,获得NtSPX4-knockout基因编辑载体。
1.5 遗传转化与分子鉴定
采用冻融法[21]将NtSPX4-knockout基因编辑载体转入农杆菌GV3101,烟草转化采用叶盘转化法[22],侵染后的叶片转移到含有6.0 mg·L-1潮霉素、0.15 mg·L-1NAA、1 mg·L-16BA、500 mg·L-1噻孢霉素的MS培养基上进行分化培养和筛选,分化芽转至含有8.0 mg·L-1潮霉素、0.1 mg·L-1NAA、500 mg·L-1噻孢霉素的MS培养基上生根成苗。提取潮霉素抗性植株的DNA,在靶位点上下游根据和序列分别设计特异性引物(F5:5’-TTCATCACATGAT CACATCAG-3’,R5:5’-GGTAAATAAAATTCAGCAA ACAGA-3’;F6:5’-CAGTTGTTTAATTCCAACTAAG TG-3’,R6:5’-TGCAAGTGCGGGGGAGGC-3’)进行PCR扩增,对PCR产物进行测序筛选靶位点发生碱基突变的株系。
1.6 磷浓度对烟苗生长发育的影响
烟草种子消毒后,均匀等量点在浸透蒸馏水的海绵上(30 cm×20 cm×1 cm),置于培养箱中暗培养,种子露白后进行光照培养。待烟苗长至两叶一心期时,将海绵转移至不同磷浓度的Hoagland溶液中进行培养。高磷处理(HP)中磷浓度为10 mmol·L-1、对照处理(MP)中磷浓度为1 mmol·L-1、低磷处理(LP)中磷浓度为0.005 mmol·L-1,其它元素浓度保持一致。低磷处理用KCl补充溶液中的K+,高磷处理用NaH2PO4补充溶液中的pi,调节PH至6.0。培养过程中,每天定时定量更换溶液,观察记录烟苗的生长发育状况。
1.7 烟苗生物量及有效磷含量测定
处理20 d后,将海绵上的烟株取出称重,每个处理10个生物学重复,进行烟苗生物量的测定。
处理20 d后,每个处理取5株烟苗,混合均匀,进行有效磷含量的测定,测定方法参照文献中的步 骤[23]。
1.8 磷吸收相关基因表达水平分析
处理20 d后,取烟株根组织样,提取RNA并反转录成cDNA,以为内参,分别对(GenBank accession:AB020061,扩增引物F7:5’-ATGGGCTTC TTTACTGATGC-3’,R7:5’-TTCCCATTTTATCTCC GAGCC-3’)和(GenBank accession:AB042951,扩增引物F8:5’-CTTGGGCGTTTATACTACACC-3’,R8:5’-CCATGATAATCAAAGTCATACC-3’)进行RT-PCR分析。反应体系同方法1.3。
1.9 数据处理和统计方法
试验数据使用Excel 2003进行整理,使用SPSS 17.0软件进行显著性分析。
2 结果与分析
2.1 NtSPX4基因克隆及生物信息学分析
烟草K326中,有两条序列与水稻基因高度同源,在N端均具有一个典型的单一的SPX结构域,分别命名为、。经克隆、测序发现,编码区长924 bp,编码区长933 bp,NtSPX4-2在60-62位较NtSPX4-1多了3个脯氨酸,二者氨基酸相似性为96.77%(图1)。

注:NtSPX4:烤烟;NsylSPX4:林烟草;NtomSPX4:绒毛烟草;BXSPX4:香料烟巴斯玛;TN90SPX4:白肋烟TN90;NbSPX4:本氏烟。
蛋白序列比对和进化树分析表明NtSPX4-1与林烟草中的NsylSPX4氨基酸序列相同,NtSPX4-2与绒毛烟草中的NtomSPX4氨基酸序列相同,说明和来源于不同的祖先种。在白肋烟TN90、香料烟巴斯玛中均有两条与NtSPX4-1和NtSPX4-2氨基酸序列分别相同的拷贝。在本氏烟中,NbSPX4-1与NtSPX4-1相似性为97.11%,NbSPX4-2与NtSPX4-2相似性为97.52%。NtSPX4-1、NtSPX4-2与番茄SlSPX4相似性分别为89.39%、92.32%,与水稻OsSPX4相似性分别为56.87%、56.19%,与拟南芥AtSPX4相似性分别为61.77%、60.55%(图2)。该结果表明,NtSPX4在栽培烟草不同类型、不同品种之间高度保守,与本氏烟NbSPX4和番茄SlSPX4亲缘关系较近,与水稻OsSPX4及拟南芥AtSPX4的亲缘关系较远。
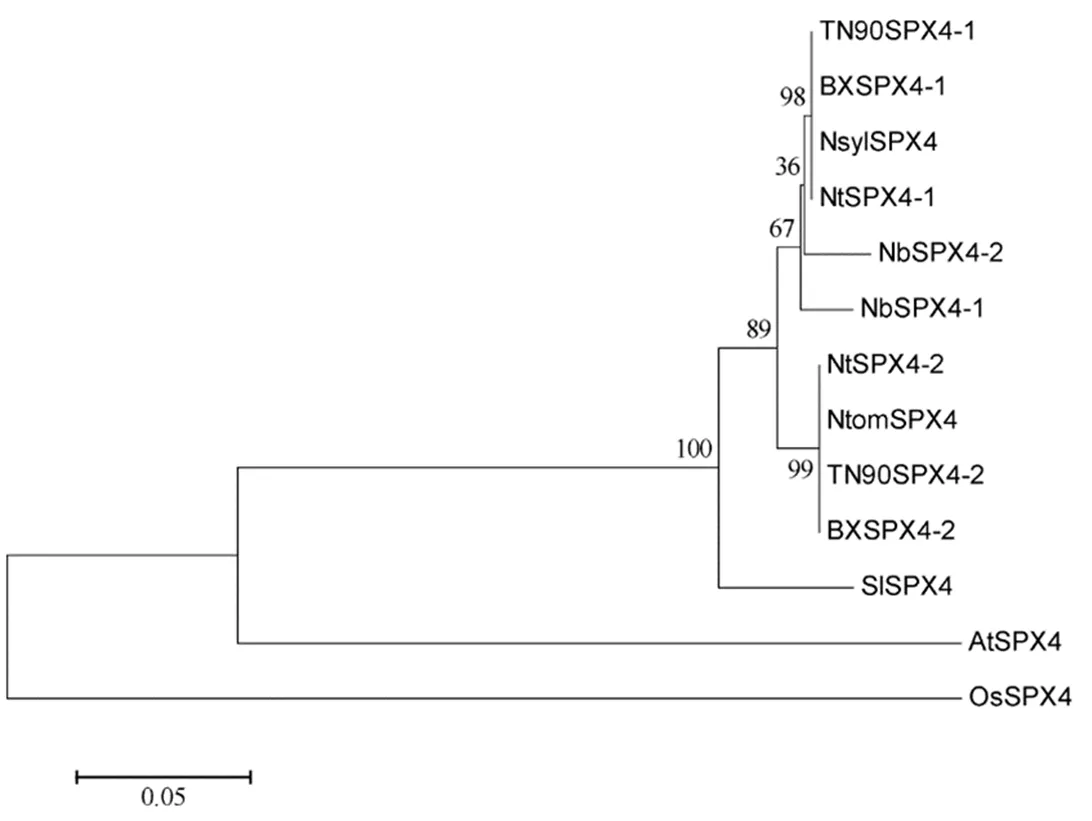
图2 NtSPX4及其同源蛋白系统进化树分析
2.2 NtSPX4基因组织表达模式分析
和的组织表达特异性分析结果如图3,、在根、茎、叶和花中均有表达,在根和花中的表达水平显著高于。研究发现在拟南芥和水稻中含有SPX结构域的大多数基因也在不同器官中广泛表达,并且这些基因在根中能够较快地响应低磷胁迫从而调控磷的吸收及磷向其他器官的转运[7,24-26]。由此推测,烟草中和不仅参与了磷的吸收,也可能参与了磷的分配,并且在磷吸收过程中起到更加重要的作用。
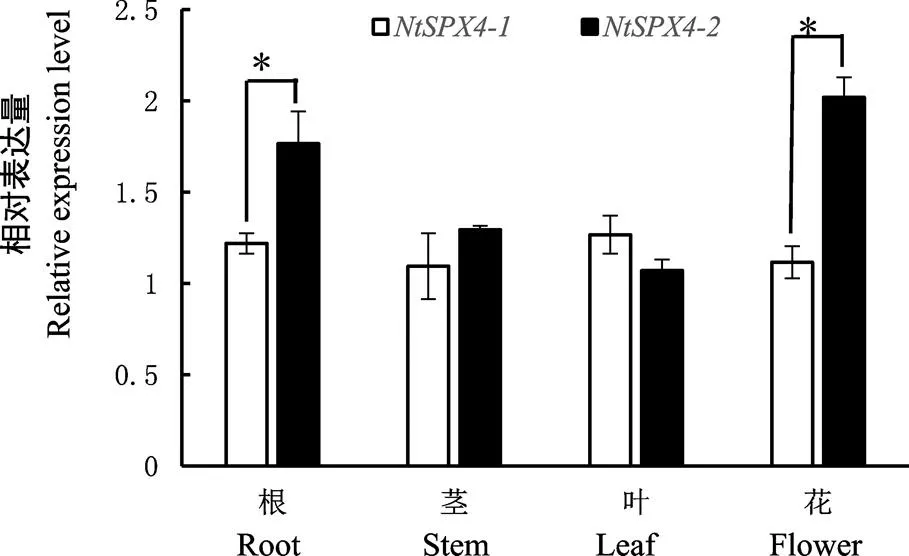
注:图中*表示基因表达量差异在P <0.05水平具有显著性。
2.3 NtSPX4基因敲除和分子鉴定
基因敲除的测序结果显示有19株与野生型序列一致(图4-a),25株在gRNA区域出现双峰(图4-b),1株发生纯合突变(图4-c),基因编辑效率约为58%。对图4-c所示的单株S42进行扩增并测序,结果发现和在靶位点处均发生了如图4-c所示的突变,说明和均发生了纯合突变,在第52 bp处插入一个碱基T,这导致了的移码突变,蛋白翻译提前中止(图4)。
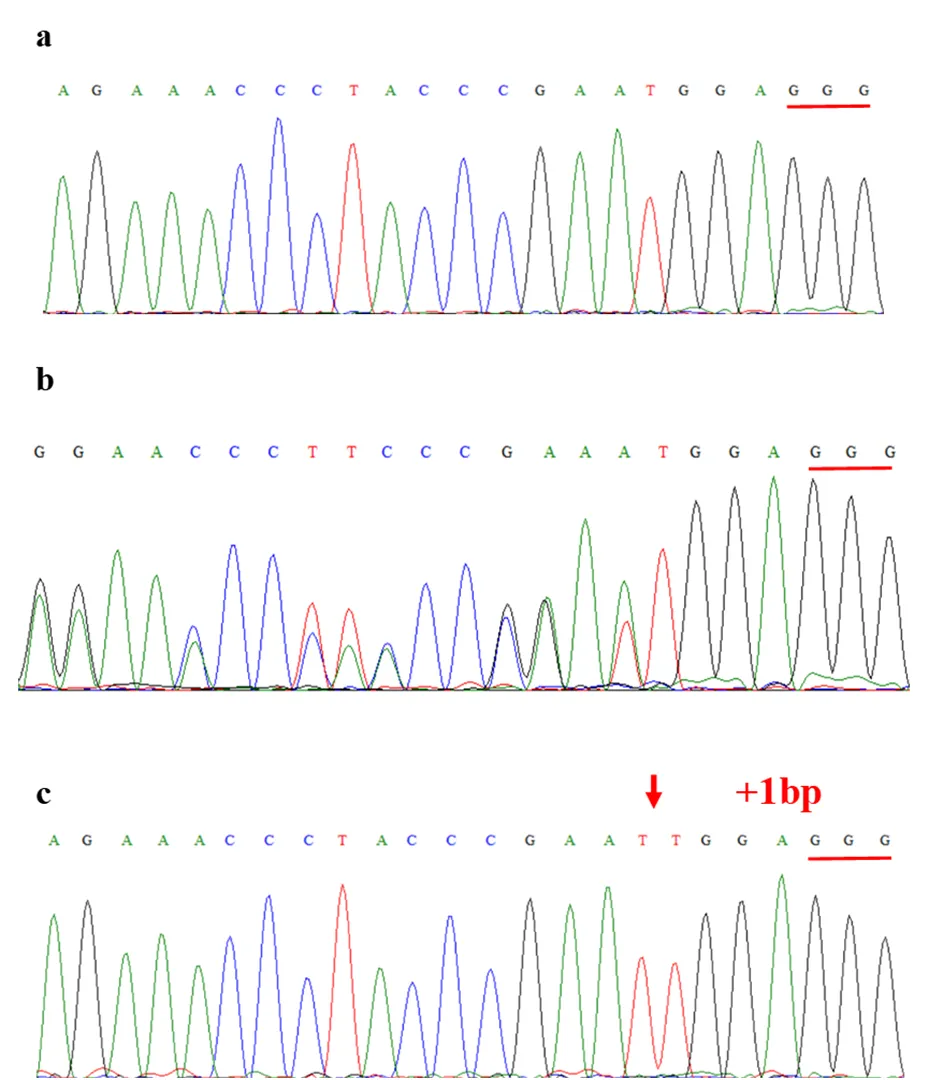
注:下划线部分为PAM序列。
2.4 磷浓度对NtSPX4纯合突变株系生长发育和物质积累的影响
磷浓度对烟苗生长发育和物质积累的影响结果显示(图5),处理20 d后,在磷浓度为1 mmol·L-1的标准Hoagland溶液(MP)中,S42株系与K326生长发育正常,二者无明显差异;在磷浓度为10 mmol·L-1的高磷Hoagland溶液(HP)中,S42株系与对照K326相比生长发育受到抑制,对照K326茎围较粗,株高较高,叶片较大,说明高磷对S42株系生长有一定抑制作用;在磷浓度为0.005 mmol·L-1的低磷Hoagland溶液(LP)中,S42株系与对照K326生长发育均受到抑制,出现发育迟缓、叶色深绿、叶片变厚等现象,但总体上S42株系株高较高,叶片数较多,叶片较大,生长势优于对照K326。生物量检测结果表明,K326烟苗的鲜重随着磷浓度的升高而增加,S42株系在正常磷浓度下生物量积累最高,在高磷和低磷条件下生物量减少,高磷条件下S42株系的生物量较对照降低了约45%左右,低磷条件下S42株系的生物量较对照提高了39%左右。说明基因的敲除,在高磷条件下对烟株的生长发育有一定的抑制作用,但在低磷条件下有助于烟株的生长发育和物质积累。

注:图中*表示不同材料间差异在P<0.05水平具有显著性。
2.5 NtSPX4基因敲除对磷吸收相关基因表达及有效磷含量的影响
不同磷浓度下烟株、的表达水平的测定结果显示(图6A、6B),在正常磷浓度处理下,S42株系和对照K326中,和基因的表达水平无显著差异;在高磷和低磷浓度处理下,S42株系中和表达水平显著高于对照K326。其中,高磷情况下,S42株系中表达量是对照的2倍,表达量是对照的4.4倍;低磷情况下,S42株系中表达量是对照的1.6倍,表达量是对照的1.5倍。该结果表明,基因的敲除可促进烟草磷转运蛋白基因、的表达。S42株系和K326烟株的有效磷含量检测结果如图6C所示,在低磷、高磷以及正常磷浓度处理下,S42株系中可利用的有效磷含量均极显著高于对照K326。这与磷转运蛋白、基因的表达趋势基本一致,证明了基因的敲除提高了烟株对磷元素的吸收能力,促进了有效磷的积累。
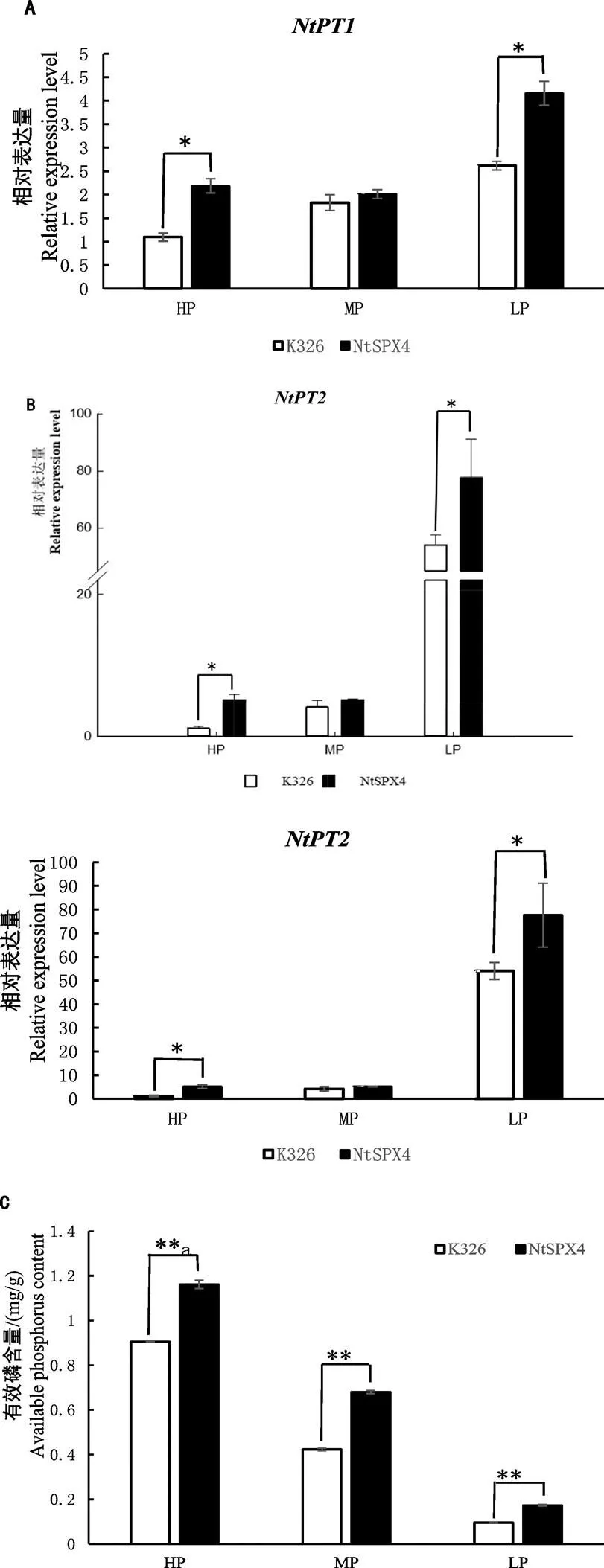
注:图中*表示不同材料间差异在P<0.05水平具有显著性;**表示不同材料间差异在P<0.01水平具有显著性。
3 讨论与结论
植物磷吸收转运的分子调控机制研究已取得较多进展,但鲜有研究将其应用于磷高效烟草品种的定向改良。水稻基因是磷吸收转运的负调控因子,该基因缺失突变体中磷含量显著增加[27],烟草中基因功能尚未得到深入研究。本研究对烟草进行了克隆和生物信息学分析,发现存在两个同源基因,分别来源于祖先种林烟草和绒毛烟草,在第一外显子区域60-62位处比多了3个脯氨酸。组织表达特异性分析表明,整体表达水平高于,而且在根和花中显著高表达,推测其在磷吸收转运中具有比较重要的作用,这还需要对分别进行功能研究来验证。
本研究利用CRISPR/Cas9技术获得了K326的基因纯合突变株系S42,在此基础上,研究S42株系与对照在不同磷浓度条件下生长发育、物质积累、基因表达及有效磷含量等方面的差异。结果发现在正常磷浓度培养条件下,虽然S42株系中有效磷含量显著高于对照株系,但S42株系的生长发育与对照无明显差异,说明此时烟株体内的有效磷含量处于适宜的范围内,由此推测在烟株体内有效磷含量在适宜的范围内时,基因敲除对烟株生长发育没有明显影响;与正常磷浓度相比,在低磷胁迫下S42株系和对照中磷转运蛋白基因、的表达水平均提高,但S42株系的增加程度显著高于对照株系,与之相应的,S42株系中有效磷含量也显著高于对照株系,说明敲除株系能够更好的响应低磷胁迫,从而比对照表现出更优的生长势;而在高磷胁迫下,与正常磷浓度相比,对照株系中的表达水平均降低,但S42株系中的表达水平则未发生显著下降,说明敲除株系不能正常响应高磷胁迫,仍然保持较高的磷吸收水平,造成体内磷浓度过高而使生长发育受到抑制。结果表明基因敲除可显著提高磷转运蛋白基因、的表达水平和有效磷含量,促进植株生长发育和物质积累,该结果与水稻中研究报道相一致。不同的是,在水稻中突变体在正常条件下表现出“磷毒害”现象,植株叶尖发黄,但烟草中基因的敲除并未出现这一现象,这可能是由于单子叶植物与双子叶植物对磷的吸收转运及分配利用存在差异,还需进一步验证。
本研究结果表明,K326中基因的敲除,不仅使其在正常磷浓度的1/200的低磷胁迫条件下仍具有一定的耐受能力,而且在正常磷浓度10倍的高磷胁迫条件下烟株无明显的磷中毒现象。鉴于K326本身是耐低磷且磷高效型品种[28],因而利用该基因对其它磷低效的烟草品种进行定向改良具有更为重要的意义,但本研究只是分析了敲除对烟株苗期磷吸收的影响,接下来还需要进行不同磷供应条件下的田间小区对比试验,以比较该基因对烟株整个发育周期的综合性状及烤后烟叶的产量品质的影响。有研究表明水稻OsSPX4蛋白降解促使氮吸收关键转录因子NLP3易位至细胞核,从而提高植株对氮的吸收及积累[11]。关于在提高烟草氮利用效率中的调控作用将是下一步研究的重点。
[1] 李廷轩,叶代桦,张锡洲,等. 植物对不同形态磷响应特征研究进展[J]. 植物营养与肥料学报,2017, 23(06): 1536-1546.
LI Tingxuan, YE Daihua, ZHANG Xizhou, et al. Research advances on response characteristics of plants to different forms of phosphorus[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(06): 1536-1546.
[2] Carroll P. Vance, Claudia Uhde-Stone, Deborah L. Allan. Phosphorus acquisition and use: critical adaptations by plants for securing a nonrenewable resource[J]. New Phytologist, 2003, 157(3): 423-447.
[3] 王庆竹,尚先文,汤纬玮,等. 马尾松基因的克隆及耐低磷功能分析[J]. 农业生物技术学报,2019, 27(06): 1016-1024.
WANG Qingzhu, SHANG Xianwen, TANG Weiwei, et al. Cloning and low phosphorus tolerance function analysis offrom[J]. Journal of Agricultural Biotechnology, 2019, 27(06): 1016-1024.
[4] 刘允熙,罗佳佳,雷健,等. 柱花草磷高效种质筛选及根系形态对低磷胁迫的响应分析[J]. 草地学报,2021, 29(05): 876-883.
LIU Yunxi, LUO Jiajia, LEI Jian, et al. Screening of phosphorus efficiency germplasm and analysis of root morphology responding to phosphorus deficiency in[J]. Acta Agrestia Sinica, 2021, 29(05): 876-883.
[5] 刘国选,陈康,陆星,等. 大豆调控根系响应低磷胁迫的功能研究[J]. 华南农业大学学报,2021, 42(04): 33-41.
LIU Guoxuan, CHEN Kang, LU Xing, et al. Function ofin soybean regulating root response to low phosphorus stress[J]. Journal of South China Agricultural University, 2021, 42(04): 33-41.
[6] Ji-Yul Jung, Martina K Ried, Michael Hothorn, et al. Control of plant phosphate homeostasis by inositol pyrophosphates and the SPX domain[J]. Current Opinion in Biotechnology, 2018, 49: 156-162.
[7] David Secco, Chuang Wang, Bulak A. The emerging importance of the SPX domain-containing proteins in phosphate homeostasis[J]. New Phytologist, 2012, 193(4): 842-851.
[8] Lin Shu-l, Santi Carole, Jobet Edouard, et al. Complex regulation of two target genes encoding SPX-MFS proteins by rice miR827 in response to phosphate starvation[J]. Plant & cell physiology, 2015, 51(12): 2119-31.
[9] Puga María Isabel, Mateos Isabel, Charukesi Rajulu, et al. SPX1 is a phosphate-dependent inhibitor of Phosphate Starvation Response 1 in[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(41): 14947-14952.
[10] Wen yuan Ruan, Meina Guo, Xueqing Wang, et al. Two RING-Finger ubiquitin E3 ligases regulate the degradation of SPX4, an internal phosphate sensor, for phosphate homeostasis and signaling in rice[J]. Molecular Plant, 2019, 12(8): 1060-1074.
[11] Bin Hu, Zhimin Jiang, Wei Wang, et al. Nitrate–NRT1.1B– SPX4 cascade integrates nitrogen and phosphorus signalling networks in plants[J]. Nature Plants, 2019, 5(4): 401-413.
[12] 朱列书. 烟草营养学[M]. 长春:吉林科学技术出版社,2003: 106.
ZHU Lieshu. Tobacco Nutrition[M]. Changchun: Jilin Science and Technology Press, 2003: 106.
[13] 岳伦勇,何华波,朱列书,等. 烟草的磷素营养研究[J]. 现代农业科技,2014(23): 238-240.
YUE Lunyong, HE Huabo, ZHU Lieshu, et al. Study on phosphorus nutrition of tobacco[J]. Modern Agricultural Science and Technology, 2014(23): 238-240.
[14] 章新,李明,杨硕媛,等. 磷素水平对烟叶化学成分和感官评吸质量的影响[J]. 安徽农业科学,2010, 38(10): 5091- 5093+5109.
ZHANG Xin, LI Ming, YANG Shuoyuan, et al. Effects of phosphorus level on chemical constituents and sensory quality of tobacco[J]. Journal of Anhui Agricultural Sciences, 2010, 38(10): 5091-5093+5109.
[15] Daniel P. Schachtman, Robert J. Reid, S.M. Ayling. Phosphorus uptake by plants: from soil to cell[J]. Plant Physiology, 1998, 116(2): 447-453.
[16] Motoshi Kai, Kouji Takazumi, Hirofumi Adachi, et al. Cloning and characterization of four phosphate transporter cDNAs in tobacco[J]. Plant Science, 2002, 163(4): 837-846.
[17] Daniel P. Schachtman, Ryoung Shin. Schachtman, Shin. Nutrient sensing and signaling: NPKS[J]. Annual Review of Plant Biology, 2007, 58: 47-69.
[18] Sung-Chul Park, Yun-Hee Kim, Chang Yoon Ji, et al. Stable internal reference genes for the normalization of real-time PCR in different sweet potato cultivars subjected to abiotic stress conditions[J]. PLoS ONE, 2017, 7(12).
[19] Kenneth J, Livak, Thomas D. Analysis of relative gene expression data using Real-Time Quantitative PCR and the 2−ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[20] 孟盈,闫筱筱,王召军,等.基因表达对烟草腺毛发生的影响[J]. 中国烟草学报,2019, 25(02): 85-92+98.
MENG Ying, YAN Xiaoxiao, WANG Zhaojun, et al. Effects ofexpression on tobacco trichomes[J].Acta Tabacaria Sinica, 2019, 25(02): 85-92+98.
[21] 高乐. 农杆菌介导RNAi大豆花叶病毒基因大豆遗传转化的研究[D]. 南京:南京农业大学,2015.
GAO Le. Studies on agrobacterium-mediated soybean transformation with RNAigene of soybean mosaic virus[D].Nanjing: Nanjing Agricultural College, 2015.
[22] 王关林,方宏均. 植物基因工程技术原理与技术[M]. 科学出版社,1998, 229-609.
WANG Guanlin, FANG Hongjun. Principles and Techniques of Plant Genetic Engineering Technology[M]. Science Press, 1998, 229-609.
[23] 季敏杰. 转录因子基因对烟草磷吸收和丛枝菌根共生的影响[D]. 南京:南京农业大学,2017.
JI Minjie. Effect of transcription factorgene on phosphorus uptake and arbuscular mycorrhizal symbiosis in tobacco[D]. Nanjing: Nanjing Agricultural College, 2017.
[24] Yong Wang, Cecile Ribot, Enea Rezzonico, et al. Structure and expression profile of thegene family indicates a broad role in inorganic phosphate homeostasis[J]. Plant Physiology, 2004, 135(1): 400-411.
[25] Ke Duan, Keke Yi, Lei Dang, et al. Characterization of a sub-family ofgenes with the SPX domain reveals their diverse functions in plant tolerance to phosphorus starvation[J]. The Plant Journal, 2008, 54(6): 965-975.
[26] Wang Zhiye, Hu Han, Huang Hongjie, et al. Regulation ofandon expression of OsSPX domain genes and Pi-starvation signaling in rice[J]. Journal of Integrative Plant Biology, 2009, 51(7): 663-674.
[27] 钟永嘉.与调控水稻磷信号和磷平衡的功能研究[D]. 杭州:浙江大学,2015.
ZHONG Yongjia. Function ofandon Pi- signaling and Pi-homeostasis in rice[D]. Hangzhou: Zhejiang University, 2015.
[28] 龚丝雨. 烟草苗期耐低磷基因型筛选及生理机制研究[D]. 南昌:江西农业大学,2019.
GONG Siyu. Screening of low-phosphorus tolerant genotypes and its physiological mechanism of tobacco at seedling stage[D]. Nanchang: Jiangxi Agricultural University, 2019.
Effect ofgene knockout on phosphorus absorption and growth of tobacco plants in seedling stage
SHAN Yujing1, WANG Zhaojun1, CHENG Zehua1, YU Jing2, LEI Bo2, YAN Xiaoxiao1, ZHANG Hongying1, CUI Hong1*
1 College of Tobacco Science, Henan Agricultural University, Zhengzhou 450002, China; 2 Guizhou Academy of Tobacco Science, Key Laboratory of Molecular Genetics, China National Tobacco Corporation, Guiyang 550081, China
[Objective] This study aims to explore the role ofgene on phosphorus absorption and transport in tobacco plant. [Methods] In this research, we cloned thegene from tobacco (L.) cultivar K326 and obtained aandhomozygous mutant strain S42of K326 by CRISPR/Cas9 technology. The expressions of genes related to the growth, material accumulation, phosphorus absorption and available phosphorus content of S42and K326 were analyzed under different phosphorus concentration treatments. [Results] Twoparalogue genes were found in tobacco genome, namedand. The full length ofcoding sequence is 924 bp, and the amino acid sequence is identical to that of; the full length ofcoding sequence is 933 bp, and the amino acid sequence is identical to that of. In strain S42, bothandinserted a base T at 52 bp, which caused the premature of NtSPX4 protein translation. Under the standard Hoagland solution condition, we found that there was no significant difference between S42and K326 in growth. Under high-phosphorus condition, the growth of S42was inhibited, and the biomass was reduced by about 45% compared to that of the control. Under low-phosphorus condition, the growth of S42was better than that of the control, and the biomass was increased by about 39% compared to that of the control. RT-PCR analysis showed that the expression levels of the phosphorus transporter genesandin S42showed no significant difference compared with the control under normal phosphorus condition. Under high- phosphorus and low-phosphorus conditions, the expression levels of theandgenes in S42were significantly up-regulated. The available phosphorus detection analysis showed that the available phosphorus content in S42was significantly higher than that of the control under all treatments. [Conclusion] This study shows thatgene knockout can promote tobacco growth under low-phosphorus condition, while inhibit its growth under high-phosphorus condition.has a negative regulatory effect on phosphorus absorption and transport for tobacco plants.
tobacco;; gene editing; phosphorus stress; phosphorus transporter
Corresponding author. Email:cuihonger_13@163.com
国家烟草专卖局科技计划项目110202101005(JY-05)
单玉静(1996—),硕士研究生,烟草生物技术,Email:1614504615@qq.com
崔红(1966—),教授,博士研究生导师,Email:cuihonger_13@163.com
2021-08-30;
2021-12-28
单玉静,王召军,程泽华,等. NtSPX4基因敲除对烟草苗期磷吸收和生长发育的影响研究[J]. 中国烟草学报,2022,28(1). SHAN Yujing, WANG Zhaojun, CHENG Zehua, et al. Effect of NtSPX4 gene knockout on phosphorus absorption and growth of tobacco plants in seedling stage[J]. Acta Tabacaria Sinica, 2022,28(1). doi: 10.16472/j.chinatobacco. 2021.T0152

