基于iTRAQ-PRM技术筛选不同类型土壤烤烟根系差异表达蛋白
杨睿,查文菊,陈颐,何承刚,王涛,何聪莲,费明亮*
基于iTRAQ-PRM技术筛选不同类型土壤烤烟根系差异表达蛋白
杨睿1,2,查文菊3,陈颐1,何承刚2,王涛3,何聪莲2,费明亮1*
1云南省烟草农业科学研究院,云南省昆明市五华区圆通街33号 650031;2云南农业大学,云南省昆明市盘龙区沣源路452号 650201;3云南省烟草公司曲靖市公司,云南省曲靖市官坡巷51号 671000
【目的】从蛋白质水平揭示烤烟根系对不同类型土壤的响应差异。【方法】以烤烟品种K326为材料,选取石灰岩土(沙壤土)、水稻土和红壤土,测定3种类型土壤烤烟根系活力、硝酸还原酶(NR)、谷氨酰胺合成酶(GS)和天冬氨酸合成酶(AS)活性;利用iTRAQ技术鉴定3种类型土壤烤烟根系差异表达蛋白,对所获得的差异蛋白进行生物信息学分析,从中选择16个蛋白进行平行反应监测(PRM)验证。【结果】(1)红壤土的烤烟根系活力、NR、GS和AS活性均高于沙壤土和水稻土;(2)从水稻土vs沙壤土、沙壤土vs红壤土、水稻土vs红壤土3组对比中分别鉴定出699、650、569个烤烟根系差异表达蛋白,其中上调/下调蛋白分别为412/287、291/359和323/246个;(3)差异蛋白质主要有催化、结合、转运活性等功能;(4)差异蛋白功能富集于次生代谢产物的生物合成、代谢途径和苯丙烷类生物合成等代谢途径;(5)红壤土烤烟根系与抗逆性、碳水化合物和能量代谢、蛋白质合成等相关的差异蛋白表达均高于沙壤土和水稻土。【结论】利用iTRAQ标记技术,结合PRM验证技术筛选出不同类型土壤烤烟根系差异表达蛋白,为获取响应关键蛋白奠定基础。
iTRAQ;烟草根系;土壤类型;氮代谢;蛋白质组学
烤烟根系具有支撑烟株、吸收水分和营养物质的作用[1],是分泌烤烟次生代谢物的主要场所[2]。影响烤烟根系生长发育的因素很多,如品种[3]、海拔[4]、施 肥[5]、土壤类型[6]、栽培管理措施[7]等,其中,土壤类型的影响较大。不同类型土壤条件下,烤烟根系生长状况有明显差异,进而影响烟叶品质[8]。马新明等[9]研究结果表明不同土壤类型烟草根系发育特点不同,主要表现为生长规律和理化特性差异很大。高云等[10]研究结果表明不同类型土壤对烟叶感官质量的评价指标有不同程度的影响,主要表现在香气量、杂气、余味、劲头和干燥感上。目前,烤烟根系响应不同类型土壤的分子机制尚不清楚,近年来蛋白组学质谱分析技术的迅速发展为相关研究提供了契机。同位素标记的相对和绝对定量iTRAQ技术(isobaric tags for relative and absolute quantitation,iTRAQ)是高通量筛选的蛋白质定量技术,具有标记效率高、标记过程简单、标记范围广等特点[11-13]。本研究结合前期研究基础与提出的理论假设,在测定烤烟根系氮代谢基础上,利用iTRAQ标记技术,结合PRM验证技术筛选不同类型土壤下烤烟根系差异表达蛋白,旨在为从蛋白质水平上揭示烤烟根系对不同类型土壤的响应差异提供基础。
1 材料与方法
1.1 供试材料
本研究供试材料为烤烟品种K326(由玉溪中烟种子有限公司提供),于2019年4月至8月在云南省玉溪市红塔区研和试验基地(102°29’58″ E, 24°14’21″ N,海拔1635 m)进行旱棚试验。田间管理遵循正常的农艺程序。土壤类型分别为石灰岩土(沙壤土)、水稻土和红壤土,前茬作物均为油菜。土壤养分肥力见表1,每个处理重复3次,且每个处理采用单独的种植区。
表1 供试土壤养分信息
Tab.1 Nutrient information of soil tested
土壤类型有机质/%pH值有效氮/(mg/kg)有效磷/(mg/kg)有效钾/(mg/kg) 石灰岩土(沙壤土)2.717.16136.027.446.7 水稻土4.377.80175.810.188.2 红壤土3.916.04120.43.5133.5
1.2 取样
采用随机取样法,选择3种类型土壤的打顶后烤烟根系作为分析材料(石灰岩土(沙壤土)-SS,水稻土-PS,红壤土-RS),洗净后甩干,剪取相同部位根系,用锡箔纸包住迅速置于液氮中,-80℃保存备用。共选择27株烟,每种类型土壤处理各9株,其中每3株混合作为1个重复,共3个重复。
1.3 酶活性测定
选取不同类型土壤烤烟根系1 g,在Giannopolitis等[14]的方法基础上略作修改进行酶提取,所有步骤均在4℃下进行。根系酶活性分别采用硝酸还原酶(NR)、谷氨酰胺合成酶(GS)和天冬氨酸合成酶(AS)试剂盒微量法进行测定(北京索莱宝科技有限公司),根系活力采用TTC法进行测定[15]。
1.4 蛋白质组学分析
参照祁忠达等[16]的方法分别对不同土壤烤烟根系进行全蛋白质提取,对提取后的蛋白样品采用BCA试剂盒测定蛋白浓度。首先按1: 50的质量比例(胰酶:蛋白)加入胰蛋白酶,37℃酶解过夜,酶解后的肽段用C18柱脱盐,真空冷冻干燥脱盐后的肽段,根据 iTRAQ-8标试剂盒(AB SCIEX,美国)操作说明进行肽段标记。然后将标记后的样品混合,应用强阳离子交换色谱(SCX)对混合后的肽段进行预分离,经过StrataX除盐柱除盐,冷冻抽干。最后进行液相分离和色谱分析。
1.5 差异蛋白的选择
鉴定到的蛋白质差异倍数≥1.3,可信度水平在 95%以上(即≤0.05),每个蛋白至少包含一个不同肽段的蛋白为可信蛋白;鉴定的肽段和蛋白质定量,以conf. ≥95过滤,即可信度在95%以上可信肽段用于蛋白质定量。通过两两对比获取显著差异蛋白,根据BH校正法,对原数据进行≤0.05校正,将差异倍数≥1.2或者≤0.83时视为表达差异蛋白[17]。
1.6 生物信息学分析
蛋白注释方法GO(Gene Ontology)分析,蛋白质组学注释分析选择UniProt数据库(https://www. uniprot.org/);KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析,选择在线服务工具KAAS对提交的蛋白进行注释,之后通过KEGG mapper将注释过的蛋白匹配入数据库中相应的代谢通路中;蛋白质定量至少包含1个特异肽段,丰度差异蛋白至少含有2个生物学重复。利用R语言进行差异蛋白质的热图聚类分析。
1.7 基于PRM技术验证差异蛋白
平行反应监测技术(parallel reaction monitoring, PRM)是目前靶向蛋白质组学数据采集的主流方法,在3个对比组的共同丰度差异蛋白质中,选取了16个与抗逆性相关的靶蛋白,用PRM技术验证iTRAQ分析获得的蛋白质表达水平以及蛋白质的功能显著性。根据iTRAQ技术制备蛋白质提取液和胰蛋白酶消化液,然后将胰蛋白酶肽装载在C18捕获柱上进行脱盐,并在TripleTOF 5600 LC-MS/MS系统(AB SCIEX,Massachusetts,USA)上进行PRM验证,MS1和MS2采集分别在350~1500 M/Z和100~1500 M/Z范围内进行。将部分胰蛋白酶肽混合后,用质谱DD(Data- Dependent Acquisition)进行检测。利用Protein-Pilot软件对蛋白质进行鉴定,用Skyline软件(spectrum- library)对质谱数据进行处理,将目的肽M/Z加入到包含列表中,建立PRM采集方法,并通过混合样品的PRM数据采集进行优化和调整。采用优化的PRM质谱采集方法,采集每个样品的数据和PRM光谱文件,通过分析得到蛋白质的定量信息[18]。
1.8 数据统计
所有数据均采用EXCEL 2016、SPSS 22.0和Origin 8.0分析软件进行统计分析和作图。
2 结果与分析
2.1 不同类型土壤烤烟根系活力及氮代谢相关酶活性比较
由图1可知,红壤土和水稻土根系活力、硝酸还原酶(NR)活性和天冬氨酸合成酶(AS)活性显著高于沙壤土(<0.05),红壤土的谷氨酰胺合成酶(GS)活性显著高于水稻土和沙壤土(<0.05),表明不同土壤类型烤烟根系活力和氮代谢相关酶活性,均表现为红壤土>水稻土>沙壤土。
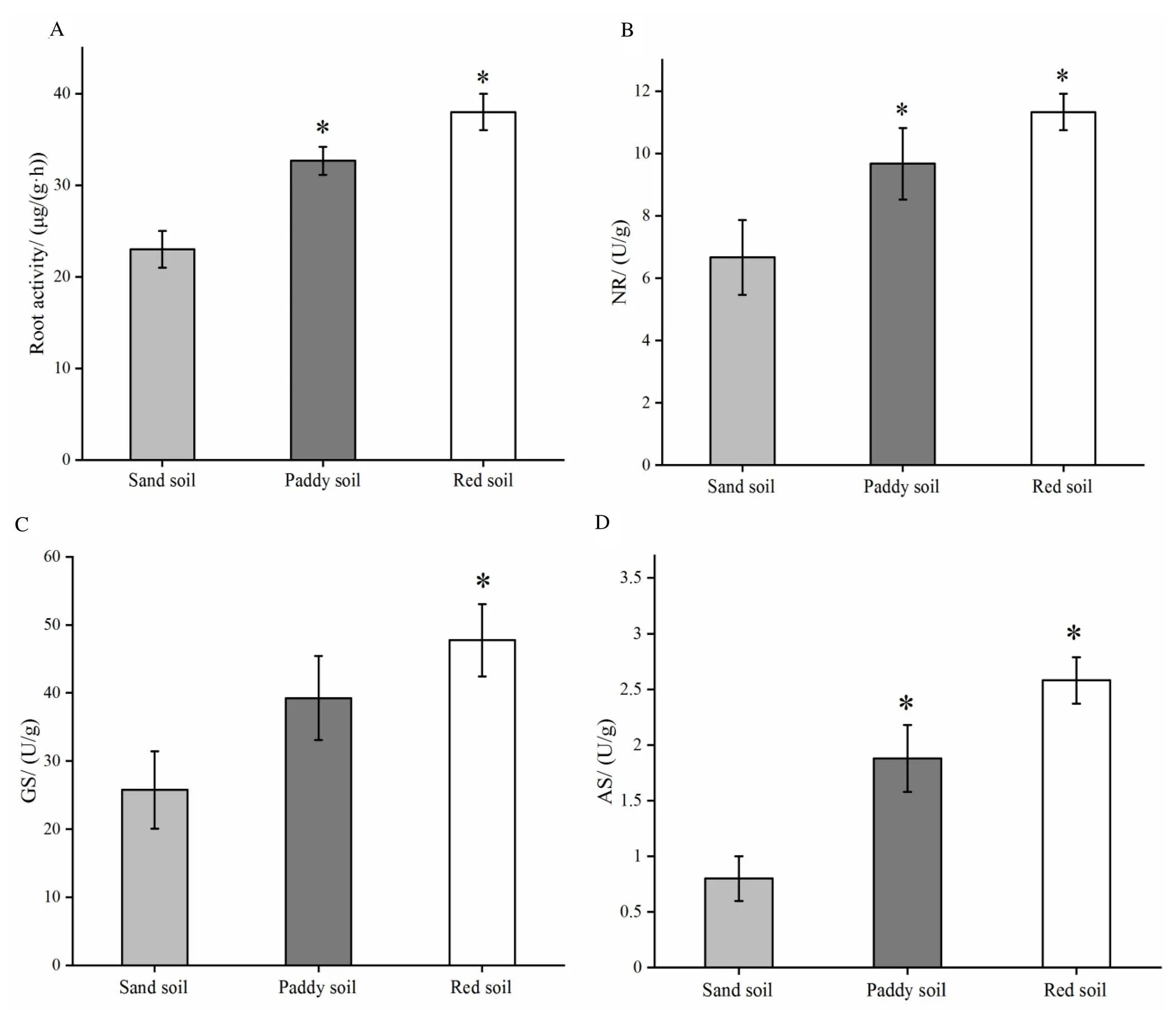
注:(A)根系活力;(B)为硝酸还原酶;(C)谷氨酰胺合成酶;(D)天冬氨酸合成酶;“*”表示不同类型土壤烤烟根系相关酶活在P<0.05水平差异显著
2.2 不同类型土壤烤烟根系iTRAQ定量分析
在不同烤烟根系样品中总共鉴定出1316466个二级图谱,搜索产生了459135个匹配质谱,鉴定到的特异肽段质谱的数量为23346,鉴定到的肽段数有33576,特异肽段数有13826,总共鉴定到1282个蛋白质(图3A)。在3次上机鉴定的总蛋白质中,2729个蛋白质有1个特异肽段,2470个蛋白质有2个特异肽段,1939个蛋白质有3个特异肽段,1761个蛋白质有11个特异肽段,其他的蛋白质有4~10个特异肽段(图3B)。鉴定的蛋白质相对分子质量主要分布在20~80 kDa,其中相对分子质量在20~30 kDa的蛋白质所占比例最高,为17.18%。鉴定覆盖率在0~10%的有337个蛋白质,覆盖率大于等于20%的蛋白质占总蛋白质数量的52.18%。
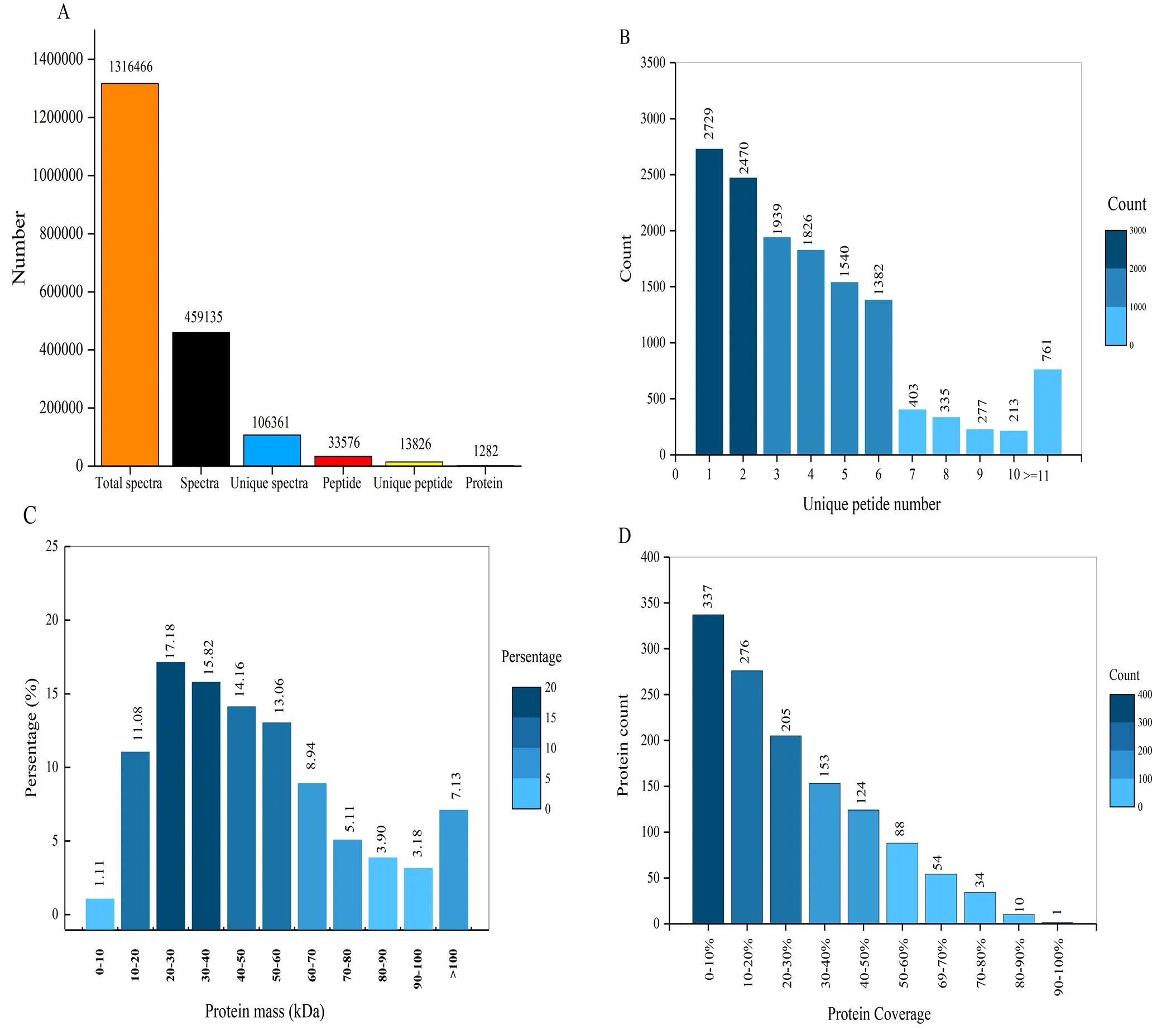
注:(A)烟叶样品蛋白质组鉴定;(B)蛋白质匹配的特异肽段数;(C)为烟叶样品蛋白质质量分布;(D)基于鉴定肽段的蛋白质覆盖范围
2.3 3组间共同差异蛋白分析
当iTRAQ分析得到的蛋白质差异倍数大于1.2倍或小于0.83倍,且值≤0.05时,蛋白质被鉴定为差异表达蛋白(上调显著性差异蛋白和下调显著性差异蛋白)。对已鉴定出的差异蛋白进行统计分析,发现PS vs SS、SS vs RS和PS vs RS这3个对比组中存在102个共同丰度差异蛋白质(图3),并利用R语言对这102个共同差异表达蛋白进行热图聚类分析,红色表示蛋白质在样品中的表达水平较高,蓝色表示表达水平较低(图4)。
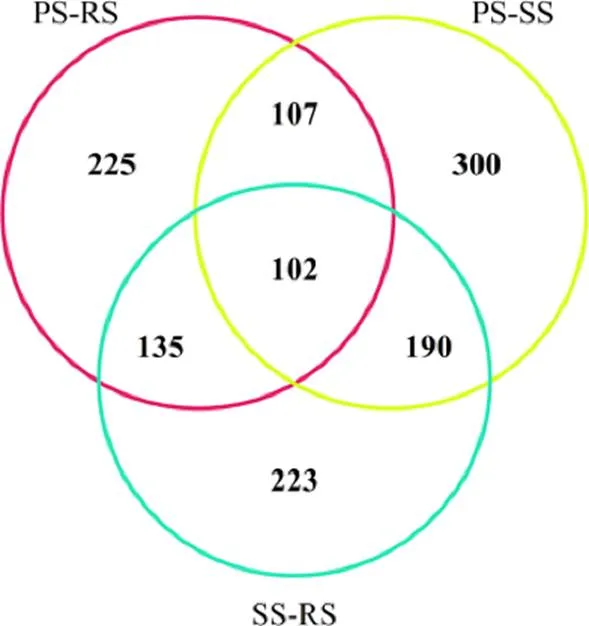
图3 3组间共同差异表达蛋白
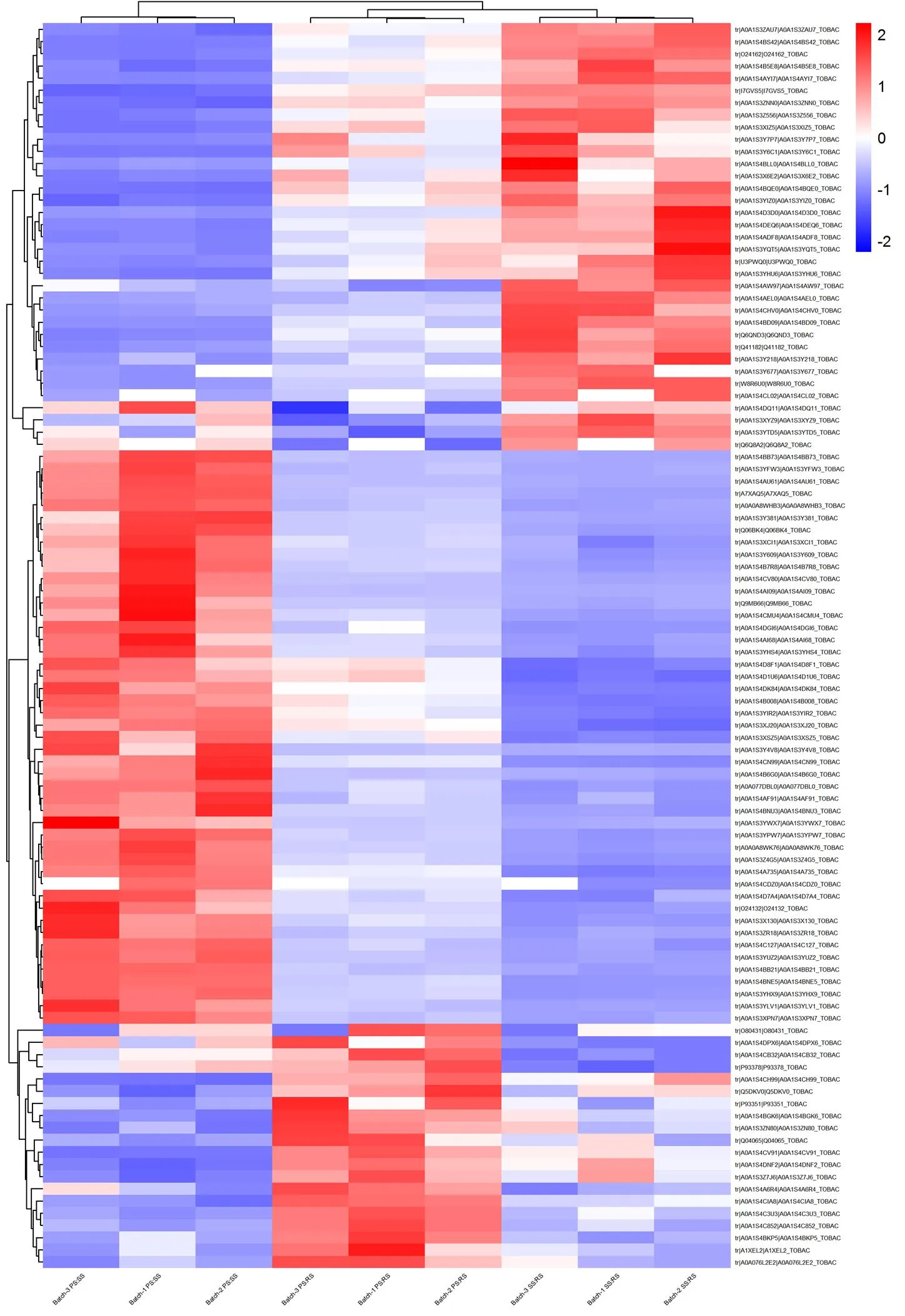
注:图中颜色所示为样品中蛋白质的相对表达水平。红色表示蛋白质在样品中的表达水平较高,蓝色表示表达水平较低。
2.4 3个对比组间差异蛋白火山图
火山图可以快速观察差异表达蛋白在总定量蛋白中的比例。本研究中利用蛋白表达量比值(即差异倍数FC)和T检验(t-test)-value将这部分显著变化的蛋白用不同颜色标示用以区分,即以log2(FC)为横坐标,以负对数-log10(-value)为纵坐标(以|FC|≥1.2,显著性≤0.05筛选差异表达蛋白)制作火山图。PS vs SS组共鉴定出699个差异表达蛋白质,包括412个上调的蛋白质和287个下调的蛋白质(图5A),在SS vs RS中,共获得了650个差异表达蛋白质,有291个上调的蛋白质和359个下调的蛋白质(图5B)。同样,PS vs RS组间有569个差异表达蛋白质,包括323个上调的蛋白质和246个下调的蛋白质(图5C)。这些蛋白质丰度的差异表明,烟草根系对不同土壤类型的响应具有复杂的生物学调控。
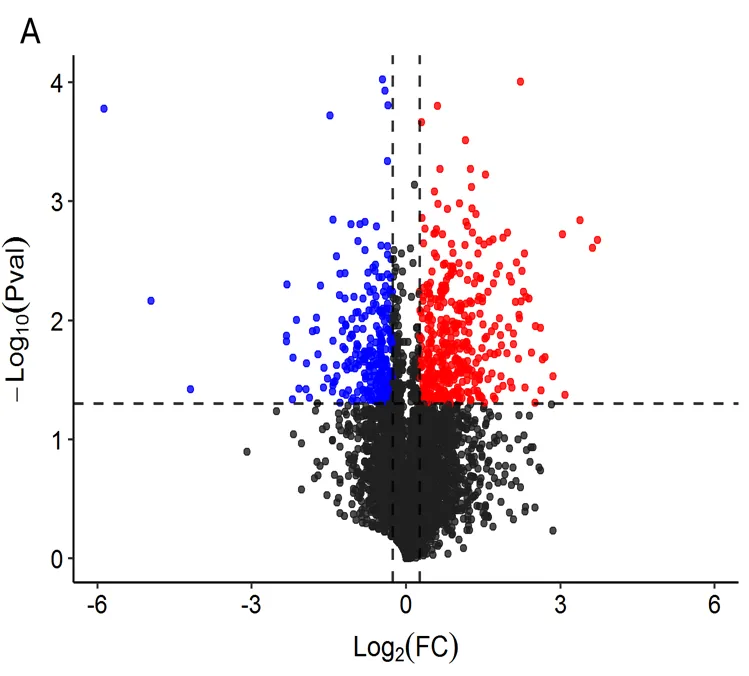
注:(A)PS vs SS差异蛋白;(B)SS vs RS差异蛋白;(C)PS vs RS差异蛋白;红色为上调蛋白,绿色为下调蛋白,黑色的为没有显著变化的蛋白。
2.5 差异蛋白质GO功能注释
图6A表示PS vs SS差异蛋白GO注释结果。在GO富集分析中,699个差异蛋白质富集到46个GO term(二级分类)中,分别参与了24个生物过程、11个细胞组成和11个分子功能。在生物过程条目中,差异蛋白主要富集在代谢过程(metabolic process)、细胞过程(cellular process)、应激反应(response to stimulus)等条目;在细胞组分条目中,差异蛋白质在细胞(cell)、细胞组分(cell part)、细胞器(organelle)占较大比例;在分子功能分类中,富集于前3位的条目分别是催化活性(catalytic activity)、结合(binding)、结构分子活动(structural molecule activity)。
图6B表示SS vs RS对比组的差异蛋白GO注释结果。在GO富集分析中,650个差异蛋白质富集到49个GO term中,分别参与了27个生物过程、11个细胞组成和11个分子功能。在生物过程条目中,差异蛋白在代谢过程、细胞过程、应激反应等条目占比较高;在细胞组分条目中,差异蛋白质主要富集在细胞、细胞组分和细胞器;在分子功能分类中,富集于前3位的条目分别是催化活性、结合和转运活性(transport- eractivity)。
图6C表示PS vs RS对比组的差异蛋白GO注释结果。在GO富集分析中,569个差异蛋白质富集到47个GO term中,分别参与了24个生物过程、11个细胞组成和12个分子功能。在生物过程中,差异蛋白主要富集在代谢过程、细胞过程应激反应和细胞成分的合成中;在细胞组成分类中,差异蛋白质主要富集在细胞和细胞组分;在分子功能分类中,差异蛋白在催化活性和结合2个功能条目的占比较大。
从总体上看,这些差异蛋白质具有多种分子功能,并参与了多种生物过程,说明烤烟根系对不同类型土壤的响应是一个复杂的生理生化过程,许多未知功能的蛋白质也被鉴定,这些蛋白质也参与烤烟根系对不同类型土壤的响应。
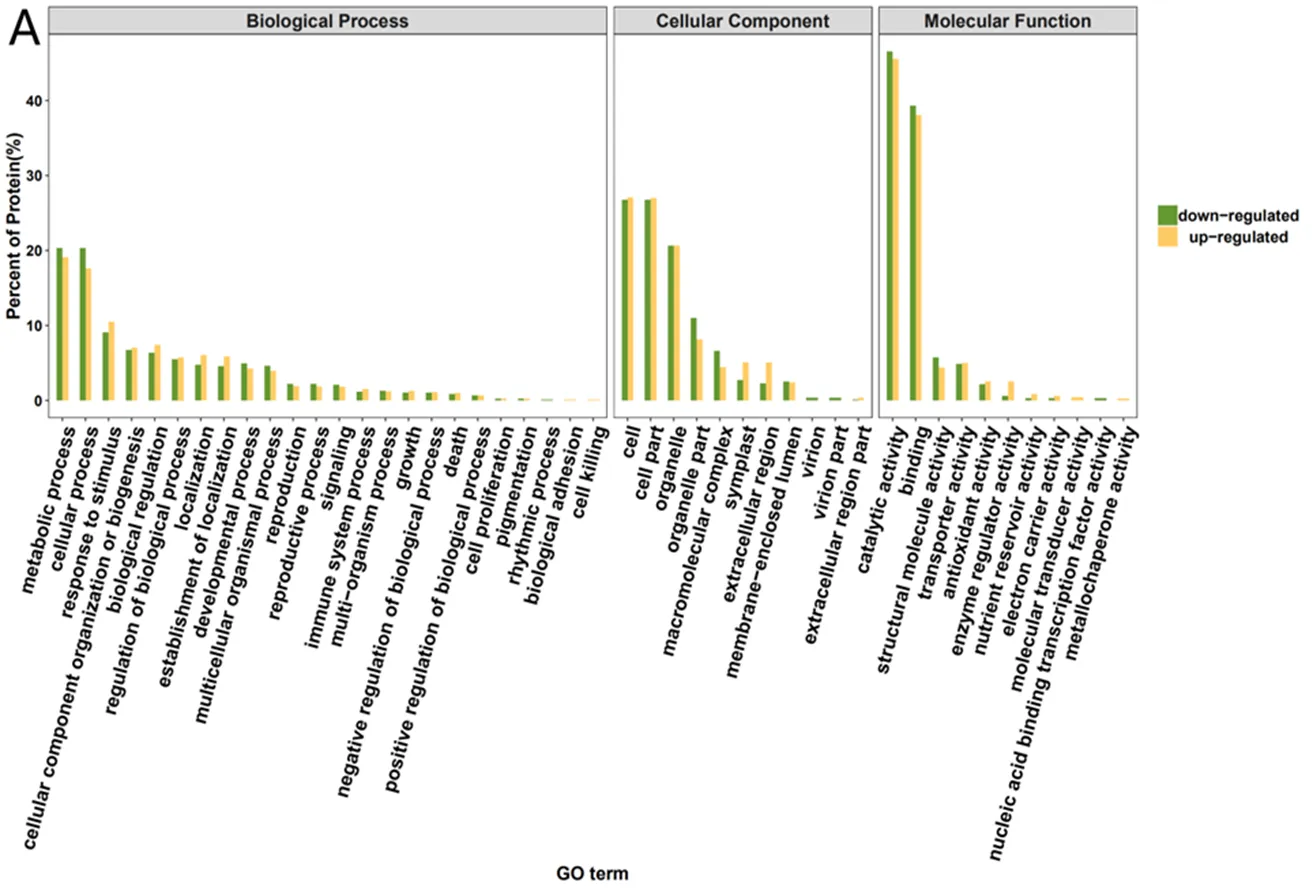
注:(A) PS vs SS;(B) SS vs RS;(C) PS vs RS。
图6 烤烟根系差异蛋白GO功能分类(分子功能、细胞组分、生物过程)
Fig.6 GO functional classification (molecular function, cellular component, biological process) of differentially expressed proteins in flue-tobacco roots
2.6 差异蛋白质KEGG富集分析
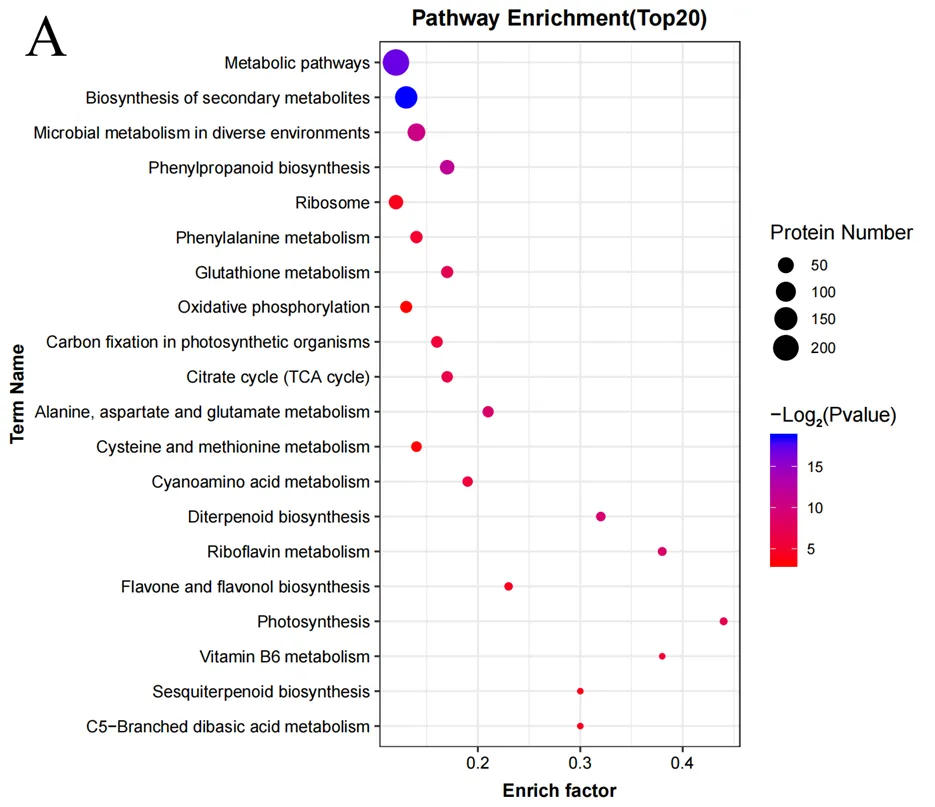
KEGG富集可以分析确定蛋白质参与的最主要生化代谢途径和信号转导途径。Pathway显著性富集分析发现,PS vs SS、SS vs RS和 PS vs RS三个对比组的差异蛋白显著富集于次生代谢产物的生物合成(Biosynthesisof secondary metabolites)、代谢途径(Metabolic pathways)和苯丙烷类生物合成(PHenylpropanoid biosynthesis)等代谢途径。
在PS vs SS组中(图7A),有520个差异蛋白质被注释到103条通路中,显著富集于15条代谢通路中(<0.05),差异蛋白质显著富集的前5条代谢通路分别为次生代谢产物生物合成途径、代谢途径、苯丙烷类生物合成、不同环境中的微生物代谢(Microbial metabolism in diverse environments)、二萜类生物合成(Diterpenoid biosynthesis)。
在SS vs RS组中(图7B),有444个差异蛋白质被注释到104条通路中,显著富集于18条代谢通路中(<0.05),差异蛋白质显著富集的前5条代谢通路分别为次生代谢产物生物合成、代谢途径、苯丙烷类生物合成、淀粉和蔗糖代谢(Starch and sucrose metabolism)和苯丙氨酸代谢(Phenylalanine metabolism)。
在PS vs RS比较组中(图7C),有398个差异蛋白质被注释到101条通路中,显著富集于15条代谢通路中(<0.05),差异蛋白质显著富集的前5条代谢通路分别为苯丙氨酸代谢、苯丙烷类生物合成、代谢途径、异喹啉生物碱生物合成(Isoquinoline alkaloid biosynthesis)、酪氨酸代谢(Tyrosine metabolism)。
2.7 差异蛋白质的PRM 验证
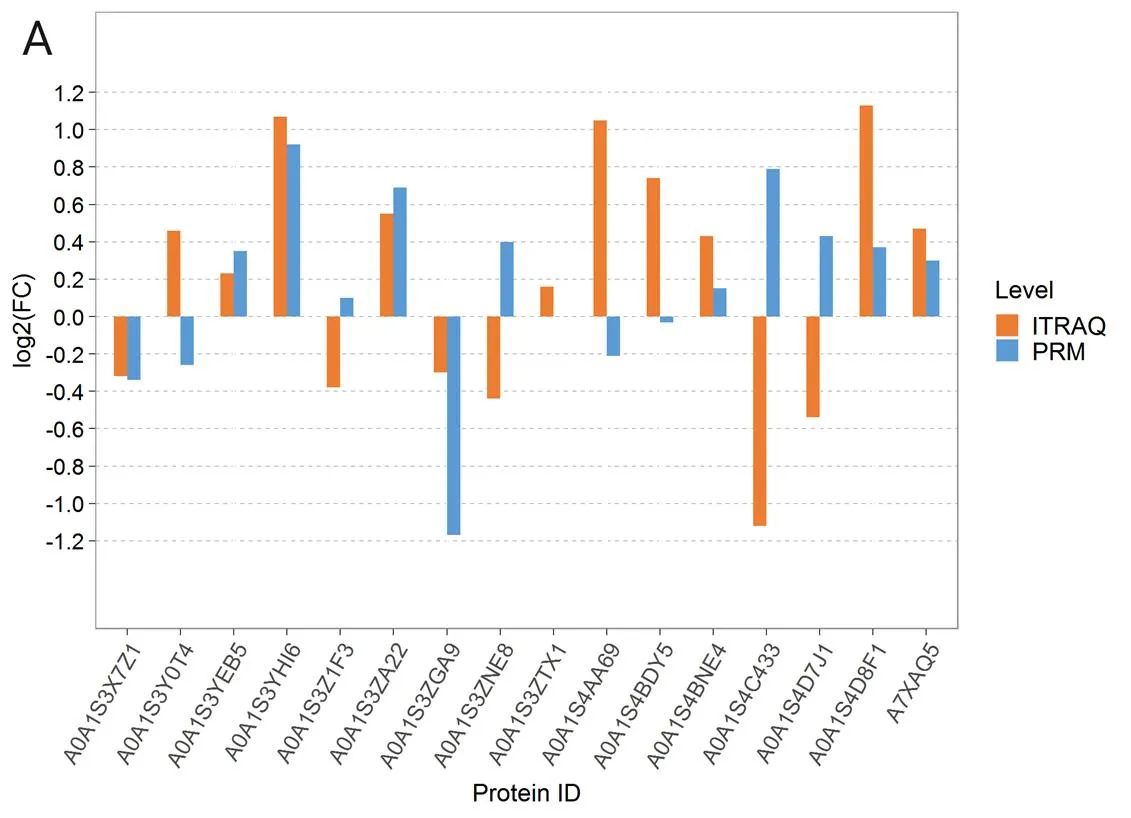
通过PRM对16个靶蛋白的表达水平进行定量分析,验证iTRAQ蛋白组学结果的可靠性(图8),结果表明,3个比较组间分别有8、11和11个蛋白质与iTRAQ结果一致,8、5和5个蛋白质与iTRAQ结果相反。验证结果表明,有5个蛋白质在3个对比组中均表现为与iTRAQ定量结果一致,包括A0A1S3YEB5,A0A1S3YHI6,A0A1S3ZA22,A0A1S4- BNE4,A7XAQ5。
3 讨论
3.1 烤烟根系活力及氮代谢相关酶活性
根系活力是反映根系代谢水平、合成化合物能力的生理指标[19],赵辉等[20]证明了烟草根系活性受土壤类型的影响。在本研究中,红壤土的根系活性显著高于水稻土和沙壤土,说明红壤土有利于烟株根系对土壤水分和养分的吸收利用,支持地上部分的生长。在不同类型土壤下,烤烟根系与氮代谢相关的酶包括NR、AS和GS活性呈现为红壤土>水稻土>沙壤土,说明烤烟根系氮代谢能力受土壤类型影响较大。王树会等[21]研究表明,不同类型土壤烤烟的NR活性变化动态和对氮素的吸收量具有显著差异,这与本研究有一致性。
3.2 与防御代谢相关的差异蛋白
在102个差异蛋白中,共筛选出21个与防御机制相关的蛋白,以A0A1S4C127为代表的过氧化物酶(POD)可以使毒性物质失活,使植物免受高浓度氧的毒性作用[22];以A0A1S3XIZ5为代表的谷胱甘肽S-转移酶(GST),是谷胱甘肽结合反应的关键酶,在解毒和抗虫方面有重要作用[23];以A0A1S4CH99为代表的果糖激酶曾被发现参与植物细胞的应激应答[24]。以I7GVS5为代表的热激蛋白具有分子伴侣功能,主要参与生物体内新生肽的运输、折叠、组装、定位以及变性蛋白的复性和降解,在细胞生命活动中起着重要的作用[25]。这些蛋白质在对比组PS vs SS中丰度降低,在SS vs RS和PS vs RS这两个对比组中丰度增加,推测不同类型土壤影响烤烟根系的防御机制,且调控网络较为复杂。
3.3 与碳水化合物与能量代谢相关的差异蛋白
蔗糖合成酶是蔗糖代谢关键酶,可催化蔗糖的分解和合成,在淀粉合成、碳代谢和固氮调节中起着重要作用[26]。在102个差异蛋白中存在A0A1S3YFR7、A0A1S4ACT4、A0A1S3ZPV3等蔗糖合酶,上述蔗糖合酶在比较组PS vs SS显著下调,在SS vs RS和PS vs RS中上调,这意味着烟草根系的蔗糖代谢可能受到不同类型土壤的影响,红壤土处理下烤烟根系的蔗糖合酶表达上调,说明在红壤土中烤烟根系的蔗糖代谢通路活性较强。有研究表明,三羧酸循环(tricarboxylic acid cycle, TCA)是有机体获得生命活动所需能量的主要途径,它为植物合成某些物质提供碳骨架[27]。参与TCA循环的几种差异蛋白质,包括比较组PS vs RS中的柠檬酸合成酶(W8SRJ8)上调;PS vs SS中的两个苹果酸脱氢酶(A0A1S3YXG6,A0A1S3ZI08)和琥珀酸脱氢酶(A0A1S4AC19)下调;SS vs RS中的延胡索酸水合酶(A0A1S3WYC1)和琥珀酸辅酶A连接酶(A0A1S3XSQ4)上调,说明相较于沙壤土和水稻土,红壤土烤烟根系与TCA循环相关的蛋白质表达上调,可能能量代谢能力较强。
3.4 与蛋白质合成能力相关的差异蛋白
核糖体蛋白质是合成蛋白质的细胞器,除参与蛋白质合成,核糖体蛋白质还具有广泛的核糖体外功能,如调控基因转录、mRNA翻译、细胞的增殖、分化和凋亡等[28]。尤垂淮等[29]研究表明,轮作烤烟根系核糖体蛋白质上调表达,蛋白质合成增加,有利于烤烟的生长,而复种连作烤烟根系蛋白质合成少,同时调控基因转录以及细胞生长发育能力降低,不利于烤烟的生长。本研究在3个比较组的102个共同差异蛋白中共筛选出8个核糖体蛋白质,其中有5个核糖体蛋白质在比较组SS vs RS和PS vs RS中上调,由此可以推测,相较于沙壤土和水稻土,红壤土的蛋白质合成增加,有可能利于烤烟生长。
4 结论
(1)相较于沙壤土和水稻土,红壤土有利于提高烤烟根系活力和NR、GS、AS等与氮代谢相关酶的活性;
(2)在不同烤烟根系样品中,总共鉴定出1282个定量蛋白,水稻土与沙壤土根系相比,发现699个差异蛋白,包括412 个上调蛋白与287个下调蛋白。沙壤土与红壤土根系相比,发现650个差异蛋白,其中291个表现为上调,359个表现为下调。水稻土与红壤土根系相比,发现569个差异蛋白质,包括323个上调蛋白和264个下调蛋白;
(3)在基因本体功能注释中,差异蛋白质主要参与代谢过程、细胞过程、应激反应等生物过程,存在于细胞、细胞组分和细胞器等部位,有催化、结合、转运活性等功能;
(4)通过京都基因与基因组百科全书分析,差异蛋白功能富集于次生代谢产物生物合成、代谢途径和苯丙烷类生物合成等代谢途径;
(5)红壤土烤烟根系的抗逆性、碳水化合物和能量代谢、蛋白质的合成等相关差异蛋白的表达均高于沙壤土和水稻土;
(6)在PRM验证中,3个对比组选择的16个蛋白质分别有8、11和11个蛋白质与iTRAQ结果一致。
[1] 杨林波,邵惠芳,章新军,等. 烟草根系研究进展[J]. 烟草科技,2002, (10): 45-48.
YANG Linbo, SHAO Huifang, ZHANG Xinjun, et al. Research progress of tobacco root system[J]. Tobacco Science & Technology, 2002(10): 45-48.
[2] 陈鹏宇,杨超,汪代斌,等. 基于盆栽试验的促根剂对低温条件下烤烟地上部生长和根系发育的影响[J]. 烟草科技,2021, 54(1): 17-23.
CHEN Pengyu, YANG Chao, WANG Daibin, et al. Effects of root-promoting agents on flue-cured tobacco’s shoot and root development grown at low temperature based on pot experiment[J]. Tobacco Science & Technology, 2021, 54(1): 17-23.
[3] 杜倩,郭凌珂,李冰,等. 两类土壤不同烤烟品种根际微生物变化特征[J]. 浙江农业科学,2020, 61(10): 1994-1998.
DU Qian, GUO Linke, LI Bing, et al. Variation characteristics of rhizosphere microorganisms of different flue cured tobacco varieties in two types of soil [J]. Journal of Zhejiang Agricultural Sciences, 2015(6): 152-154.
[4] 陈璐璐,冯秋红,孙建新,等. 川西亚高山岷江冷杉外生菌根形态随海拔梯度的分化[J]. 应用生态学报,2020, 31(9): 2911- 2922.
CHEN Lulu, FENG Qiuhong, SUN Jianxin, et al. Differentiation of ectomycorrhizal morphology ofin subalpine of Western Sichuan with altitude gradient[J]. Chinese Journal of Applied Ecology, 2020, 31(9): 2911-2922.
[5] 刘凯,党涛涛,王方斌,等. 不同毛管配置对水氮分布和机采棉根系生长的影响[J]. 水土保持学报,2021, 35(3): 268-275+283.
LIU Kai, DANG Taotao, WANG Fangbin, et al. Effects of different capillary configuration on water and nitrogen distribution and root growth of machine harvested cotton[J]. Journal of Soil and Water Conservation, 2021, 35(3): 268-275+283.
[6] 曾宇,叶协锋,符云鹏,等. 施加腐熟小麦秸秆对土壤容重及烤烟根系生长的影响[J]. 中国烟草学报,2014, 20(3): 68-72.
ZENG Yu, YE Xiefeng, FU Yunpeng, et al. Effects of decomposed wheat straw on soil bulk density and root growth of flue cured tobacco[J]. Chinese Tobacco Science, 2012, 33(1): 98-101.
[7] 赖勇林,杨旭健,吴道铭,等. 土壤栽培条件下根系生长非扰动观测根箱及其应用[J]. 农业工程学报,2013, 29(4): 174-182.
LAI Yonglin, YANG Xujian, WU Daoming, et al.Non disturbance observation of root growth in soil and its application[J]. Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(4): 174-182.
[8] 高林,董建新,武可峰,等. 土壤类型对烟草生长发育的影响研究进展[J]. 中国烟草科学,2012, 33(1): 98-101.
GAO Lin, DONG Jianxin, WU Kefeng, et al. Research progress on effects of soil types on tobacco growth and development[J]. Chinese Tobacco Science, 2012, 33(1): 98-101.
[9] 马新明,王小纯,倪纪恒,等. 不同土壤类型烟草根系发育特点研究[J]. 中国烟草学报,2003, (1): 40-45.
MA Xinming, WANG Xiaochun, NI Jiheng, et al. Study on the root development characteristics of tobacco in different soil types[J]. Chinese Tobacco Science, 2003, (1): 40-45.
[10] 高云,卢秀萍,许自成,等. 曲靖中海拔烟区不同土壤类型烤烟品质的差异比较[J]. 土壤通报,2017, 48(6): 1449- 1456.
GAO Yun, LU Xiuping, XU Zicheng, et al. Comparison of the quality of flue-cured tobacco of different soil types in the middle and West China Tobacco extraction areas of Qujing[J]. Chinese Journal of Soil Science, 2017, 48(06): 1449-1456.
[11] WU Shengjiang, GUO Yushuang, Joan Heren Issaka, et al. iTRAQ- based comparative proteomic analysis reveals high temperature accelerated leaf senescence of tobacco (L.) during flue-cuing [J]. Genomics, 2020, 112: 3075-3088.
[12] WU Shengjiang, CAO Gaoyi, ADIL Muhammad Faheem, et al. Changes in water loss and cell wall metabolism during postharvest withering of tobacco (L.) leaves using tandem mass tag-based quantitative proteomics approach [J]. Plant Physiology and Biochemistry, 2020, 150: 121-132.
[13] 何聪莲,郑志云,陈颐,等. 基于iTRAQ技术筛选烟叶响应衰老差异表达蛋白[J]. 中国烟草学报,2020, 26(3): 99-108.
HE Conglian, ZHENG Zhiyun, CHEN Yi, et al. Screening differentially expressed proteins in response to senescence of tobacco leaves based on iTRAQ[J]. Acta Tabacaria Sinica, 2020, 26(3): 99-108.
[14] Giannopolitis C N, Ries S K. Superoxide dismutases: I. occurrence in higher plants[J]. Plant Physiology, 1977, 59(2): 309-314.
[15] 朱秀云,梁梦,马玉. 根系活力的测定(TTC法)实验综述报告[J]. 广东化工,2020,47(6):211-212.
ZHU Xiuyun, LIANG Meng, MA Yu. A review report on the experiments for the determination of root activity by TTC method[J]. Guangdong Chemical Industry, 2020, 47(6):211-212.
[16] 祁忠达,韦艳,龙水庭,等. 基于TMT质谱分析技术筛选水稻根尖响应汞胁迫差异表达蛋白[J]. 生态学杂志,2019, 38(6): 1792-1799.
QI Zhongda, WEI Yan, LONG Shuiting, et al. Screening differentially expressed proteins in response to mercury stress in rice roots by proteomic quantification based on stable isotope labeling and parallel reaction monitoring[J]. Chinese Journal of Ecology, 2019, 38(6): 1792-1799.
[17] Ruiling L, Yuying W, Guozheng Q, et al. iTRAQ-based quantitative proteomic analysis reveals the role of the tonoplast in fruit senescence[J]. Journal of Proteomics, 2016, 146(13): 975-986
[18] Guo Hui, Chen Tianci, Liang Zhi, Fan Lanfen, Shen Yuchun, Zhou Dayan. iTRAQ and PRM-based comparative proteomic profiling in gills of white shrimpunder copper stress[J]. Chemosphere, 2021, 263.
[19] Mohammad S, Shukla A K, Rahul T, et al. Root activity and antioxidant enzyme activities of rice cultivass under different iron toxicity mitigation options[J]. Journal of the Indian Society of Soil Science, 2017, 65(3): 596-611.
[20] 赵辉,赵铭钦,程玉渊,等. 河南南阳烟区不同类型土壤的根际和非根际微生物及酶活性变化[J]. 土壤通报,2010, 41(5): 1057-1063.
ZHAO Hui, ZHAO Mingqin, CHENG Yuyuan, et al. Changes of rhizosphere and non rhizosphere microorganisms and enzyme activities in different types of soil in Nanyang Tobacco Growing Area of Henan Province[J]. Chinese Journal of Soil Science, 2010, 41(5): 1057-1063.
[21] 王树会,赵宪凤,刘卫群. 植烟土壤对云南滇中烤烟碳氮代谢及其代谢产物动态变化的影响[J]. 西南师范大学学报(自然科学版),2012, 37(12): 62-66.
WANG Shuhui, ZHAI Xianfeng, LIU Weiqun. Effects of tobacco planting soil on carbon and nitrogen metabolism and dynamic changes of metabolites of flue-cured tobacco in Central Yunnan[J]. Journal of Southwest Normal University(Natural Science Edition), 2012, 37(12): 62-66.
[22] 郭艳阳,刘佳,朱亚利,等. 玉米叶片光合和抗氧化酶活性对干旱胁迫的响应[J]. 植物生理学报,2018, 54(12): 1839-1846.
GUO Yanyang, LIU Jia, ZHU Yali, et al. Responses of photosynthetic and antioxidant enzyme activities in maize leaves to drought stress[J]. Plant Physiology Journal, 2018, 54(12):1839-1846.
[23] 朱守晶,史文娟. 苎麻谷胱甘肽-S-转移酶基因BnGSTU1的克隆和表达分析[J]. 植物遗传资源学报,2018, 19(6): 1197-1204.
ZHU Shoujing, SHI Wenjuan. Cloning and expression analysis of a glutathione-S-transferase genefrom Ramie ((.) Gaudich. )[J]. Journal of Plant Genetic Resources, 2018, 19(6): 1197-1204.
[24] 何亚飞,李霞,谢寅峰. 植物中糖信号及其对逆境调控的研究进展[J]. 植物生理学报,2016, 52(3): 241-249.
HE Yafei, LI Xia, XIE Yinfeng. Research progress in sugar signal and its regulation of stress in plan[J]. Plant Physiology Journal, 2016, 52(3): 241-249.
[25] 秦芳玲. 五种野生扁桃亚属植物种子营养组成和生境胁迫响应蛋白组学研究[D]. 西安:西北大学,2019.
QIN Fangling. Nutritional composition and proteomics study on seed stress response of five wild speciesplants seeds[D]. Xian: Northwest University, 2019.
[26] 李丽娜,孔建强. 植物蔗糖合酶的结构、功能及应用[J]. 中国生物化学与分子生物学报,2015, 31(9): 904-913.
LI Lina, KONG Jianqing. Structure, function and application of plant sucrose synthase[J]. Chinese Journal of Biochemistry Molecular Biology, 2015, 31(9): 904-913.
[27] 王得运,罗光明,刘培培,等. 植物响应淹涝的转录组学研究进展[J]. 生物技术通报,2019, 35(7): 156-161.
WANG Deyun, LUO Guangming, LIU Peipei, et al. Advances in transcriptomics of plant response to flooding[J]. Biotechnology Bulletin, 2019, 35(7): 156-161.
[28] Hu R, Zhu X, Xiang S, et al. Comparative proteomic analysis reveals differential protein and energy metabolisms from two tobacco cultivars in response to cold stress[J]. Acta Physiologiae Plantarum, 2018, 40: 19.
[29] 尤垂淮,陈冬梅,黄锦文,等. 不同种植方式下烤烟根系差异表达蛋白质分析[J]. 中国烟草科学,2014, 35(1): 89-95.
YOU Chuihuai, CHEN Dongmei, HUANG Jinwen, et al. Analysis of differentially expressed proteins in flue-cured tobacco roots under different planting methods[J]. Chinese Tobacco Science, 2014, 35(1): 89-95.
Screening of differentially expressed proteins in flue-cured tobacco roots in different soil types based on iTRAQ-PRM
YANG Rui1,2, ZHA Wenju3, CHEN Yi1, HE Chenggang2, WANG Tao3, HE Conglian2, FEI Mingliang1*
1 Agronomy Research Center, Yunnan Academy of Tobacco Agriculture Science, Kunming 650031, Yunnan, China;2 College of Tobacco Science, Yunnan Agricultural University, Kunming 650201, Yunnan, China;3 Qujing tobacco company of Yunnan, Qujing 671000, Yunnan, China
[Background] This study aims to reveal the response of flue-cured tobacco roots to different types of soil at the protein level.[Methods] Using flue-cured tobacco variety K326 as material, the root activity, nitrate reductase (NR), glutamine synthetase (GS) and aspartate synthetase (AS) activities of flue-cured tobacco roots in three types of soil including calcareous soil (sandy soil), paddy soil and red soil were measured. iTRAQ technology was used to identify the differentially expressed proteins of flue-cured tobacco roots in three types of soil, and the obtained differential proteins were analyzed by bioinformatics. On this basis,16 proteins were selected for parallel reaction monitoring (PRM) validation. [Results] (1) The root activity and activities of NR, GS, AS of flue-cured tobacco roots in red soil were higher than those in sandy soil and paddy soil ; (2) 699, 650 and 569 differentially expressed proteins were identified from the comparison of paddy soil vs sandy soil, sandy soil vs red soil, paddy soil vs red soil, respectively. The up-regulated/down regulated proteins were 412/287, 291/359 and 323/246, respectively; (3) Differentially expressed proteins are mainly involved in metabolic process, cellular process, stress response and other biological processes. They exist in cells, cell components and organelles, and have catalytic activity, binding activity and transport activity; (4) Their functions are enriched in the biosynthesis and metabolic pathways of secondary metabolites and phenylpropanoid biosynthesis; (5) The stress resistance, carbohydrate and energy metabolism, and protein synthesis of flue-cured tobacco roots in red soil were higher than those in sandy soil and paddy soil; (6) PRM analysis showed that results of iTRAQ proteomics were correct and reliable. [Conclusion] iTRAQ labeling technology was used to screen the root differentially expressed proteins of flue-cured tobacco in different types of soil combined with PRM verification technology, which provided some theoretical basis and technical support for choosing the appropriate soil type, formulating reasonable cultivation technology and producing high-quality tobacco.
iTRAQ; tobacco root system; soil type; nitrogen metabolism; proteomics
Corresponding author. Email:258181714@qq.com
杨睿,查文菊,陈颐,等. 基于iTRAQ-PRM技术筛选不同类型土壤烤烟根系差异表达蛋白[J]. 中国烟草学报,2022,28(1). YANG Rui, ZHA Wenju, CHEN Yi, et al. Screening of differentially expressed proteins in flue-cured tobacco roots in different soil types based on iTRAQ-PRM [J]. Acta Tabacaria Sinica,2022, 28(1).doi: 10.16472/j.chinatobacco. 2021.121

