促生菌对Cd胁迫下蒌蒿光合特性的影响
周小梅, 董 萌, 余红兵,, 谭淑端, 杨 楠
(1.湖南城市学院建筑与城市规划学院, 湖南 益阳 413000; 2. 数字化城乡空间规划关键技术湖南省重点实验室,湖南 益阳 413000; 3. 湖南省城乡生态规划与修复工程技术研究中心, 湖南 益阳 413000; 4.湖南省村镇饮用水水质安全保障工程技术研究中心, 湖南 益阳 413000)
Cd是一种典型的土壤污染物,环保部和国土资源部2014年联合发布的《全国土壤污染状况调查公报》显示:我国土壤环境中Cd点位超标率为7.0%[1]。Cd毒性极强,非生物体生命活动的必需元素,由于其极强的移动性,极易通过食物链危害人体的健康。相比于传统的物理与化学方法,生物修复技术由于其经济、环保、无污染等特点,是当前公认的一种环境友好型污染治理技术。
洞庭湖区是湖南省及至全国比较重要的粮食生产基地,其湿地土壤Cd污染较为严重[2-3]。蒌蒿(Artemisiaselengensis)是洞庭湖湿地优势植物,多年生草本,菊科蒿属,适合刈割、无性繁殖,对Cd具较强耐性,是洞庭湖湿地土壤实施Cd污染修复的理想选择[4]。
促生菌(Plant growth-promoting bacteria,PGPB)能够与植物建立良好的协同互惠关系,在重金属污染土壤的修复过程中可发挥重要作用[5-7]。近年围绕促生菌在重金属污染土壤植物修复方面的运用已作了大量的研究,研究主要集中于对植物生长、解毒、生防、对重金属的生物有效性及其转运机制等方面的探究[8-9]。光合作用是植物生长的物质基础,Cd胁迫影响植物叶绿素合成、光合气体交换、叶绿素荧光特性以及植物对土壤中光合矿质元素的吸收等,从而导致植物代谢紊乱,影响整个生长发育及生命活动[10-11]。促生菌可提高植物的光合作用,促进植物的生长,但由于植物种类和接种菌株的不同,不同植物对促生菌的反映不完全一致。刘美琪等[12研究表明,接种促生菌裸燕麦各时期的净光合速率(Pn),蒸腾速率(Tr),气孔导度(Gs),叶片胞间CO2浓度(Ci)均显著高于对照;袁宗胜等[13]研究显示,促生菌处理后芳樟叶片光合速率、蒸腾速率和气孔导度均有所提高,但芳樟叶片胞间CO2浓度降低。促生菌的接种方式可分为单接、混合接。一般认为,单接优于不接,混合接优于单接[14-15]。另外,促生菌对Cd胁迫下植物光合作用的影响研究也已不乏报道[16],但研究多集中于对植物光合色素的探究,缺少对Cd胁迫下植物光合特性的系统性分析,当前关于促生菌对Cd胁迫下植物光合作用的机理尚不甚清楚。
鉴于此,本研究以具促生功能的Bacillussp.T3,PantoeaagglomeransJ2,PseudomonasfluorescensY5的混合菌剂为对象,通过盆栽试验,系统分析在促生菌作用下蒌蒿光合气体交换、光合色素、光合矿质元素和叶绿素荧光参数等光合指标对不同浓度Cd胁迫的响应,以揭示促生菌对Cd胁迫下蒌蒿光合特性的作用机理,欲为洞庭湖湿地土壤Cd污染修复建构有效的生物技术提供科学依据。
1 材料与方法
1.1 供试材料
1.1.1促生菌由T3,J2和Y5菌株的菌悬液混合而成,T3菌株为芽孢杆菌(Bacillussp.)分离于蒌蒿的根际土壤,能合成铁载体、产酸,对Cd2+的耐受浓度为50 mg·L-1[17],J2和Y5菌株分离于蒌蒿的茎叶中,分别为成团泛菌(Pantoeaagglomerans)和荧光假单胞菌(Pseudomonasfluorescens),能分泌吲哚乙酸(IAA),对Cd2+的耐受浓度为90 mg·L-1[18]。供试菌株分别接种于LB液体培养基中,30℃,150 rpm震荡培养72 h,菌液4℃,8 000 rpm离心 5 min,无菌生理盐水润洗2次。为确保各菌株的试验用量一致,用无菌生理盐水将各菌液浓度调节至1×108cfu·mL-1,各菌液等量混合制成接种菌剂。
1.1.2基质购自湖南红星大市场,由草炭、蛭石和珍珠岩混合而成,经测定有机质含量为395 g·kg-1,全P含量为1.15 g·kg-1,全N含量为11.6 g·kg-1,全K含量为10.2 g·kg-1,全Cd含量为0.25 mg·kg-1,pH值为6.85,自然风干且高压蒸汽灭菌2遍后,添加CdCl2溶液,Cd2+浓度为0 mg·kg-1(Cd0),10 mg·kg-1(Cd10),20 mg·kg-1(Cd20),30 mg·kg-1(Cd30),拌匀平衡备用。
1.1.3蒌蒿取自南洞庭湖管竹山(112°19′33.4″E,28°55′14.9″N),栽种于湖南城市学院苗圃大棚,为保证试验用苗的一致性,剪取带3芽的蒌蒿茎段若干进行扦插,正常养护管理,待成活后选择长势基本一致的蒌蒿苗用于试验处理。
1.2 试验设计
2016年3月10日,将平衡了3周的基质进行装钵处理。钵大小为:上口径10.5 cm,底径7.5 cm,高9.5 cm,称取基质500 g,与菌剂150 mL充分混匀,然后装钵,以等量无菌生理盐水为对照(CK)。选取带3片完全展开叶且长势基本一致的蒌蒿扦插苗移栽于营养钵,每处理移栽12钵,浇透水。于苗圃大棚[温度为(28±2)℃,相对湿度(65±5)%]正常养护管理30天后进行各指标的测定。
1.3 测定方法
1.3.1光合气体交换参数于2016年4月10日上午9∶00-11∶30进行测定,采用美国Li-Cor公司的Li-6400型光合仪,选取蒌蒿上部第2片完全展开叶进行净光合速率(Pn),气孔导度(Gs),蒸腾速率(Tr)和胞间CO2浓度(Ci)的测定,每测定重复3次。测定时光照强度为1 000 μmol·m-2·s-1光量子,气流速度为50 μmol·s-1,专用内置红光源,叶室温度28℃左右。
1.3.2光合色素于2016年4月11日上午采摘蒌蒿上部第3叶于冰盒中带回实验室,称取0.5 g,采用80%的丙酮进行浸提,参考李合生[19]的方法进行叶绿素a,叶绿素b和类胡萝卜素含量的测定。
1.3.3光合矿质元素每处理随机选取蒌蒿植物6钵,剪取叶片,去离子水冲冼干净,置于烘箱中,105℃杀青15 min,70℃下烘干至恒重,研磨粉碎,称取0.2 g样品,参照梁泰帅等[8]方法进行消解,用流动注射分析仪测定N,P含量,原子吸收分光光度计测定K,Fe,Zn,Ca,Mg,S,Cd含量。
1.3.4叶绿素荧光参数选取蒌蒿上部第2片完全展开叶,采用德国Walz公司的Imaging PAM叶绿素荧光仪进行测定,测定前暗适应20 min,Kinetics窗口检测各参数的动力学变化曲线,PSⅡ最大光化学效率(Fv/Fm),实际光化学量子产量(Yield),相对电子传递速率(rETR),光化学荧光淬灭系数(qP),非光化学荧光淬灭系数(NPQ)等数据从Report窗口导出。
1.4 统计分析
所有数据均为3次重复的平均值,以平均值±标准差表示,Excel 2010进行数据整理并绘图,SPSS 26.0进行差异显著性分析。
2 结果与分析
2.1 促生菌对Cd胁迫下蒌蒿光合气体交换的影响
Cd胁迫使蒌蒿体内的净光合速率、气孔导度以及蒸腾速率均显著下降(图1A,1B,1C),而胞间CO2浓度呈先降后升的趋势,当Cd胁迫浓度为Cd20时降幅显著(图1D)。促生菌可缓解Cd胁迫对蒌蒿光合作用的抑制效应,促生菌使Cd胁迫下蒌蒿净光合速率、气孔导度及蒸腾速率均有不同程度地增加,其中净光合速率在所有的Cd胁迫水平下均显著增加,增幅为13.7%~28.6%(图1A),气孔导度在Cd胁迫浓度为Cd30时显著增加44.1%(图1B),蒸腾速率在Cd胁迫浓度为Cd0,Cd10,Cd30时显著增加14.3%,21.4%,39.7%(图1C)。促生菌使Cd胁迫下蒌蒿细胞间CO2浓度下降,在Cd胁迫浓度为Cd0,Cd10,Cd20时显著下降7.6%,8.3%,10.1%(图1D)。
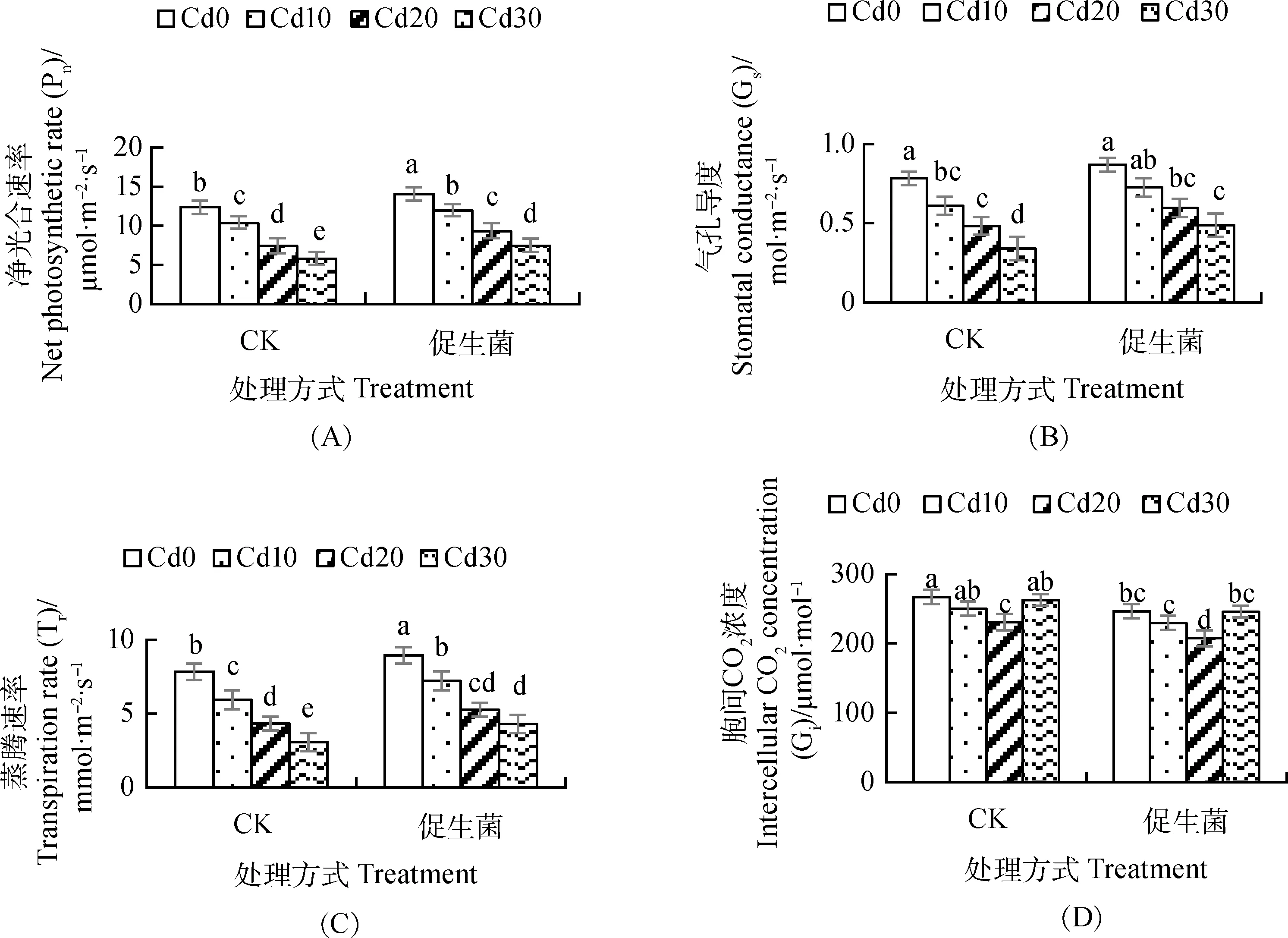
图1 促生菌对Cd胁迫下蒌蒿光合气体交换的影响Fig.1 Effects of PGPB on photosynthetic gas exchange of Artemisia selengensis under cadmium stress注:不同小写字母代表不同处理在 0.05 水平差异显著(P<0.05)。下图同Note:Different lowercase letters represent significant differences between treatments at 0.05 level (P<0.05). The same as below
2.2促生菌对Cd胁迫下蒌蒿光合色素的影响
Cd胁迫下蒌蒿叶绿素a,叶绿素b,总叶绿素以及类胡萝卜素含量均呈先升后降的趋势,在Cd胁迫浓度为Cd10时达最大值(图2A,2B,2C,2E),叶绿素a/b和类胡萝卜素/总叶绿素随Cd胁迫浓度的增加而增大,在Cd胁迫浓度为Cd30时显著增加14.6%和26.9%(图2D,2F)。促生菌有利于Cd胁迫下蒌蒿叶绿素a,叶绿素b,总叶绿素和类胡萝卜素含量的增加,叶绿素a含量在Cd胁迫浓度为Cd30时显著增加23.9%(图2A),叶绿素b含量在Cd胁迫浓度为Cd10~ Cd30时显著增加,增幅为16.2%~24.6%(图2B),总叶绿素含量在Cd胁迫浓度为Cd20,Cd30时显著增加9.6%,23.9%(图2C),类胡萝卜素含量在Cd胁迫浓度为Cd30时显著增加20.0%(图2E)。促生菌降低了Cd胁迫下蒌蒿叶绿素a/b的值,并呈先降后升的趋势,在Cd胁迫浓度为Cd20时显著降低15.7%(图2D)。促生菌对Cd胁迫下蒌蒿体内类胡萝卜素/总叶绿素无显著影响(图2F)。

图2 促生菌对Cd胁迫下蒌蒿光合色素的影响Fig.2 Effects of PGPB on photosynthetic pigments of Artemisia selengensis under cadmium stress
2.3 促生菌对Cd胁迫下蒌蒿叶绿素荧光参数的影响
Cd胁迫使蒌蒿体内的最大光化学效率、实际光化学量子产量、相对电子传递速率、光化学淬灭系数均呈下降趋势(图3A,3B,3C,3D),非光化学淬灭系数随Cd胁迫浓度的增加而上升(图3E)。促生菌使Cd胁迫下蒌蒿体内的最大光化学效率、实际光化学量子产量、相对电子传递速率、光化学淬灭系系数均显著增加,非光化学淬灭系数显著降低,最大光化学效率在Cd胁迫浓度为Cd20,Cd30时显著增加12.9%,18.0%(图3A),实际光化学量子产量在Cd胁迫浓度为Cd0,Cd10,Cd30时显著增加12.5%,18.4%,25.8%(图3B),相对电子传递速率在Cd胁迫浓度为Cd10~ Cd30时显著增加8.4%~14.6%(图3C),光化学淬灭系系数在Cd胁迫浓度为Cd10~ Cd30时显著增加14.3%~20.0%(图3D),非光化学淬灭系数在在Cd胁迫浓度为Cd10~ Cd30时显著减少11.1%~53.8%(图3E)。

图3 促生菌对Cd胁迫下蒌蒿叶绿素荧光参数的影响Fig.3 Effects of PGPB on chlorophyll fluorescence parameters of Artemisia selengensis under cadmium stress
2.4 促生菌对Cd胁迫下蒌蒿光合矿质元素的影响
Cd胁迫对蒌蒿N,K的吸收无明显影响,对S,Cd的影响随Cd胁迫浓度的增加而增加,对蒌蒿P,Fe,Zn,Ca,Mg的影响随Cd胁迫浓度的增加呈下降趋势(表1)。促生菌对Cd胁迫下蒌蒿N,Zn的吸收无显著影响,促生菌有利于Cd胁迫下蒌蒿对Cd,P,K,Fe,Ca,Mg,S的吸收,P,K分别显著增加2.2%~4.1%,0.5%~0.7%,Cd在胁迫浓度为Cd10,Cd20,Cd30时显著增加21.0%,99.3%,79.7%,Fe在Cd胁迫浓度为Cd0,Cd10,Cd20时显著增加2.8%,3.7%,2.7%,Ca在Cd胁迫浓度为Cd30时显著增加11.9%,Mg在Cd胁迫浓度为Cd20,Cd30时显著增加2.7%,5.2%,S在Cd胁迫浓度为Cd30时显著增加2.5%(表1)。

表1 促生菌对Cd胁迫下蒌蒿光合矿质元素的影响Table1 Effects of PGPB on photosynthetic mineral elements of Artemisia selengensis under cadmium stress 单位:mg·kg-1DW
3 讨论
3.1 促生菌对Cd胁迫下蒌蒿光合气体交换的影响
光合作用是绿色植物最重要的生理活动,为地球上生命的生存和繁衍提供物质和能量[20]。Cd是一种光合抑制剂,Cd胁迫会影响植物体内水分平衡,阻碍气孔的打开,导致黄瓜净光合速率和蒸腾速率的下降[21]。无论接菌与否,Cd胁迫下蒌蒿的净光合速率、蒸腾速率和气孔导度均显著低于非Cd胁迫,由此可见,Cd胁迫对蒌蒿光合产生抑制。相关研究表明,接种促生菌可明显改善裸燕麦的气孔限制,促进其净光合速率和蒸腾速率的增加[12]。本研究发现,接种促生菌,蒌蒿的净光合速率、蒸腾速率和气孔导度明显高于单一Cd胁迫,证明接种促生菌缓解了Cd胁迫对蒌蒿光合的限制,这与文献报道结果一致。但也有不同的报道,Arkhipova等[22]发现接种能分泌细胞分裂素的Bacillussp.IB-22,莴苣的气孔导度并没有提高。产生差异的原因可能是促生菌的生理特性不一样,也可能是试验材料的不同而异。Cd胁迫导致植物光合伤害的机理可分为气孔因子和非气孔因子,非气孔因子主要表现为叶肉细胞光合活性的降低,胞间CO2浓度的变化可作为气孔因子和非气孔因子的评判依据[23]。一般认为,植物净光合速率、气孔导度与胞间CO2浓度均下降,则为气孔因子的限制,如果植物净光合速率和气孔导度的下降伴随胞间CO2浓度的上升,则表现为非气孔因子的伤害。本研究结果显示,蒌蒿净光合速率和气孔导度随Cd胁迫浓度的增加而下降,而胞间CO2浓度表现为先降后升,表明Cd胁迫对蒌蒿气孔的伤害与Cd胁迫浓度有关,浓度较低时主要表现为气孔限制,而浓度较高时则主要表现为非气孔限制,这与Cd胁迫龙葵的结果相似[24]。Cd胁迫下蒌蒿叶绿素含量的变化趋势也证明了这一点(图2A,2B,2C)。接种促生菌明显增加蒌蒿净光合速率和气孔导度,显著降低胞间CO2浓度,分析原因可能是由于促生菌的运用增强了蒌蒿叶肉细胞的光合活性,进一步调节了Cd胁迫对蒌蒿气孔因子与非气孔因子的影响。
3.2 促生菌对Cd胁迫下蒌蒿光合色素的影响
光合色素可分为叶绿素和类胡萝卜素,叶绿素是植物光合光能捕获的关键物质,其含量高低在某种程度上可体现植物光合及抗逆性的强弱[25-26]。Cd胁迫通常会导致叶绿素含量的下降,与Cd影响氨基-γ-戊酮酸的合成和抑制原叶绿素酯氧还酶的活性有关,也与Cd破坏叶绿体的结构有关[27]。而本研究中,叶绿素a,叶绿素b,总叶绿素含量呈先升后降的趋势,表明Cd胁迫对蒌蒿叶绿素含量的影响存在剂量效应,低浓度Cd具有一定的毒物兴奋作用。相关研究表明,接种促生菌可提高甘蓝型油菜和番茄的抗逆性,保障其叶绿素酶的催化能力,提高其叶绿素含量[28-29]。本研究结果显示,蒌蒿叶绿素a,叶绿素b和总叶绿素含量在促生菌的作用下明显增加,表明接种促生菌提高了蒌蒿的抗逆性并改善Cd胁迫对蒌蒿叶绿素酶活性和叶绿体结构的影响,这与文献报道结果相似;蒌蒿叶绿素a/b值显著降低,说明叶绿素b比叶绿素a增加得更多,叶绿素b主要存在于光系统的天线组分中,表明接种促生菌蒌蒿叶片吸收和传递到光系统反应中心的光能增多;类胡萝卜素属于天线色素兼具光保护的功能,可吸收多余光能并以热能的形式释放,促生菌作用下蒌蒿类胡萝卜素含量增加,说明接种促生菌后蒌蒿叶片在吸收较多光能的同时开启了自保护机制,避免其叶绿体在强光下受到伤害,这与前人的相关研究结论一致[25];但蒌蒿叶绿素a/b值在Cd胁迫浓度为Cd20时显著减少,而类胡萝卜素含量是在Cd胁迫浓度为Cd30时显著增加,两者变化不完全同步,究其原因可能与促生菌对光能的利用有关,也可能是蒌蒿适应Cd胁迫的一种自我保护。
3.3 促生菌对Cd胁迫下蒌蒿叶绿素荧光参数的影响
叶绿素荧光参数反映植物光合过程中光能的吸收、传递、耗散和分配情况[21]。最大光化学效率对环境胁迫比较敏感,可作为植物PSⅡ受伤害程度的判断指标[27]。正常情况下植物叶片最大光化学效率为0.75~0.85[30]。单一Cd胁迫蒌蒿最大光化学效率均低于0.75,接菌后蒌蒿最大光化学效率有所提高,表明促生菌降低了Cd胁迫对蒌蒿PSⅡ的伤害程度。实际光化学量子产量和相对电子传递速率用于反映环境胁迫下植物PSⅡ的光化学活性[31-32]。Cd胁迫下蒌蒿的实际光化学量子产量和相对电子传递速率均下降,Cd2+一旦进入叶绿体便会与类囊体膜上的巯基结合导致蛋白变性,会替代放氧复合体中Ca/Mn聚集体上的Ca2+[23],从而降低蒌蒿的PSⅡ的光化学活性。促生菌显著提高Cd胁迫下蒌蒿的实际光化学量子产量和相对电子传递速率,缓解Cd胁迫对蒌蒿PSⅡ光化学的抑制。光化学淬灭系数表示天线色素所吸收光能的光合电子传递的情况而非光化学淬灭系数表示光能的热耗散部分[23,33]。Cd胁迫下蒌蒿光化学淬灭系数下降而非光化学淬灭系数随Cd胁迫浓度的增加而增加,说明蒌蒿在Cd胁迫下启动了光保护机制,减少光化学途径能量的传递,避免光氧化胁迫对光合机制的进一步伤害,这与Cd胁迫结缕草的结论相似[27]。接种促生菌,蒌蒿的光化学淬灭系数增加,非光化学淬灭系数减少,表明促生菌提高了蒌蒿对所吸收光能的转化,更多用于驱动光化学反应,提高蒌蒿对光能的利用效率。
3.4 促生菌对Cd胁迫下蒌蒿光合矿质元素的影响
矿质元素直接或间接影响光合作用,Cd胁迫影响植物对矿质元素的吸收和改变植物体内的化学物质,致使光合的下降。研究表明Cd2+通过取代1,5-二磷酸核酮糖羧化酶(Rubisco)活性中心的Mg2+,改变Rubisco结构,导致其活性的下降,影响CO2的固定[34]。植物体内聚集的Cd2+会替代叶绿素卟啉环中的Mg2+,形成了“Cd替代叶绿素”,影响电子释放[35]。Cd2+和Ca2+的化学性质极其相似,Cd2+会与Ca2+竞争离子通道和载体蛋白,阻碍Ca2+信号传递,影响叶绿素的合成[36]。Cd2+会替代PSII放氧复合体中Ca/Mn聚集体上的Ca2+,影响水的光解和电子释放[37-38]。Cd2+和Zn2+是一对竞争性阳离子,会竞争相似的活性位点,引起植物的Cd中毒[39]。本研究发现,Cd胁迫下蒌蒿体内Cd含量显著增加,并且Cd胁迫对蒌蒿Zn,Ca,Mg的吸收产生拮抗作用,这与Cd胁迫黑麦草的试验结果一致[40]。Cd胁迫与Zn,Ca,Mg产生竞争,可能会形成“Cd替代叶绿素”,可能会影响Rubisco活性,也可能会取代Ca/Mn聚集体上的Ca2+,影响水的光解或与Zn竞争活性位点等,导致蒌蒿光合的下降,但下降的具体原因有待进一步的验证。Fe参与光合电子传递,Cd胁迫导致蒌蒿Fe含量下降,缺Fe会影响光合电子传递。但Root等[41]认为,Cd胁迫引起Fe含量上升,且Fe/Zn值增加是Cd胁迫下玉米叶片黄化的主要原因。缺P会影响植物光合同化力和中间磷酸化合物的形成,缺K影响植物光合产物的运输,S是植物叶绿体的重要组成成分[42]。接种促生菌后蒌蒿体内Ca,Mg,Fe,S,P,K的含量显著增加,促生菌改善了Cd胁迫下蒌蒿对矿质元素的吸收,缓解了Cd胁迫对蒌蒿光合的抑制,这与促生菌对Cd胁迫下鹰嘴豆矿质元素吸收的影响相似[43]。促生菌之所以能促进Cd胁迫下蒌蒿对矿质元素的吸收,可能是因为①促生菌中的J2,Y5菌株能分泌IAA,促进蒌蒿根系对土壤中矿质元素的吸收;②促生菌中的T3菌株能产生铁载体且能分泌有机酸,促进蒌蒿对铁的吸收并降低土壤pH值,改善根际矿质元素的生物有效性。
4 结论
相比单一Cd胁迫,接种促生菌能缓解Cd胁迫对蒌蒿气孔和非气孔因子的限制,缓解高浓度Cd胁迫对蒌蒿光合色素的破坏,促进蒌蒿对土壤中光合矿质元素的吸收,减轻Cd胁迫对蒌蒿PSⅡ的伤害,提高蒌蒿对所吸收光能的转化和利用,保障其光合作用。

