鳗鱼肉粉中氨基甲苯咪唑基体标准物质的研制
罗春连
(福建省工业产品生产许可证审查技术中心,福建 福州 350003)
中国是全球最大鳗鱼养殖国,鳗鱼产量占全球总产量的80%以上[1]。鳗鱼在生长过程中易受寄生虫感染[2],这些寄生虫会影响鳗鱼的生理学和生活史许多特征,甚至导致种群崩溃[3]。甲苯咪唑(Mebendazole,MBZ)是一种苯并咪唑类广谱抗寄生虫的合成药物,通过对虫体肠细胞浆微管的摧毁进而阻断细胞对葡萄糖的转运和吸收[4],对钩虫[5]、蛔虫[6]、蛲虫[7]、鞭虫[8]、线虫[9]等多种寄生虫具有良好的驱除效果,是鳗鱼养殖中寄生虫感染的主要治疗药物[10-11]。但MBZ及其主要代谢产物羟基甲苯咪唑(Hydroxy-mebendazole,MBZ-OH)和氨基甲苯咪唑(Amino-mebendazole,MBZ-NH2)会在动物体内残留且具有生物毒性[12-15],因此MBZ是动物源性食品兽药残留的重要监控对象。目前国外多数国家规定水产品中MBZ的最大残留限量为0.1 mg/kg[16],日本肯定列表对其限量为0.02 mg/kg[17],美国和加拿大执行的最新规定为0.05 mg/kg。因为中国GB 31650—2019未规定该兽药在水产品中的最大残留限量,据美国食品药品管理局(FDA)消息,近年来因烤鳗中频繁检出MBZ-NH2,美国对中国多家出口企业相关产品实施自动扣留,导致中国鳗鱼出口损失较大。
目前,对MBZ的测定只使用纯品标准物质进行定量检测[11-12],难以有效避免样品基质效应对检测结果的干扰[18]。基体标准物质是一种新型标准物质,它将目标分析物与样品基质进行结合,具有实际样品特性以及足够均匀性和稳定性特征值,由于其目标化合物比基体更接近真实检测样品,能够有效降低检测过程中的基质效应,保障检测结果的准确性,被广泛用于实验室质量控制工作[19-20]。中国食品类基体标准物质的研究正值起步发展阶段,研制出的基体标准物质主要涉及谷物[21]、水产品[22]、乳制品[23]、茶叶[24]、畜禽肉[25]等,食品类标准物质覆盖面窄,与实际需求仍有巨大缺口[26],且国家标准物质资源共享平台中未发现鳗鱼肉中MBZ及其代谢物的基质标准物质。研究拟以鳗鱼肉组织对MBZ及其代谢产物MBZ-OH和MBZ-NH2的代谢规律为基础,通过真空冷冻干燥均匀化技术,制备鳗鱼肉粉中MBZ-NH2基体标准物质,以期为鳗鱼制品中MBZ-NH2的量值溯源、分析检测、质量控制、实验室能力验证、分析方法的准确性评估和验证等提供依据。
1 材料与方法
1.1 材料与试剂
鳗鱼(Anguillidae):长乐聚泉食品股份有限公司;
包装材料:采用双层平口袋包装,其中外包装袋材质为铝箔复合材料,内包装袋材质为聚乙烯;
MBZ、MBZ-OH、MBZ-NH2标准品:色谱纯,德国 Dr.Ehremstorfer公司;
乙腈、甲酸、冰乙酸:色谱纯,德国Merck公司;
超纯水:符合GB 6682—2008 Ⅲ级水标准,实验室自制。
1.2 仪器与设备
高效液相色谱—串联质谱仪:Xevo TQ-S型,配有电喷雾离子源,美国Waters公司;
高速冷冻离心机:Allegra V-15R型,美国Beckman Coulter公司;
电动肉丸机:YQ-6型,中国佛山俊凌厨具电器厂;
拍击均质器:stomacher350型,英国Seward公司;
电子分析天平:BSA124S型,德国Sartorius公司;
涡旋振荡器:VORTEX1型,德国IKA公司;
MCX固相萃取柱:60 mg/3 mL,美国Waters 公司。
1.3 方法
1.3.1 候选物的制备 取适量的兽药MBZ水剂,用水稀释后均匀泼洒入池,使鱼池中MBZ质量浓度约为1 mg/L,静置过夜;取70条重量约为250 g的鳗鱼,暂养在装有循环充气的水箱中,每天换1次水,用药3 d后停药,休药第9天捞出宰杀,去皮、去骨、去内脏,取肉部分,混合搅碎,混匀制成鳗鱼肉糜。
1.3.2 样品制备 将鳗鱼肉糜进行真空冷冻干燥制得冻干鳗鱼肉粉,水分含量<5%。冻干粉粉碎、过35目筛,得鳗鱼肉粉样品,用聚乙烯内袋及铝箔复合袋进行真空包装,最小包装总单元数约432袋,每袋8~10 g,贴标签并编号;辐照灭菌(60Co-γ,12 kGy);于-18 ℃保存。
1.3.3 样品均匀性与稳定性试验
(1) 均匀性检验:按JJF 1343—2012执行。
(2) 稳定性检验:按JJF 1343—2012执行。
1.3.4 定值及朔源性 采用邮政网络协同定值[27],选择8家具备MBZ及其代谢产物检测能力的资质检验机构作为协作定值实验室,分别用编号L001~L008表示,每个机构测定3个样品,每个样品独立重复测定2次。检测数据的定值与离散性检验、不确定度评估方法参照文献[28]。
1.3.5 MBZ及其代谢产物检测 准确称取1.250 0 g样品于离心管中,加入3.75 mL超纯水充分混匀使其复原为鱼糜,浸泡30 min,参照SN/T 2624—2010对MBZ及其代谢产物进行提取和净化,上机检测。色谱条件为:waters Acquity UPLC C18(1.6 μm, 3 mm×100 mm);流动相A为5 mmol/L乙酸铵溶液-0.2%甲酸溶液;流动相 B为100%乙腈溶液;梯度洗脱程序:0~1 min,10% B;1~2 min,10%~80% B;2.0~4.5 min,80% B;4.5~6.0 min,80%~10% B;流速0.3 mL/min;柱温35 ℃;进样量5 μL。质谱条件为:多反应监测(MRM)扫描模式;电喷雾离子源(ESI);正离子扫描;脱溶剂气温度650 ℃,流速800 L/h;毛细管电压3.0 kV。其他MRM质谱参数见表1。

表1 MBZ及其代谢物的主要质谱参数†
2 结果与分析
2.1 MBZ及其代谢物在鳗鱼肉中的代谢规律及标样的选择
由图1可知,鳗鱼肉中MBZ及其代谢物含量随休药时间的延长先降低后趋于稳定;鳗鱼肉组织对MBZ和MBZ-OH的降解能力强,自休药的第4天起已降至极低水平;而MBZ-NH2至休药的第8天才降至较低水平,且难以被鳗鱼肉组织完全降解,从而形成稳定的兽药残留,因此MBZ-NH2适合被制备为鳗鱼肉中的基体标准物质。为使鳗鱼肉中MBZ-NH2基体标准物质来源稳定且不受MBZ和MBZ-OH的干扰,确定休药后第9天为最佳取样点。

图1 鳗鱼肉组织中MBZ及其代谢物在休药后随时间的变化趋势
2.2 鳗鱼肉粉中MBZ-NH2基体标准物质的制备
基于MBZ-NH2的代谢规律,在休药后第9天进行样品采集和标品制备。为保证样品的均匀性,使用电动肉丸机将鳗鱼肉进行粉碎,再将粉碎后的鱼糜边搅拌边进行拍击均质。鳗鱼含油脂较多,直接以糜样的形式保存很容易析出油脂而影响目标化合物含量,研究采用真空冷冻干燥技术能够克服上述缺陷,冻干鱼糜粉末复水性好,且复溶后的鱼浆能极大程度地还原其基体特性。该冻干产品易于水分控制且方便贮藏和运输。对冻干后的样品进行粉碎,过35目筛,研制好的样品经双层真空包装后再进行辐照灭菌,所制备的MBZ-NH2基体标准物质能在1年内保持无菌状态,以满足长期稳定性的考察需求及实际贮藏应用需求。
2.3 鳗鱼肉粉中MBZ-NH2基体标准物质的复水条件优化
根据样品冻干前后的水分含量,确定复水质量比为1∶3,同时考察了不同称样量(0.50,1.00,1.25,1.50 g)、复水时间(10,20,30,40 min)对MBZ-NH2检测结果的影响。结果表明,1.25 g为最佳称样量,30 min为最佳复水时间,其分析结果的准确度和重现性最好。因此,确定该标准样品的最小取样量为1.25 g,复水比例为1∶3。
2.4 鳗鱼肉粉中MBZ-NH2基体标准物质的上机检验
取3份样本复水后按SN/T 2624—2010进行测定,发现只有MBZ-NH2的检出值大于其方法定量限,而MBZ和MBZ-OH均未检出。
由图2可知,基体标准物质的图谱与标品溶液的图谱高度相似,各离子对的峰形尖锐且无拖尾现象,目标峰附近无杂峰干扰,说明基体标准物质中MBZ-NH2的定性检验并不受鳗鱼肉粉中其他物质的干扰,进一步验证了取样点及复水条件的合理性。
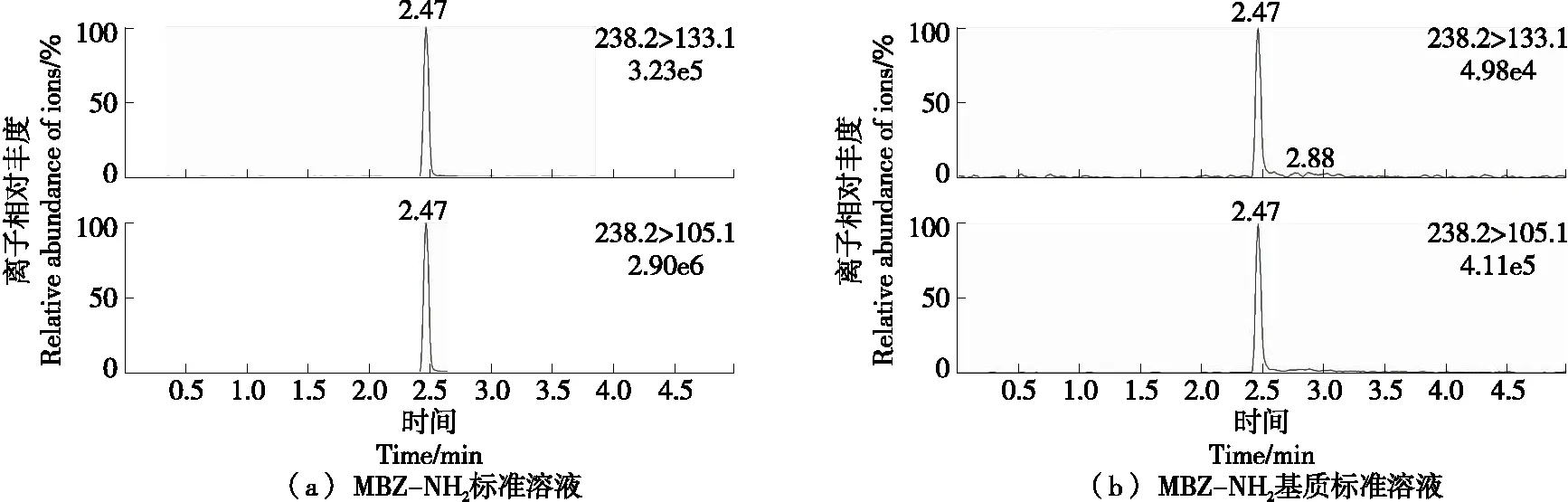
图2 标准溶液及基质样品的选择离子监测色谱图
2.5 鳗鱼肉粉中MBZ-NH2基体标准物质的基本属性
2.5.1 均匀性 随机抽取12份所制备的基体标准物质进行检测分析,鳗鱼肉粉中MBZ-NH2含量测定结果以及方差分析结果见表2。查表得F0.05(12,36)=2.216 3,鳗鱼肉粉中MBZ-NH2标准物质的F计算值为2.119 7,FMBZ-NH2 表2 鳗鱼肉粉中MBZ-NH2基体标准物质的均匀性方差分析† 2.5.2 稳定性 由表3可知,所有样品均未出现胀袋、霉变、形态、质构等方面的异常变化,说明2.2中样品的制备和包装方式符合短期贮藏需求;对MBZ-NH2进行含量检测,样品在暴晒环境中MBZ-NH2含量下降明显,F-检验表明:在α=0.05显著水平条件下,FMBZ-NH2=1.300 7 表3 鳗鱼肉粉中MBZ-NH2基体标准物质的短期稳定性检测结果† 长期稳定性检验参照GB 15000.3—2008,即-18 ℃低温贮藏1年,并在多个时间点跟踪监测MBZ-NH2的含量变化情况,测定结果见表4。由表4可知,在95%置信区间内,F=0.148 8>0.05,不显著,说明贮藏时间不影响MBZ-NH2的含量变化,因此认为该基体标准物质能够在12个月保持稳定。 2.5.3 定值与离群值检验 将同批次未拆封的样品送至8家资质检验机构(8组)进行MBZ-NH2含量检测,结果见表5。由表5可知,8组数据未发现异常值,说明8家资质检验机构的检测结果数据稳定;以夏皮洛—威尔克(Shapiro-wilk)检验法对8组数据的均值进行正态分布检验,计算得W=0.970>W(48,0.95)=0.947,说明检测数据服从正态分布;继续采用科克伦法检验8组数据的平均值是否等精度,计算得出C=0.330,满足C 表4 鳗鱼肉粉中MBZ-NH2基体标准物质的长期稳定性检测结果 2.5.4 不确定度评估 不确定度表征被测量值的分散性,其值大小与测定结果可信赖程度相关联[29-30],根据标准物质统计方法指南规定,评估合作定制方法得到定值结果的不确定度,通过测定值标准不确定度、瓶间标准不确定度、长期稳定性不确定度的合成并扩展来评定,最终确定MBZ-NH2特性值为(35.3±6.4) μg/kg (k=2)。 表5 协同定值 对甲苯咪唑休药第9天时制得的含氨基甲苯咪唑鳗鱼肉糜,采用联合冷冻干燥、真空包装和辐射灭菌技术,研制得鳗鱼肉粉中氨基甲苯咪唑自然基体标准物质。结果表明,复水后该基体标准物质上机检测效果良好,能够满足鳗鱼中氨基甲苯咪唑质量控制和方法验证需求,可保证测定结果的可靠性、可比性和溯源性。根据鳗鱼肌肉组织对甲苯咪唑的代谢特征,未来在甲苯咪唑喂药过程中使用其代谢抑制剂以及单独喂药羟基甲苯咪唑有望分别获得甲苯咪唑和羟基甲苯咪唑标准物质。



3 结论

