SNHG7-miR-653-5p-STAT2反馈通路在神经母细胞瘤进展中的调节作用研究
杨槟伊 刘小梅 陈鑫 陈伟明 范煦 李富江 鹿洪亭
1 青岛大学附属医院小儿外科,青岛 266000; 2 青岛大学,青岛 266071; 3 胜利油田中心医院儿科,东营 257034; 4 青岛大学附属妇女儿童医院小儿外科,青岛 266011
神经母细胞瘤(neuroblastoma,NB)是交感神经系统的胚胎性颅外实体瘤,是儿童交感神经系统最常见的恶性肿瘤[1-2]。NB的平均诊断年龄约17个月,临床表现多样,预后个体差异较大[3-5]。NB因病死率高、预后差而被视为一种高风险的儿童恶性肿瘤[3,6-7]。目前大量研究表明,长链非编码RNA (long noncoding RNAs,lncRNA)在肿瘤进展中起着关键作用[8]。LncRNA一般超过200个核苷酸,缺乏蛋白质编码能力[9]。此外,lncRNA能够调节与肿瘤异常增殖、凋亡、迁移、侵袭和转移相关基因的表达[9-10]。lncRNA SNHG7全长2176 bp,位于染色体9q34.3上。SNHG7具有促进多种肿瘤细胞增殖和抑制细胞凋亡的作用。例如,lncRNA SNHG7与miR-34a相互作用,通过PI3K/Akt/mTOR通路上调结直肠癌中GALNT7的表达水平[11]。LncRNA SNHG7通过上调FAIM2蛋白的表达水平,促进细胞增殖,抑制癌细胞凋亡[12]。虽然SNHG7被认为是多种癌症的重要调控因子,但其在神经母细胞瘤进展中的作用及机制尚未明确。
miRNA长度通常为20~22个核苷酸,缺乏蛋白编码潜能,通过结合靶mRNA上的互补序列,在转录后下调基因表达[13]。越来越多的研究表明,lncRNA可以通过miRNA的海绵作用调控多种癌症中mRNA的表达[14-15]。例如,lncRNA FTH1P3可通过miR-206/ABCB1激活乳腺癌患儿的紫杉醇耐药[16]。有报道SNHG7在多种癌症中作为miRNA发挥海绵样作用[17]。例如,SNHG7通过分泌miR-503经cyclin D1促进前列腺癌的增殖和周期进展[18]。MiR-653-5p是以前从未被研究过的miRNA之一,miR-653-5p是否参与NB的进展仍有待阐明。本研究旨在探索SNHG7在神经母细胞瘤进展中的作用,并进一步探讨SNHG7中的分子机制对NB的潜在影响。
材料与方法
一、研究对象
从青岛大学附属医院收治的NB患儿体内获得92对NB组织及相邻非肿瘤组织。样品获取后即置于-80℃低温冰箱保存。所有患儿未接受术前治疗,患儿家属签署书面知情同意书,本研究获得青岛大学附属妇女儿童医院伦理委员会批准(QYFYWZLL25816)。
二、研究方法
1.细胞培养和转染:人神经母细胞瘤细胞系[SK-N-AS,SK-N-SH,SH-SY5Y,IMR-32,SK-N-BE(2)-C]购于美国ATCC公司。细胞的培养液(dulbecco’s modified eagle medium,DMEM)及100 U/mL青霉素和100 mg/mL链霉素购于美国默赛飞世尔公司,10%的灭活胎牛血清(fetal bovine serum,FBS)购于美国Hyclone公司,然后置于含有5%CO2,37℃的细胞培养箱中培养。以SNHG7为靶点的shRNA和相应的对照组shRNA (sh-NC)由上海吉玛基因制药技术有限公司提供。合成STAT2序列,亚克隆到pcDNA3.1载体(pcDNA/STAT2)购于英杰公司。从上海吉玛公司获得miR-653-5p模拟物和miR-653-5p抑制。SK-N-SH细胞和SH-SY5Y细胞与质粒使用lipofectamine 2000进行转染。转染24 h后,收集细胞并保存,以备后续研究。
2. RNA提取和实时荧光定量PCR:采用Trizol试剂(美国默赛飞世尔公司)从患儿组织和NB细胞中提取RNA。采用分光光度法测定RNA样品的浓度和纯度。纯化后的RNA经相应逆转录试剂盒(购自德国德商宝公司)逆转录成cDNA。基因的相对表达水平用反转录试剂盒(中国大连的宝生物公司)进行验证。用U6作为内参,每组实验重复3次。
3. 比色法实验:将SK-N-SH和SH-SY5Y两种细胞(2×105)分别在96孔板中培养24 h、48 h、72 h、96 h。 向每个孔中加入3-(4,5-二甲基-2-噻唑基)-2、5-二苯基-2-H-四唑溴化物(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT,0.5 mg/mL)溶液。 将细胞依次孵育4 h,除去剩余的MTT溶液,再向每个孔中加入二甲基亚砜(Dimethyl sulfoxide,DMSO)以溶解晶体。 此后,使用ELX-800光谱仪读数器(美国宝特仪器有限公司)测量490 nm处的吸光度。 每组实验重复3次。
4. 集落形成实验:转染后,将SK-N-SH和SH-SY5Y两种细胞(1×103细胞/孔)接种到12孔板中。 培养基每3天更换1次。 2周后,用PBS轻轻洗涤细胞,甲醇固定10 min后用0.1%结晶紫染色5 min,最后手动计数含有超过50个细胞的集落。每组实验重复3次。
5. 细胞的侵袭和迁移实验:利用Transwell小室实验(美国的康宁公司)检测上述两种细胞,SK-N-SH和SH-SY5Y两种细胞(2×104)置于有200 μL新鲜DMEM培养基的上室中,将含有10%FBS的800 μL培养基加入下室。 孵育24 h后,用4%多聚甲醛固定细胞20 min,并用0.1%结晶紫染色5 min。 然后通过光学显微镜(日本奥林巴斯公司,型号BX51)放大200倍对膜底部侵入或迁移的细胞进行计数。每组实验重复3次。
6. 荧光素酶报告实验:将含有预测的miR-653-5p结合位点和SNHG7的全长序列的STAT2的3’-UTR序列克隆到psiCHECK-2载体(普洛麦格公司,美国)上来产生野生型STAT2报告基因(STAT2-Wt)和野生型SNHG7报告基因(SNHG7-Wt)。 突变型STAT2报告基因(STAT2-Mut)和突变型SNHG7报告基因(SNHG7-Mut)由定点突变试剂盒(购于默赛飞世尔公司)产生。 用HEK-293T细胞与miRNA(miR-NC,miR-653-5p模拟物)以及miRNA抑制物(miR-NC,miR-653-5p抑制物)一起转染这些构建的分子报告基因。 在转染48 h后,用双荧光素酶报告系统(普洛麦格系统,美国)测量荧光素酶活性。每组试验重复3次。
7. RIP测定法(RNA结合蛋白免疫沉淀法):运用蛋白质免疫沉淀试剂盒对SK-N-SH和SH-SY5Y细胞进行处理。将细胞裂解物(SK-N-SH和SH-SY5Y)在含有磁珠的RIP缓冲液中孵育,所述磁珠与人抗-Ago2抗体结合,正常IgG和Input分别充当对照组。用蛋白酶K分离免疫沉淀的RNA。最后,提取纯化的RNA,通过实时PCR测量。每组实验重复3次。
(3)加强风险规范管理。强化数据分析应用,推进财产行为税风险管理,加强信息比对,完善各税种风险特征库、管理模型和指标体系,建立财产行为税风险管理机制,不断提高风险管理的规范化水平。
8.RNA下拉测定法:Bio-SNHG7-WT,Bio-SNHG7-Mut和Bio-NC由中国上海吉玛公司生物素化所得。 将生物素标记的RNA转染到SK-N-SH和SH-SY5Y细胞中。 转染48 h后,收集细胞并裂解。 将细胞裂解物与含有抗-Ago2或抗-IgG的珠子一起孵育10 min。 通过qRT-PCR分析纯化的RNA复合物。每组实验重复3次。
三、统计学处理
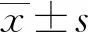
结 果
一、SNHG7在NB组织和细胞中表达明显上调
为了探讨SNHG7在NB进展中的作用,首先用qRT-PCR检测92对NB组织中SNHG7的表达。如图1A所示,与相应的非肿瘤组织相比,SNHG7在肿瘤组织中的表达明显上调。检测NB细胞[SK-N-SH,SH-SY5Y,IMR-32,SK-N-AS,SK-N-BE(2)-C]中SNHG7的表达水平发现,SNHG7在SK-N-SH和SH-SY5Y细胞中高表达(图1B),提示SNHG7可能参与NB的发生发展。
二、SNHG7表达与NB临床预后的关系
为了进一步确定SNHG7对NB的影响,分析临床病理特征与NB患儿SNHG7表达水平之间的关系,根据实时PCR分析得到SNHG7的平均表达水平,将所有患儿分为高表达组和低表达组。如表1所示,SNHG7的高表达与淋巴结转移(χ2=4.843,P=0.035)、INSS分期(χ2=5.101,P=0.034)、视神经侵犯(χ2=10.163,P=0.003)有关,但SNHG7的表达与年龄、性别、分化程度无关(P>0.05)。Kaplan-Meier分析发现,SNHG7高表达的患儿预后较差(图1C)。此外,SNHG7的表达(P=0.042)可以作为NB患儿预后的独立预测因子(表2),NB患儿SNHG7的表达水平可能与预后有关。

图1 SNHG7在NB组织和细胞中表达上调相关结果图 注 A:与配对的非肿瘤组织相比,92例NB组织中SNHG7表达上调; B:SNHG7在5株NB细胞中的表达情况; C:Kaplan-Meier分析低(n=39)和高(n=53) SNHG7表达的NB患儿总生存期(*代表P<0.05,**代表P<0.01)

表1 SNHG7表达等级与临床特征的关联性(n=92)Table 1 Correlation between SNHG7 expression and clinical features (n=92)变量分类SNHG7表达等级低高χ2值P值年龄(岁)<2.5≥2.5241535180.1980.667性别(例)男女261333200.1890.826淋巴结转移是否162334194.8430.035INSS分期(例)1~2A2B~4S241520335.1010.034分化程度好差112813400.1580.811视神经侵犯否是2415153810.1630.003
为了探讨SNHG7在NB进展中的作用,使用特异性shRNA来沉默具有SNHG7高表达的两个NB细胞系SK-N-SH和SH-SY5Y。 如图2A所示,在SK-N-SH和SH-SY5Y细胞中,shSNHG7有效降低了SNHG7的表达。 MTT测定显示SNHG7的下调明显抑制了SK-N-SH和SH-SY5Y细胞的活力(图2B)。 此外,SNHG7下调显著减少了SK-N-SH和SH-SY5Y细胞中的集落数(图2C)。

图2 SNHG7在体外抑制NB细胞增殖、体内抑制肿瘤生长的相关结果图 注 A:采用qRT-PCR检测转染shCtrl或shSNHG7后SK-N-SH和SH-SY5Y细胞中SNHG7的相对表达水平; B:通过MTT法检测SNHG7下调对SK-N-SH和SH-SY5Y细胞存活和增殖的作用; C:菌落形成法检测答案显示SNHG7下调对SK-N-SH和SH-SY5Y细胞存活和增殖有明显抑制作用

表2 NB患儿预后相关因素的Cox回归分析结果Table 2 Multivariate analysis of prognostic parameters in NB children by Cox regression 变量分类P值年龄(岁)<2.5≥2.50.360性别男女0.765淋巴结转移是否0.031分期1~2A2B~4S0.041分化程度好中/差0.881视神经侵犯否是0.076SNHG7表达等级高低0.042
四、SNHG7的下调抑制NB细胞的迁移、侵袭
为了进一步研究SNHG7对NB转移的影响,应用Transwell测定法验证SK-N-SH和SH-SY5Y细胞的细胞迁移和侵袭能力。 从图3A和图3B可以看出,SNHG7的下调明显抑制了SK-N-SH和SH-SY5Y细胞迁移和侵袭的能力,这表明沉默SNHG7可抑制NB细胞转移。
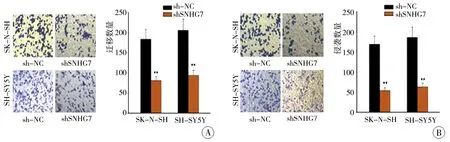
图3 SNHG7基因敲除抑制NB细胞迁移、侵袭能力的相关结果图 注 A和B:Transwell试验结果表明,敲低SNHG7可明显抑制SK-N-SH和SH-SY5Y细胞的细胞迁移和侵袭能力 (**代表P<0.01)
五、SNHG7在NB细胞中与miR-653-5p的相互作用及相关性
最近,越来越多的证据表明,lncRNA含有与miRNA互补的序列,并且对miRNA的表达和活性具有抑制作用[18-19]。我们通过生物信息学分析发现,SNHG7 RNA含有一个保守元件,可能是miR-653-5p的靶位点。为了确保这种可能性,本研究分别用SNHG7的野生型序列(SNHG7-WT)和突变型序列(SNHG7-Mut)构建了两个pMIR荧光素酶报告基因(图4A)。 如图4B所示,miR-653-5p模拟物仅能降低SNHG7-WT的荧光素酶活性,但不能降低SNHG7-Mut的荧光素酶活性,而对miR-NC则没有影响。 此外,RIP测定结果显示,与对照IgG免疫沉淀物相比,SNHG7和miR-653-5p均含来自SK-N-SH和SH-SY5Y提取物的Ago2沉淀(图4C)。 另外,miR-653-5p与SNHG7之间存在一定的相互作用并受其影响,其促进作用可被SNHG7抑制(图4D)。
为了进一步证实SNHG7与miR-653-5p的相关性,本研究分析了它们在NB组织中的表达情况。 qRT-PCR结果显示,与非肿瘤组织相比,miR-653-5p在NB组织中表达下调(图4E)。Spearman相关分析显示,miR-653-5p表达与SNHG7的表达呈负相关(r=-0.281,P=0.007),详见图4F。

图4 SNHG7在NB细胞中与miR-653-5p结合的相关结果图 注 A:miR-653-5p与SNHG7序列的预测结合位点; B:荧光素酶报告基因测定用于检测转染HEK-293T细胞的荧光素酶活性; C:RIP法检测珠子中SNHG7和miR-653-5p的qRT-PCR结果; D:采用qRT-PCR检测SK-N-SH和SH-SY5Y细胞中RNA下拉法拉低复合物中miR-653-5p的相对表达情况; E:NB组织中miR-653-5p表达的qRT-PCR结果; F:Spearman相关显示NB组织中SNHG7与miR-653-5p呈负相关(**代表P<0.01)
六、STAT2是受SNHG7和SNHG7/miR-653-5p 轴调控的靶基因
使用StarBase 2.0发现,STAT2是miR-653-5p的一个假定靶点(图5A) 。荧光素酶报告基因检测显示,miR-653-5p模拟物可降低STAT2-WT的荧光素酶活性,而其他组的荧光素酶活性变化不大,说明miR-653-5p与STAT2-WT存在特异性的相互作用(图5B)。Spearman相关分析表明,STAT2表达与miR-653-5p水平呈负相关(r=-0.295,P=0.004),而与NB组织中的SNHG7表达呈正相关(r=0.296,P=0.004),见图5C和5D 。这些数据说明SNHG7通过调节miR-653-5P/STAT2途径在NB进展中发挥作用。

图5 STAT2是SNHG7调控miR-653-5p的靶点,以及SNHG7/miR-653-5p/STAT2轴在NB进展中的作用 注 A:miR-653-5p与STAT2序列的预测结合位点; B:采用HEK-293T细胞荧光素酶报告基因检测miR-653-5p与STAT2的结合; C、D:Spearman相关分析揭示了STAT2的表达与NB组织中miR-653-5p或SNHG7水平存在相关性
讨 论
越来越多的证据表明,lncRNA在多种恶性肿瘤(包括神经母细胞瘤)的进展中起着至关重要的作用。 例如,新型长非编码RNA的linc-NeD125携带miR-125b-1,并负向控制人神经母细胞瘤细胞的增殖[20]。CASC15在神经母细胞瘤中起肿瘤抑制剂的作用[21]。SNHG7是一种lncRNA,已被鉴定为几种癌症的致癌基因[12,18,22]。然而,其在神经母细胞瘤发展中的作用和调节机制尚不清楚。 本研究发现NB组织和细胞系中,SNHG7的表达水平显著升高,而SNHG7的表达具有重要的临床意义,可以预测NB患儿的预后。 随后,细胞功能实验验证SNHG7的下调会抑制NB细胞增殖,并抑制细胞迁移、侵袭。
越来越多的证据表明,与miRNA序列互补的lncRNA能够抑制miRNA的表达和活性[19,23]。例如,长链非编码RNA GAPLINC作为miR-378分子的靶基因可通过海绵作用调控MAPK1表达,促进胃癌细胞增殖[24]。LncRNA CCAT1通过下调miR-143在FTC-133甲状腺癌细胞株中的表达,促进细胞增殖、迁移和侵袭[25]。本研究通过生物信息学分析发现,miR-653-5p与SNHG7和STAT2含有预测的结合位点,提示SNHG7通过类似机制调控神经母细胞瘤进展。本研究证实了miR-653-5p与SNHG7或STAT2的相互作用。此外,STAT2表达与miR-653-5p水平呈负相关,但与NB组织中SNHG7水平呈正相关。
信号转导子和转录激活子(signal transduction and activator of transcription, STATs)是JAKs-STATs信号通路中常见的转录因子。经常参与多种细胞因子信号通路的调控[26]。STAT2是著名的STAT家族蛋白之一,在调控靶基因转录方面发挥重要作用[27]。诸多文献报道STAT2参与了某些癌症的发生[28-29]。例如,与宫颈炎和发育不良组织相比,宫颈癌组织中STAT2上调[28]。与这些研究一致,本研究发现NB组织中STAT2水平较非肿瘤组织显著上调,说明STAT2与NB肿瘤进展有关。此外,STAT2过表达和miR-653-5p抑制shSNHG7诱导的细胞增殖、迁移和侵袭的恢复表明,SNHG7通过调控miR-653-5p/STAT2通路参与NB的进展。
综上所述,本研究初步阐明了SNHG7-miR-653-5p-STAT2信号通路在调节NB进展中的作用,为进一步探索新的NB治疗靶点和预后生物标志物提供了依据,后续会通过蛋白印迹及免疫组化等试验进一步验证此实验的准确性,未来还需要更多的NB动物实验以及临床实验来证实本研究结果。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明文献检索为杨槟伊、陈伟明,论文调查设计为杨槟伊、刘小梅、陈鑫,数据收集与分析为杨槟伊、范煦、陈伟明、李富江、陈鑫、刘小梅,论文结果撰写为杨槟伊、陈伟明、范煦、鹿洪亭,论文讨论分析为杨槟伊,刘小梅,鹿洪亭

