神经生长因子联合多奈哌齐对帕金森病患者认知功能、运动能力及炎症反应的影响
杨远芳,滕跃华
(辽阳市中心医院神经内四科,辽宁 辽阳 111000)
帕金森病(Parkinson’s disease,PD)与环境、遗传、神经系统老化、免疫异常等因素相关,是老年人群中常见的神经系统退行性疾病,常表现为肌强直、静止性震颤、运动迟缓等,极大降低了患者的生命质量[1]。PD尚无法治愈,临床常首选药物治疗以控制病情进展、促进其日常活动能力的恢复。多奈哌齐是可逆性中枢乙酰胆碱酯酶(acetylcholinesterase,AChE)抑制剂,可通过抑制中枢AChE活性来减慢乙酰胆碱(acetylcholine,ACh)的分解,提高ACh水平从而改善患者认知功能[2],但长期使用存在加重患者运动症状的不良影响,总体疗效有限[3]。神经生长因子(nerve growth factor,NGF)具有促进神经元生长和损伤修复、维持神经系统正常功能等作用,具有从保护神经元方面治疗PD的潜能[4]。PD患者的多巴胺能神经元受损可能与小胶质细胞过度激活而释放的大量炎症因子有关,改善炎症状态有望于提高疗效[5]。本研究探究神经生长因子联合多奈哌齐对PD患者认知功能、运动能力及炎症状态的影响。
1 资料与方法
1.1 一般资料
选取2019年6月至2020年12月辽阳市中心医院收治的106例PD患者为研究对象,按治疗方式不同分为对照组和观察组,每组各53例。纳入标准:(1)确诊为原发性PD;(2)Hoehn-Yahr(H-Y)分期为Ⅰ~Ⅲ期;(3)年龄55~85岁;(4)病程>6个月;(5)有基本语言沟通和理解能力;(6)知情同意参与研究,且治疗配合度高。排除标准:(1)对本研究药物过敏或存在药物配伍禁忌者;(2)有精神疾病、智力障碍、癫痫史者;(3)合并严重心脑血管疾病、肝肾功能不全、恶性肿瘤者;(4)因其他原因导致的运动障碍者;(5)正在接受PD相关治疗,且病情已有改善者;(6)有长期精神类药物治疗史者。两组患者一般资料比较,差异均无统计学意义(P>0.05)。见表1。本研究通过医院医学伦理委员会审批。
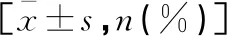
表1 两组一般资料比较
1.2 治疗方法
对照组予以盐酸多奈哌齐片(陕西方舟制药有限公司)治疗,5 mg/次,1次/d,睡前口服。观察组在对照组的基础上增加神经生长因子(丽珠集团丽珠制药厂)治疗,30 g/次,用2 mL氯化钠注射液溶解后肌肉注射,1次/d。两组其他辅助治疗方法无差别,均连续治疗3个月。
1.3 观察指标
(1)认知功能:使用蒙特利尔认知评估量表(montreal cognitive assessment,MoCA)[6]评估认知功能。MoCA包括交替连线测验、视结构技能、命名、记忆等10个项目,总分0~30分,评分越高提示患者认知功能越好。(2)非运动症状:使用非运动症状筛查问卷(non motor symptoms questionnaire,NMSQ)[7]评估非运动症状。NMSQ共30个条目,每条目按是/否记为1分/0分,总分0~30分,评分越高提示患者非运动症状越严重。(3)运动能力:分别使用简易上肢机能检查(simple test for evaluating hand function,STEF)[8]、Berg平衡量表(Berg blance scale,BBS)[9]、计时起立行走测试(time up and go test,TUGT)[10]评估上肢功能、平衡能力、行走能力。STEF共10个项目,每项按所需时间记1~10分,总分0~100分,评分越好提示患者上肢功能越高;BBS共14个条目,每条目0~4分,总分0~56分,评分越高提示患者平衡能力越好;患者在TUGT时可自选速度,完成3 m折返行走,记录用时,测量两次取平均值,用时越少提示患者步行能力越好。(4)炎症因子:使用酶联免疫吸附法(ELISA)检测空腹外周静脉血中血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、IL-1β水平,试剂盒均购自上海酶联生物科技有限公司。
1.4 疗效评价
使用改良Webster症状评分量表[11]评估对所有患者治疗前后的临床症状,进行症状积分。改良Webster症状评分包括上肢运动障碍、及强制、姿势、步态等10个条目,每条目依严重程度记0~3分,总分0~30分,积分越高提示患者症状越严重。参考症状积分对疗效进行3级评价。显效:疗效指数(effect index,EI)≥60%;有效:EI为30%~59%;无效:EI<30%。EI=(症状积分治疗前-症状积分治疗后)/症状积分治疗前×100%。临床总有效率=(显效例数+有效例数)/总例数×100%。
1.5 统计学分析
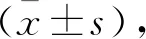
2 结果
2.1 两组临床疗效比较
观察组临床总有效率高于对照组(88.68%vs.73.58%,P<0.05)。见表2。
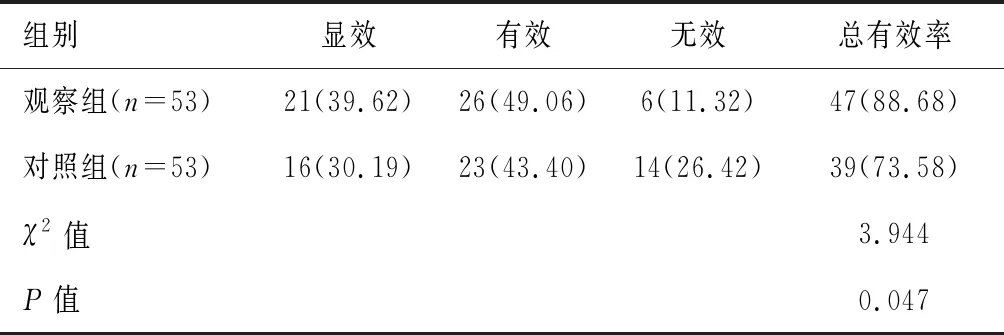
表2 两组临床疗效比较[n(%)]
2.2 两组认知功能及非运动症状比较
治疗前,两组MoCA及NMSQ评分比较,差异均无统计学意义(P>0.05)。治疗后,两组MoCA评分均较治疗前上升(P>0.05),NMSQ评分则较治疗前下降(P<0.05);且与对照组相比,观察组MoCA评分更高,NMSQ评分更低(P<0.05)。见表3。
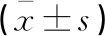
表3 两组MoCA及NMSQ评分比较
2.3 两组运动能力比较
治疗前,两组STEF、BBS评分及TUGT结果比较,差异均无统计学意义(P>0.05)。治疗后,两组STEF、BBS评分均较治疗前提高(P>0.05),TUGT用时则较治疗前缩短(P<0.05);且与对照组相比,观察组STEF、BBS评分均更高,TUGT用时更短(P<0.05)。见表4。
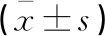
表4 两组STEF、BBS评分及TUGT结果比较
2.4 两组炎症因子表达水平比较
治疗前,两组血清炎症因子水平比较,差异均无统计学意义(P>0.05)。治疗后,两组血清TNF-α、IL-6、IL-1β水平均较治疗前降低(P<0.05);且观察组血清TNF-α、IL-6、IL-1β水平均低于对照组(P<0.05)。见表5。
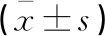
表5 两组血清炎症因子水平比较
3 讨论
PD以中脑黑质多巴胺能神经元坏死、纹状体中多巴胺水平过低、ACh亢进等为主要病理改变[12]。多奈哌齐可竞争性、选择性的抑制中枢系统的AChE活性,减少脑内的ACh的分解,有效提高脑顶叶、颞叶、皮质、海马体等中的ACh浓度,发挥改善神经传导功能的作用;另外,多哌奈齐还被证实对PD小鼠的CA1区钙蛋白酶Ⅰ(calpainⅠ)的表达有抑制作用,而CalpainⅠ参与了MPP+诱导的多巴胺能神经元损害,抑制其表达可在增加ACh浓度同时发挥一定的神经元保护作用,从而改善机体学习能力、记忆、认知功能[13-14]。神经生长因子是一种活性生物蛋白,可通过调节胆碱能神经元活性、减少毒性氨基酸释放、缓解钙离子超载、抑制细胞凋亡等多种机制促进神经系统的损伤修复,保护并营养神经[15]。本研究表明,神经生长因子联合多奈哌齐可显著增强治疗PD的临床疗效,改善患者运动和非运动临床症状。
认知功能的恢复以重组中枢神经系统功能、开放潜伏的神经通路、促进神经轴突再生和海马区记忆的形成等[16]。NGF可以提高神经递质活性,促进并维持神经元分化、成熟、存活,补充外源性NGF具有提高脑损伤耐受性、加速局部受损神经修复的作用[17]。重建受损神经功能、修复海马区神经元、建立神经通路可能是神经生长因子改善PD患者的认知功能的原因之一。本研究显示,观察组治疗后MoCA及NMSQ评分均较对照组改善程度更大,表明神经生长因子联合多哌奈齐可明显提高PD患者认知功能,这与NGF对中枢神经系统的修复作用密不可分[18]。
运动能力下降也是PD患者的主诉症状之一,与静止性震颤、运动迟缓、平衡障碍等运动症状有关。机体预期性姿势调节(anticipatory postural adjustments,APAs)、随意运动的控制等均依赖于中枢神经系统的调控,可涉及大脑皮质、基底节、丘脑、小脑等结构,由各神经组织、神经环路共同参与目标肌群的协调运动[19-20]。本研究发现,观察组治疗后STEF、BBS评分高于对照组,TUGT用时则更短,表明神经生长因子联合多奈哌齐可明显增强PD患者的运动能力,可能得益于神经生长因子对神经损伤良好的修复作用[21]。β样淀粉蛋白(amyloid-β,Aβ)沉积与多巴胺能神经元的形成具有明显剂量依赖性关系,提示Aβ可能参与了PD的发生发展[22]。Bekris等[23]研究发现,Aβ的神经毒性可促进相关炎症因子大量释放,改变微循环,破坏血脑屏障,导致神经元变性坏死,故也可认为PD是一种神经炎性疾病。既往研究[24-25]也证实,炎症状态与PD进展密切相关,PD患者血清炎症因子水平如IL-6、TNF-α等均高于健康人群。NGF则被发现可与兴奋性氨基酸的毒性相拮抗,具有缓解局部神经炎症的作用[26]。苏鸿年等[27]发现,神经生长因子可能通过抗氧化应激作用来抑制神经炎症。研究[28]也显示,NGF对脑组织中Aβ表达的具有抑制作用,可降低炎症因子IL-1β、TNF-α等的表达,改善炎症状态[28]。本研究中,观察组治疗后血清TNF-α、IL-6、IL-1β水平均低于对照组,表明神经生长因子联合多奈哌齐可有效抑制PD患者的炎症反应,从而有利于临床症状的改善。
综上所述,在使用多奈哌齐治疗PD的基础上增加神经生长因子,可有效提高患者认知功能和运动能力,缓解非运动症状,临床疗效良好,改善机体炎症状态可能是其机制之一。

