Hsp90α联合TPA、CRP检测在恶性肿瘤临床诊断中的意义
杜琴,王强,蔡艳娟,杜娟,张茂鑫,郭晓兰
(川北医学院,1.附属医院检验科;2.医学检验系;3.转化医学研究中心,四川 南充 637000)
恶性肿瘤是严重威胁人类健康的公共卫生问题之一,最新癌症报告显示,我国平均每分钟有8.2个人被确诊,且发病率和死亡率呈持续上升态势。肺癌和消化道肿瘤是我国主要的恶性肿瘤,临床上确诊主要依靠穿刺活检或胃肠镜等侵入性操作[1],患者体感较差。随着技术的发展,肿瘤标志物在临床应用愈发广泛,组织多肽抗原(tissue polypeptide antigen,TPA)作为一种广谱肿瘤筛查标志物[2],在恶性肿瘤患者血清中具有较高检出率。有研究[3-4]发现,恶性肿瘤在病理生理上与炎症组织相似,炎症组织损伤可能引起肿瘤的发生。因此,近年C反应蛋白(CRP)在诊断恶性肿瘤方面也逐渐受到重视。热休克蛋白90α(heat shock protein 90α,Hsp90α)是一类具有分子伴侣特性的蛋白,在肿瘤细胞增殖过程中通过保护客户蛋白参与肿瘤的多种行为,且能够帮助肿瘤生长、侵袭和转移[5]。本研究旨在探讨Hsp90α联合TPA、C反应蛋白CRP检测在恶性肿瘤临床诊断中的意义。
1 资料与方法
1.1 一般资料
选取2019年2月至2019年6月川北医学院附属医院收治74例术后病理明确诊断的恶性肿瘤患者为肿瘤组,另选48例同期肺部及消化道炎症病变患者为炎症组,49名健康体检者为非炎症组。肿瘤组中,男性52例,女性22例;年龄44~81岁,平均(62.42±9.45)岁;肺癌28例,食管癌22例,消化道肿瘤19例,其他肿瘤5例。炎症组中,男性32例,女性16例;年龄36~83岁,平均(66.42±13.92)岁。非炎症组中,男性32名,女性17名;年龄39~85岁,平均(62.00±12.43)岁。三组对象年龄、性别比较,差异无统计学意义(P>0.05)。 纳入标准:(1)经术后病理明确诊断为恶性肿瘤者;(2)初次确诊,既往未行手术、放化疗及靶向治疗者。排除标准:(1)存在意识及表达障碍者;(2)中途退出研究者。
1.2 方法
1.2.1 Hsp90α、TPA及CRP检测 采集清晨空腹血4 mL,3 500 rpm离心5 min,采用酶联免疫吸附法测定血浆中Hsp90α浓度(烟台普罗吉生物科技发展有限公司,批号:201809002);化学发光法测定血清中TPA浓度(意大利索灵公司,批号:17845A);用速率散射比浊法测定血清中CRP浓度(贝克曼库尔特公司,批号: M909057)。
1.2.2 阳性判断标准 Hsp90α正常参考范围0~82.06 ng/mL,Hsp90α>82.06 ng/mL为阳性;TPA 正常参考范围0~75 ng/mL ,TPA >75 ng/mL为阳性;CRP正常参考范围0~5 mg/mL,CRP>5 mg/mL为阳性[6]。
1.3 观察指标
(1)Hsp90α、TPA和CRP水平;(2)Hsp90α、TPA和CRP单一检测和联合检测对恶性肿瘤的诊断效能。
1.4 统计学分析
采用SPSS19.0软件对数据进行分析与处理。计量资料以[M(Q1,Q3)]表示,采用t检验;诊断效能采用ROC曲线分析,曲线下面积(AUC)曲线下面积(AUC)>0.75,提示诊断价值较高。P<0.05为差异有统计学意义。
2 结果
2.1 三组对象Hsp90α、TPA和CRP水平比较
肿瘤组Hsp90α水平均明显高于非炎症组,差异有统计学意义(P<0.05)。见表1。
2.2 Hsp90α、TPA和CRP对炎症性疾病的诊断效能
ROC曲线分析显示, Hsp90α、TPA和CRP的AUC分别为0.608、0.617和0.924,CRP对炎症性疾病的诊断效能最大。见图1。
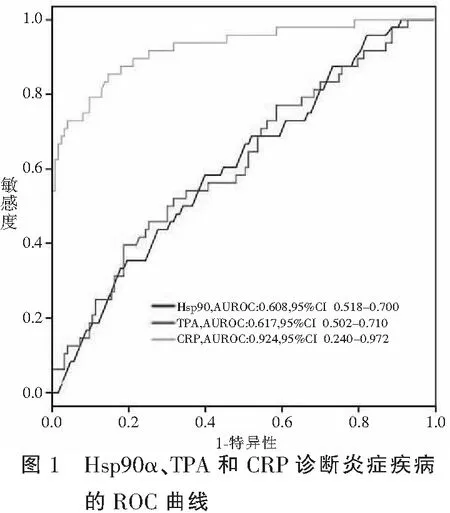
2.3 Hsp90α、TPA和CRP对非炎症性疾病的诊断效能
ROC曲线分析显示, Hsp90α、TPA和CRP的AUC分别为0.707、0.711和0.560,均小于0.75,表明健康人群外周血Hsp90α、TPA和CRP浓度不高。见图2。

2.4 Hsp90α、TPA和CRP对恶性肿瘤的诊断效能
ROC曲线分析显示, Hsp90α、TPA和CRP的AUC分别为0.593、0.587和0.321,Hsp90α对恶性肿瘤的诊断效能相对较好,但灵敏度和特异性不高,分别仅为62.2%和58.8%。见图3和表2。
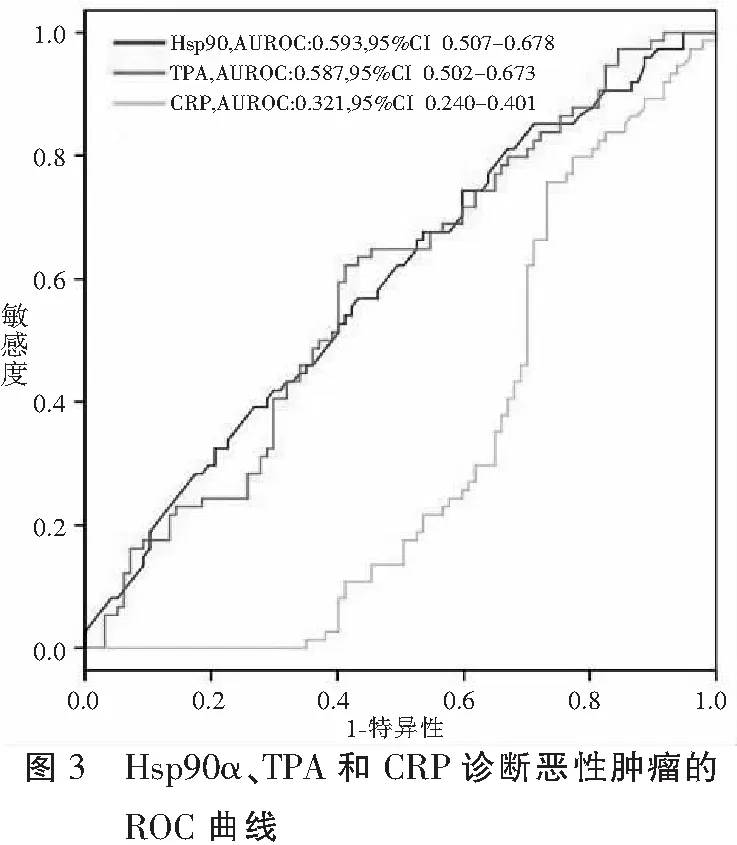
2.5 Hsp90α、TPA和CRP联合检测对恶性肿瘤的诊断效能
ROC曲线分析显示,Hsp90α&TPA、Hsp90α&CRP、TPA&CRP和Hsp90α&TPA&CRP的AUC分别为0.593、0.784、0.679和0.784,Hsp90α&CRP联合检测能提高对恶性肿瘤的诊断效能;而TPA的联合检测,并不能提高恶性肿瘤的检出灵敏度和特异性。见图4。
2.6 Hsp90α和TPA与CRP的比值对恶性肿瘤的诊断效能
ROC曲线分析显示, Hsp90α/CRP、TPA/CRP的AUC分别为0.765和0.742,Hsp90α与CRP进行比值计算后,灵敏性和特异度提高,提高了对恶性肿瘤的诊断效能。见图5。


2.7 Hsp90α、TPA和CRP单独和联合运用对恶性肿瘤的诊断效能
ROC曲线分析显示, Hsp90α对恶性肿瘤的诊断方面较TPA稍具优势(0.593>0.587),灵敏度达74.3%,但特异性稍显不足,仅为40.2%;其联合CRP检测或通过与CRP比值的计算后,可明显提高对恶性肿瘤的诊断效能,达到0.784或0.765,灵敏度和特异性亦增加。与TPA的联合检测,对恶性肿瘤诊断效能无提高,灵敏度和特异性亦无变化。见表2。

表2 Hsp90α、TPA和CRP单独和联合运用对恶性肿瘤的诊断效能
3 讨论
近年来,恶性肿瘤的发病率逐年上升,多数患者发病早期无典型的临床不适症状或症状轻微,至初次就诊时就已经是晚期。因此,恶性肿瘤的死亡率居高不下,严重威胁着人类健康。自上世纪起,多种肿瘤标志物应用于恶性肿瘤的早期筛查和辅助诊断,但单一肿瘤标志物的检测灵敏度仍然较低,特异性不足,远低于临床预期。目前,更推荐采用肿瘤标志物的联合检测方法,以期提高恶性肿瘤的检出率,增加对恶性肿瘤的诊断特异性[7]。
TPA是一种广谱的肿瘤筛查标志物,与肿瘤细胞的DNA合成相关,在多种肿瘤患者体内均发现增高[8],但有相当一部分非恶性肿瘤患者外周血TPA亦发现增高,阳性率约为14%~35%,故TPA尚不能很好的区分恶性肿瘤与炎症性疾病;Hsp90α是细胞内一种高度保守蛋白,正常主要辅助蛋白折叠、维持胞内多种信号传导蛋白的稳定性;而在荷瘤条件下,与肿瘤细胞的增殖分化以及各种癌症中凋亡相关分子有关[5]。有研究人员发现Hsp90α能加强DNA聚合酶polη的功能,参与DNA损伤反应和细胞凋亡[9],Hsp90α还能调节细胞内多种蛋白质的合成和功能,促进肿瘤的发生发展[10],并与肿瘤的分级分期和侵袭转移有关[11]。本研究发现,TPA和Hsp90α在恶性肿瘤患者体内均增加(P<0.05),但Hsp90α对恶性肿瘤的诊断性能更胜一筹,但特异性稍显不足,将两者联合检测对恶性肿瘤的诊断价值也未见明显提高(P>0.05)。
1800年前,Galenus发现恶性肿瘤在病理生理上与炎症组织相似,炎症组织损伤可能引起肿瘤的发生[12]。19世纪,学者发现肿瘤细胞内有白细胞的存在,这是癌症与慢性炎症之间存在一定相关性的第一个证据[13]。而慢性炎症诱导肿瘤发生发展的机制十分复杂,可能与局部微环境的反复组织损伤修复,使活化的炎性细胞释放大量炎症因子及介质,致细胞DNA链断裂,诱发基因突变,或引起原癌基因活化和抑癌基因失活,最终导致肿瘤的发生[14-15]。因此,部分学者将肿瘤相关性炎症归于肿瘤的第七大生物学特征。CRP是经典的急性时相反应蛋白,在炎症性疾病体内明显升高。近年来,CRP在诊断恶性肿瘤方面也逐渐受到重视。本研究ROC曲线分析结果发现,Hsp90α和CRP联合检测或计算Hsp90α/CRP比值,可以明显提高诊断效能(P<0.05)。
综上,Hsp90α是一种全新的肿瘤标志物,和CRP的联合检测或通过Hsp90α/CRP比值的计算,可提升恶性肿瘤的检出率,对炎症性疾病和恶性肿瘤的鉴别亦有一定价值。

