血清VEGF、HIF-1α及Hcy与2型糖尿病视网膜病变的相关性
陈焓,李志洪
(1.厦门大学附属第一医院眼科;2.中国人民解放军陆军第七十三集团军医院心内科心功能区,福建 厦门 361003)
糖尿病视网膜病变(diabetic retinopathy,DR)是因持续高血糖状态导致的眼底微血管功能和结构改变,是2型糖尿病(diabetes mellitus type 2,T2DM)患者常见的慢性进行性并发症之一,也是导致成人视力障碍的首要原因[1]。DR可通过早期规范性预防和治疗来延缓病情进展,改善预后[2],但DR病变早期无明显症状。因此,探究与DR相关的生化指标用以指导DR诊疗极具临床意义。目前,DR的确切机制仍不明确,近年来众多研究[3-4]支持慢性炎症、血管内皮功能紊乱、新血管生成等参与了DR的发生发展。血管内皮生长因子(vascular endothelial growth factor,VEGF)具有刺激血管内皮细胞生长增殖和诱导迁移、增强血管通透性、诱导新生血管形成等作用[5];缺氧诱导因子-1α(hypoxia inducible factor 1α,HIF-1α)是参与机体应答缺氧环境的一种转录调节因子,也是新血管形成中的关键因子之一[6];同型半胱氨酸(homocysteine,Hcy)可通过诱导生成H2O2而增加自由基活性的细胞毒作用,直接损伤血管内皮功能[7]。本研究旨在探究血清VEGF、HIF-1α及Hcy与DR的相关性。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年6月厦门大学附属第一医院收治的120例T2DM患者为研究对象,根据是否合并DR分为DR组(n=76)和单纯T2DM组(n=44),再根据DR分期将DR组分为非增殖型DR(non-proliferative diabetic retinopathy,NPDR)组(n=45)和增殖型DR(proliferative diabetic retinopathy,PDR)组(n=31)。纳入标准:(1)符合T2DM诊断标准;(2)完成DR筛查,DR诊断标准[8]:经散瞳后眼底镜检查、眼底荧光造影、眼底照相等检查发现渗出、出血、血管增生、微血管瘤等症状;(3)年龄18~75岁;(4)临床资料清晰完整;(5)患者或家属知情同意参与研究。排除标准:(1)合并免疫系统疾病、慢性炎性疾病、神经系统疾病、严重肝肾功能疾病、恶性肿瘤者;(2)合并青光眼、白内障、屈光改变等眼部疾病或眼底病变难以分级者;(3)妊娠或哺乳期妇女;(4)存在其他糖尿病急性并发症者;(5)入组前两个月内有免疫抑制剂、细胞毒制剂应用史者。本研究已获得相关医学伦理委员会审批。本研究为前瞻性研究,符合《赫尔辛基宣言》。
1.2 观察指标与检测方法
入组后即收集所有对象:(1)一般资料包括性别、年龄、体质指数(BMI)、糖尿病病程、收缩压(SPB)、舒张压(DPB)、吸烟及饮酒情况;(2)生化指标包括空腹血糖(FPG)、糖化血红蛋白(HbAlc)、血清总胆固醇(TC)、甲状腺球蛋白(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、超敏C-反应蛋白(hs-CRP)及VEGF、HIF-1α、Hcy,其中血清学指标检测血样为空腹外周静脉血,FPG检测采用葡萄糖氧化酶法,HbA1c检测采用高效液相色谱法,TC、TG、LDL-C、HDL-C、hs-CRP、Hcy检测采用全自动生化分析仪(AU5800,Beckman Coulter),VEGF、HIF-1α检测采用酶联免疫吸附法(ELISA)(上海酶联生物科技有限公司)。
1.3 统计学分析
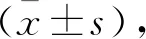
2 结果
2.1 单纯T2DM组与DR组患者一般资料比较
DR组糖尿病病程长于单纯T2DM组(P<0.05)。两组性别、年龄、BMI、SPB、DPB等其他一般资料比较,差异均无统计学意义(P>0.05)。见表1。
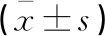
表1 单纯T2DM组与DR组一般资料比较
2.2 单纯T2DM组与DR组患者生化指标比较
与单纯T2DM组相比,DR组HbAlc及血清VEGF、HIF-1α、Hcy水平均更高(P<0.05)。两组FPG、TC、TG、LDL-C、HDL-C、hs-CRP水平比较,差异均无统计学意义(P>0.05)。见表2。
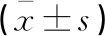
表2 单纯T2DM组与DR组患者生化指标比较
2.3 不同分期DR患者血清VEGF、HIF-1α、Hcy水平比较
PDR组血清VEGF、HIF-1α、Hcy水平均高于NPDR组,差异均有统计学意义(P<0.05)。见表3。
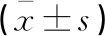
表3 不同分期DR患者血清VEGF、HIF-1α、Hcy水平比较
2.4 Logistic多因素回归分析
以T2DM患者是否合并DR为因变量,以单因素分析中有统计学意义的指标为自变量,行Logistic回归分析。结果显示,糖尿病病程、HbAlc、VEGF、HIF-1α、Hcy均是DR的独立危险因素(P<0.05)。见表4。

表4 影响DR的多因素Logistic回归分析
2.5 血清VEGF、HIF-1α、Hcy对DR、PDR的诊断价值
血清VEGF、HIF-1α、Hcy诊断DR的ROC曲线下面积(AUC)分别为0.754、0.683、0.676;且三者联合的AUC最大(0.984),敏感度、特异度分别为94.74%、95.45%。见表5。

表5 血清VEGF、HIF-1α、Hcy对DR的诊断价值
3 讨论
糖尿病病程是DR发生的重要危险因素,DR的发生几率会随病程的延长而显著增加;血糖控制是临床治疗糖尿病及其相关并发症的关键所在,高血糖状态会刺激T2DM患者眼底组织加速病变[9-10]。本研究也显示糖尿病病程、高HbAlc水平均是DR发生的独立危险因素,提示临床应重视T2DM的血糖控制状态,进行DR的定期筛查,从而通过早期积极干预来改善预后。
目前,DR发生发展的确切机制不详,但高血糖负荷导致的视网膜微血管损伤是主流假说[11]。VEGF是视网膜新血管生成、血管渗漏的关键因素,在DR的视网膜异常增生、纤维化病变过程中有着重要作用,其水平异常与DR病变程度存在显著相关性[12]。严鸣光等[13]研究显示,不同分期DR患者的房水和血清中的VEGF水平均存在明显差异,PDR患者的VEGF表达程度更高。VEGF一方面可与VEGF受体(vascular endothelial growth factor receptor,VEGFR)特异性结合来诱导内皮细胞增生,另一方面可通过细胞小囊泡器增强血管通透性。当机体的组织或细胞因高血糖刺激发生炎性损伤或增生时,血清VEGF水平随之上调,进而诱导新血管增生,最终形成DR[14]。抗VEGF靶向治疗是近年来临床DR治疗新策略和方向。本研究中,PDR组的血清VEGF水平高于NPDR组,且为DR发生的独立危险因素,与既往研究[15]结果相一致。
DR的发生还与视网膜缺氧有关。T2MD患者存在糖代谢异常,血红蛋白(hemoglobin,Hb)出现非酶糖化,将降低Hb的携氧能力,使氧扩散受阻,导致视网膜缺氧,视网膜微血管受损[16]。HIF-1α是细胞受缺血缺氧刺激而产生应答缺氧环境的特异性转录调节因子。Syaed等[17]研究发现,合并DR患者的外周血HIF-1α水平要高于单纯T2MD患者。HIF-1α与VEGF在DR患者外周血中表达呈现明显互相依赖,干扰HIF-1α可降低VEGF的表达[18]。基础实验[19]也证实,敲除掉小鼠的HIF-1α基因可有效降级细胞间黏附分子和VEGF的表达,减轻视网膜血管渗漏和过度增生。本研究显示,HIF-1α在DR组患者中表达更高,是DR发生的独立影响因素,表明HIF-1α与DR的发生发展密切相关,监测、调节HIF-1α表达可能是DR诊断、治疗的一种新思路。Hcy是血管内皮损伤的常用监测指标,可反映血管病变情况。高水平Hcy可能通过加重血管内皮细胞的脂质过氧化反应[20]、提高血小板的黏附性和聚集性[21]、刺激血管平滑肌过度增殖[22]等多种机制损害视网膜微血管,加重循环障碍,进而引发DR。本研究也证实,高Hcy水平是DR发生的独立危险因素,与黄漓莉等[23]研究结果一致。本研究还将血清VEGF、HIF-1α、Hcy用于DR诊断分析,ROC曲线分析显示,三者联合应用诊断DR的AUC高达0.984,明显高于单项指标应用,表明血清VEGF、HIF-1α联合Hcy对DR具较高的诊断效能。
综上所述,血清VEGF、HIF-1α、Hcy均与DR的发生发展关系密切,是DR发生的独立影响因素,三者联合用于DR诊断中具较高的诊断效能。临床在诊疗T2MD患者时应密切关注患者的血清VEGF、HIF-1α、Hcy水平,对存在较高风险的患者进行定期筛查,采取预防性干预措施,发挥其诊断、病情监测的积极作用,进而改善患者预后。

