膀胱癌患者癌组织Fibulin-3、SENP1、NCOA1表达与疾病进展及复发的关系
秦建文,张楠,刘小林,陈苏杭,周和平
(中国科学院国科医疗江油医院泌尿外科,四川 江油 621701)
膀胱癌属于泌尿系统高发恶性肿瘤,有调查[1]显示,在成人恶性肿瘤中,膀胱癌约占8%左右。研究膀胱癌进展与复发机制,对指导临床诊治,降低患者复发率、改善预后具有重要意义。纤蛋白3(Fibulin-3)属于细胞外基质中的糖蛋白,在人体广泛表达[2-3]。有研究[4]表明,细胞外基质中Fibulin-3起着构架作用,并可作用于下游信号通路,激活表皮生长因子受体信号通路。多种实体瘤患者肿瘤组织Fibulin-3异常表达,具有肿瘤促进作用[5]。SUMO特异性蛋白酶1(SENP1)可对肿瘤血管形成产生重要调控作用,参与肿瘤发生与发展[6]。核受体辅激活因子1(NCOA1)为依赖配体的相应转录因子,在多种病理组织中呈现高表达水平,可能参与肥胖、癌症以及糖尿病病理[7]。本文旨在探究膀胱癌患者癌组织Fibulin-3、SENP1、NCOA1表达情况与疾病进展及复发的关系。
1 资料与方法
1.1 一般资料
选取2015年2月至2017年3月中国科学院国科医疗江油医院收治的104例膀胱癌患者的癌组织和癌旁组织为研究对象。纳入标准:(1)具有手术适应症,并接受根治性全膀胱切除术;(2)病理证实为膀胱癌;(3)临床资料完整;(4)精神、意识正常,签署研究知情同意书。排除标准:(1)合并严重心、肝、肾等疾病;(2)其他恶性肿瘤患者;(3)具有传染病史。本研究经医院医学伦理委员会审批。
1.2 方法
1.2.1 资料收集 包括性别、年龄、体重指数(BMI)、肿瘤直径、TNM分期、病理分级、淋巴结转移、浸润深度及随访3年疾病复发情况。
1.2.2 免疫组化检测 取自手术切除的癌组织与相应配对癌旁(与肿瘤间隔>5 cm)正常组织。石蜡包埋切片,利用柠檬酸盐修复液进行抗原的修复;以3%过氧化氢连续孵育10 min,同时对内源性过氧化物酶进行封闭处理;以山羊血清封闭。接着分别放入Fibulin-3单克隆抗体、SENP1单克隆抗体及NCOA1单克隆抗体,均由Abcam 公司提供,置于4 ℃条件下孵育过夜。第2天以山羊抗兔免疫球蛋白G(IgG)二抗(经辣根过氧化物酶进行标记,控制稀释比等于1∶50)处理,室温下连续孵育30 min。二氨基联苯胺(DAB)显色,并以苏木素复染,利用二甲苯进行透明处理。注意以磷酸盐缓冲液(PBS)代替一抗,用于阴性对照。安排两名病理科医师,通过双盲法独立完成阅片过程。结果评估:在各切片之中随机取五个观察视野(400×),进行染色评估,并在200个细胞之中,算出阳性细胞所占百分比。染色评分标准:显示淡黄色为1分;显示棕黄色为2分;显示棕褐色为3分;阳性细胞百分比评分标准:百分比<10%为1分;10%<百分比≤50%为2分;50%<百分比≤80%为3分;百分比>80%为4分。染色评分+百分比评分>3分提示阳性表达[8]。
1.2.3 苏木精-伊红(HE)染色 采用10%甲醛固定组织样本,石蜡包埋之后进行HE染色。
1.3 统计学分析
采用SPSS 22.0软件对数据进行分析与处理。计数资料以[n(%)]表示,采用χ2检验;相关性采用Logistic回归模型分析;生存分析采取Kaplan-Meier生存曲线分析。P<0.05为差异有统计学意义。
2 结果
2.1 膀胱癌与癌旁组织Fibulin-3、SENP1、NCOA1表达比较
膀胱癌组织Fibulin-3、SENP1、NCOA1表达阳性率高于癌旁组织(P<0.05)。见表1。
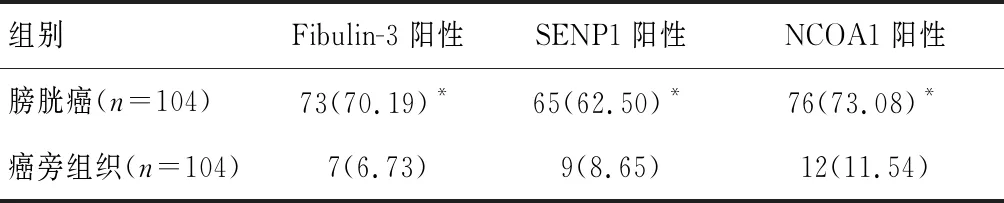
表1 膀胱癌与癌旁组织Fibulin-3、SENP1、NCOA1表达比较[n(%)]
2.2 不同临床特征患者Fibulin-3、SENP1、NCOA1表达阳性率比较
不同性别、年龄、BMI、肿瘤直径患者Fibulin-3、SENP1、NCOA1阳性率比较,差异无统计学意义(P>0.05);不同TNM分期、病理分级、浸润深度及淋巴结转移情况患者Fibulin-3、SENP1、NCOA1阳性率比较,差异有统计学意义(P<0.05)。见表2。
2.3 Logistic单因素与多因素回归分析
Logistic回归分析显示,Fibulin-3、SENP1、NCOA1表达情况与TNM分期、病理分级、淋巴结转移、浸润深度有关(P<0.05)。见表3。
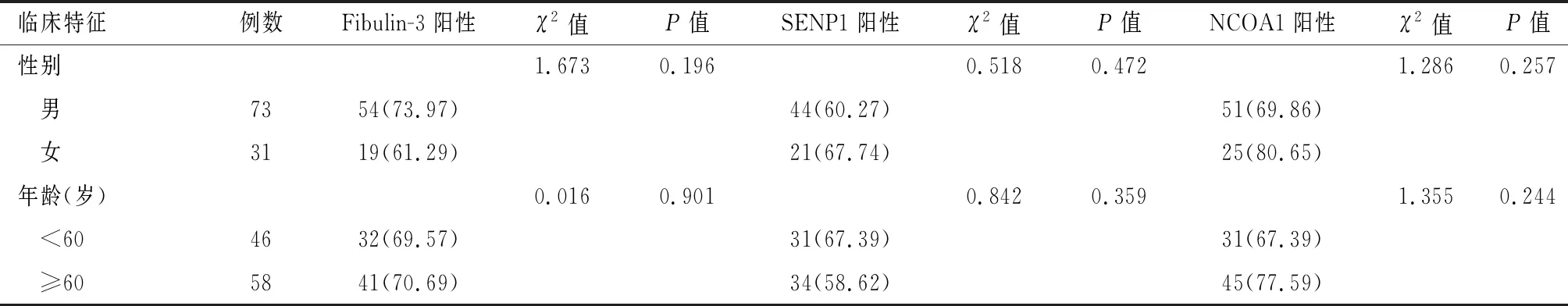
表2 不同临床特征患者Fibulin-3、SENP1、NCOA1表达阳性率比较[n(%)]

续表2
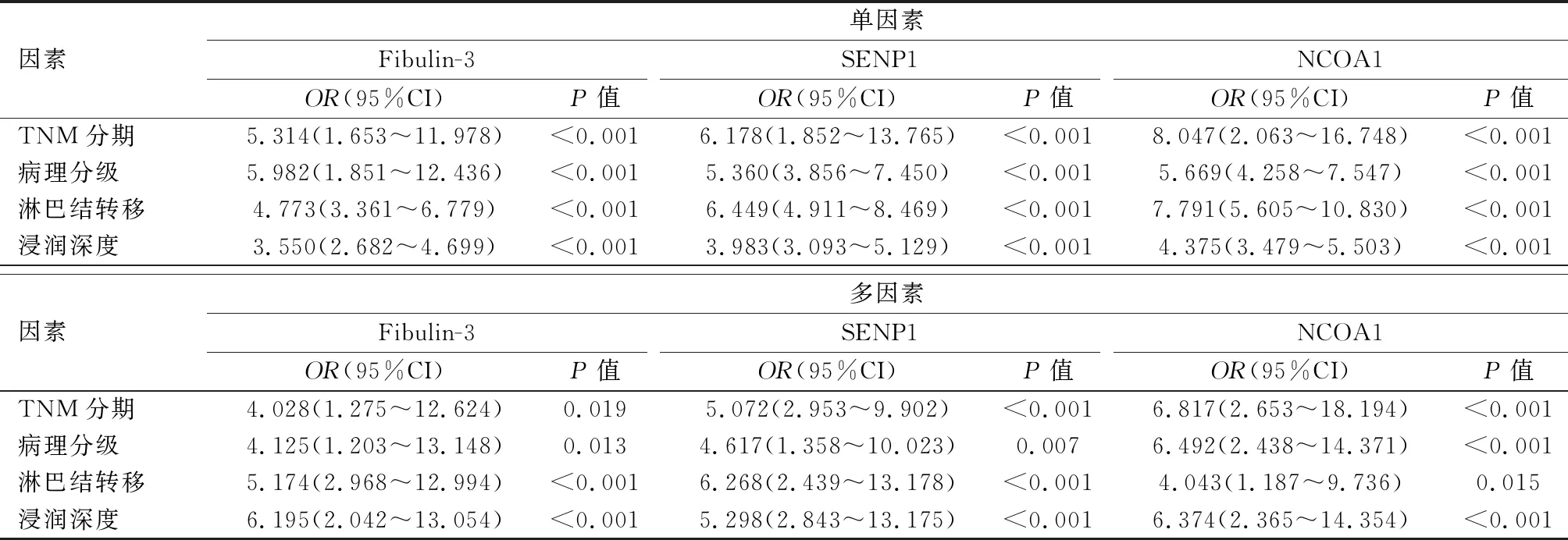
表3 Logistic单因素与多因素回归分析
2.4 Fibulin-3、SENP1、NCOA1表达与疾病复发的关系
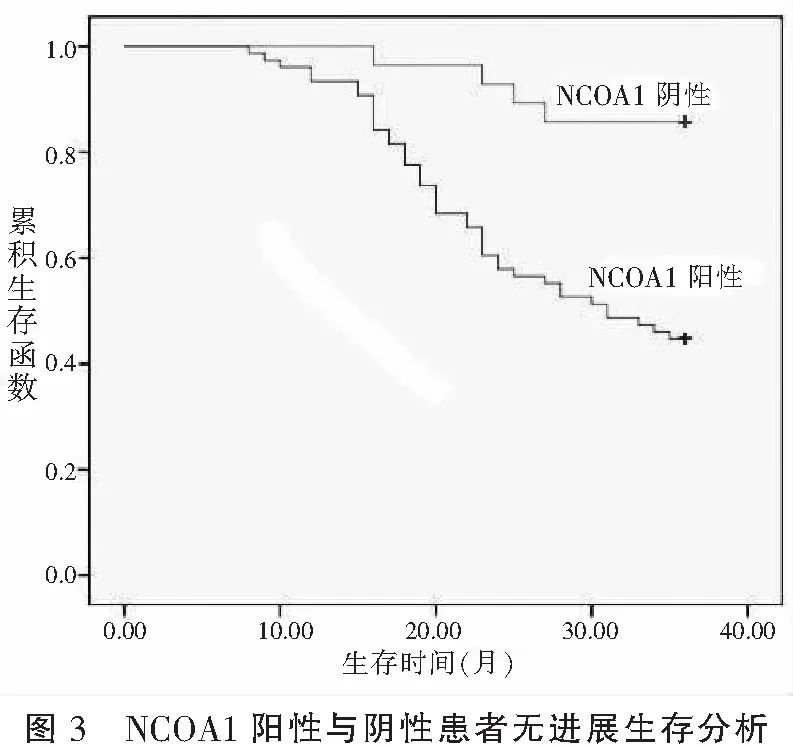
随访发现,104例患者共复发46例(肾盂肿瘤6例、盆腔复发5例、尿道复发3例、远处转移32例,其中远处转移包括肺9例、骨10例、肝6例、腹膜后盆腔淋巴结7例),中位随访时间29(28~31)个月。Fibulin-3、SENP1、NCOA1表达阳性患者3年无进展生存率低于表达阴性患者(χ2=12.793、35.840、12.558,P<0.05)。见表4、图1-图3。
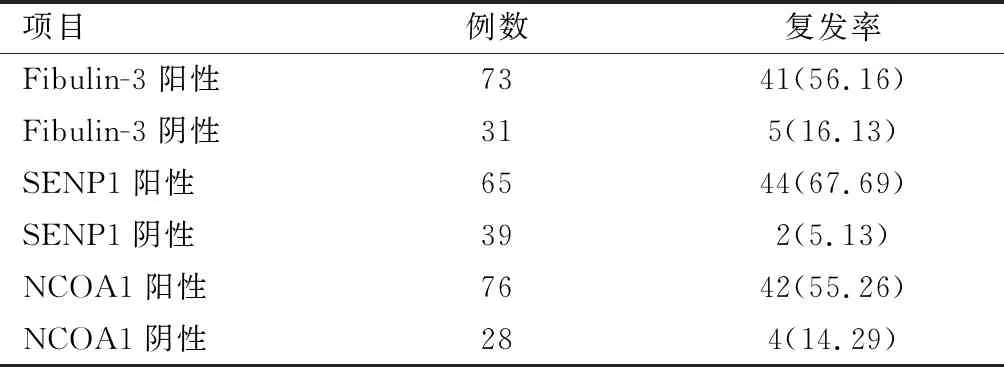
表4 复发情况[n(%)]


3 讨论
Fibulins与参与构成人体细胞外基质,当前已知包含七个基因型,Fibulin-3具有调控细胞生长与相关信号转导作用,同时在肿瘤发生及演进中起着重要作用[9]。相关研究[10-11]表明,卵巢癌、神经胶质瘤、宫颈癌以及胰腺癌中Fibulin-3具有过表达表现,且和肿瘤进展、患者不良预后有关,关于作用机制,可能由于Fibulin-3启动子区处于超甲基化状态,造成肿瘤恶化。亦有报道[12]认为,对于膀胱癌而言,Fibulin-3属于前侵入因子。本研究中,相较于癌旁正常组织,膀胱癌组织Fibulin-3阳性率升高(P<0.05)且与肿瘤TNM分期、病理分级、淋巴结转移以及浸润深度紧密相关(P<0.05),与上述研究观点相符。说明Fibulin-3可能参与膀胱癌的发生及进展,考虑可能与Fibulin-3调控上皮间充质转化、基质金属蛋白酶分泌、血管生成、相关信号通路(包括NOTCH、MAPK以及AKT等)有关[13]。有研究[14]表明,SENP1属于缺氧诱导因子1α(HIF-1α)调控靶基因,SENP1与HIF-1α通过正反馈作用可增加肝癌干细胞特性,加快肝癌产生。以往研究以前列腺癌患者为对象,发现病灶组织里面SENP1呈现为高表达,其参与肿瘤侵袭以及复发;通过抑制SENP1表达,能够影响 HIF-1α与相应信号通路中下游部位基质金属蛋白酶2(MMP-2) 与基质金属蛋白酶9(MMP-9)骨重构作用,从而起到抑制骨转移效果[15]。本研究中,膀胱癌组织SENP1阳性率高于癌旁正常组织(P<0.05);Logistic分析发现,其与肿瘤浸润深度、分期、淋巴结转移及病理分级有关(P<0.05),表明SENP1可能具有促进膀胱癌进展作用,原因可能和其调控 HIF-1α活性及其下游血管内皮生长因子(VEGF)有关。鉴于SENP1、Fibulin-3均能够调控血管生成,故考虑两者在膀胱癌进展中可能具有协同作用。HIF1α可能通过结合以及激活转录因子NCOA1的方式,调控C-X-C趋化因子受体4,从而加快肿瘤转移[16],推测SENP1与NCOA1共同参与肿瘤侵袭及转移。有报道[17]显示,膀胱癌患者NCOA1蛋白表达水平和临床分期、是否出现淋巴结转移等存在显著相关性。本研究显示,膀胱癌组织NCOA1阳性率异常升高(P<0.05),并和肿瘤分期、淋巴结转移情况有关(P<0.05),与上述研究观点一致,并创新性发现NCOA1和膀胱癌病理分级及浸润等进展密切相关。NCOA1能够通过提高雄激素受体(AR)活性的方式介导细胞增殖,对其进行敲除,可以减少雄激素依赖的相应细胞(如LNCap细胞)增殖,同时对AR依赖细胞(如C4-2细胞)生长产生抑制作用[18]。
以往关于不同Fibulin-3、SENP1、NCOA1表达膀胱癌患者生存分析的研究极少。本研究经生存分析创新性发现,Fibulin-3、SENP1、NCOA1表达阳性患者3年无进展生存率明显更低(P<0.05),提示Fibulin-3、SENP1、NCOA1阳性膀胱癌患者存在更高疾病进展与复发风险。
综上,相较于正常组织,膀胱癌组织Fibulin-3、SENP1、NCOA1阳性率更高,且和疾病进展与复发紧密相关,其检测对患者疾病诊治及预后评估具有重要指导价值。但本研究具有一定局限性,比如样本量较少,为单中心研究,且仅采用免疫组化分析法,方法有限,关于Fibulin-3、SENP1与NCOA1参与膀胱癌进展与复发具体分子机制,有待后续大样本、多检测方式及多中心研究进一步探究、补充与完善。

