菌菇复合多糖对秀丽线虫氧化胁迫抗性的影响
张 菊, 贾东升, 赵士豪, 谢晓亮, 陈 宏, 李海峰*
(1 河北经贸大学生物科学与工程学院 石家庄050072 2 河北省农林科学院经济作物研究所 石家庄050051 3 广东药科大学生命科学与生物制药学院 广州510006)
菌菇多糖作为食用菌中扶正固本、 安全无毒的主要天然活性成分, 已被研究证实具有免疫调节[1-3]、抗肿瘤[4-5]、抗疲劳[6-7]、抗衰老[8-9]、降血糖[10-12]等多种生理活性和功能,被广泛称为“生物应答调节剂”。 现代药理学研究发现,绝大部分病变与体内抗氧化能力衰退有关, 当机体不能及时清理体内过氧化物时,则会导致细胞损伤,进而导致机体受损、病变。菌菇多糖的多种生物活性均与其抗氧化性相关[13-14],即多糖可以通过缓解衰老、疾病、辐射、 代谢等引起的氧化应激达到治疗和预防肿瘤发生、免疫力低下等疾病。多糖的抗氧化性被认为是其多种生理活性和功能的作用机理之一[13]。
近年来, 生物活性多糖的研究也正由单独应用向多糖与多糖间的协同效应研究转变[15-16]。 例如,枸杞多糖、黄芪多糖与红枣多糖组成的复合多糖在低剂量时即可对细胞有较好的抗氧化作用,并可抑制四氯化碳造成的小鼠肝脏损伤, 表现出优于单一多糖活性的效果[17]。 同样,我国食用菌种类繁多,菌菇多糖之间的复合使用,无疑为菌菇多糖的开发提供了新的研究方向。
本研究结合菌菇多糖在抗肿瘤、 代谢及免疫调节等方面的应用,选取香菇、滑子菇和栗蘑为原料, 以抗氧化活性指标为依据, 采用试验操作简便、 关键信号通路与人类同源的模式生物秀丽线虫为实验模型,通过体内、体外相结合的评价方法对菌菇复合多糖的抗氧化活性进行综合评价,同时结合秀丽线虫体内的氧化胁迫抗性检测初步探究其活性作用机制,以期为食用菌资源的利用,菌菇多糖产品的开发提供更多的理论依据。
1 材料与方法
1.1 模式动物与试验材料
野生型秀丽线虫N2、 转基因线虫LG345、GR1352 和大肠杆菌(OP50 和NA22),购于美国明尼苏达大学秀丽线虫遗传中心(Caenorhabditis Genetics center)。 香菇 【Lentinusedodes(Berk.)Sing.】、滑子菇(Pholiota nameko)、栗蘑【Polyporus frondosus (Dicks.) Fr.】,购于安国市药材市场。
1.2 试剂与仪器
维生素C、DPPH、邻二氮菲、琼脂、胰蛋白胨、酵母提取物、 氨苄青霉素、2′-脱氧-5-氟脲苷,美国Sigma 公司;硫酸亚铁、双氧水,国药集团化学试剂有限公司;Pierce BCA 蛋白定量分析试剂盒,美国Thermo 公司;活性氧(ROS)检测试剂盒、总超氧化物歧化酶(SOD)活性检测试剂盒、脂质氧化(MDA)检测试剂盒、过氧化氢酶(CAT)检测试剂盒、总谷胱甘肽过氧化物酶(GPx)检测试剂盒,碧云天生物科技有限公司。
全波长酶标仪(Synergy H1 型),美国BioTek公司;Image Xpress Micro 高内涵成像分析仪,美国Molecular Devices 公司; 定量PCR 仪, 美国Bio-Rad 公司; 紫外-可见分光光度计 (SP-756型),上海光谱仪器;研磨机(JX-24 型),上海净信公司。
1.3 方法
1.3.1 菌菇多糖的提取 取等量的香菇、 滑子菇和栗蘑的干燥子实体按质量比1∶1∶1 的比例配料,粉碎,称重,乙醇回流提取2 次,每次2 h。过滤,将滤渣挥干乙醇后,水浴加热提取2 次,每次2 h,合并水提液并浓缩。 浓缩液按1∶3 的比例加入无水乙醇并搅拌, 沉淀出粗多糖, 用75%乙醇反复洗涤、沉淀,离心分离沉淀物,采用喷雾干燥法干燥,得到菌菇复合多糖样品(FHP)。 取与复合配料同等质量的香菇、 滑子菇和栗蘑的干燥子实体,粉碎,称重,按同样方法制备香菇多糖(XGP)、滑子菇多糖(HZP)和栗蘑多糖(LMP)的单一多糖样品,备用。其中,用于秀丽线虫体内活性试验的样品需溶于秀丽线虫液体培养基中, 配制成5 mg/mL 的多糖样品母液, 过0.22 μm 无菌微孔滤膜后,备用。
1.3.2 体外自由基清除的测定 羟自由基(·OH)和1,1-二苯-2-苦肼基(DPPH·)自由基清除试验参照周萍等[13]的方法,以VC 的自由基清除率为阳性对照, 等体积的蒸馏水为对照组, 平行测量3次,数据以(±s)表示。 将上述复合及单一多糖样品(FHP、XGP、HZP、LMP)分别配成1.0 mg/mL 的溶液,用于测量。
1.3.3 秀丽线虫食物清除率的测定 食物清除率试验参考Zhang 等[18]方法。 将同步化的L1 期N2线虫、 食物大肠杆菌OP50 及样品溶液一同加入96 孔板中,对照组以液体培养基代替,每个样品质量浓度设置8 个复孔。 用普通光学酶标仪检测96 孔板每孔的OD570nm值, 作为第1 天的初始值。将线虫于20 ℃培养箱中培养,在第2~7 天每天相同的时间测定OD570nm值。
1.3.4 秀丽线虫百草枯氧化胁迫存活率的测定秀丽线虫百草枯氧化胁迫存活率试验参照Wang等[19]的方法。 将同步化的成虫初期线虫,2′-脱氧-5-氟脲苷 (终质量浓度75 μg/mL)、 氨苄青霉素(终质量浓度100 μg/mL)、食物NA22(OD570nm≈0.70) 和不同的多糖样品一同加入96 孔板中,空白对照组以液体培养基代替,每个样品设10 个复孔,20 ℃继续孵育48 h 后, 加入10 μL 百草枯溶液(ROS 诱导试剂,终浓度为60 mmol/L),混合均匀后置于20 ℃孵育。 以加入百草枯为第0 小时,每12 h 统计秀丽线虫的存活状况,直至其全部死亡。 统计过程中将身体僵直不动及对轻微震动无反应的秀丽线虫判断为死亡状态。
1.3.5 秀丽线虫体内ROS 水平的测定 线虫体内ROS 水平测定试验参照Zhang 等[18]的DCFHDA 探针法。按照氧化胁迫存活试验方法准备秀丽线虫并给药处理,不同之处在于将线虫加入24 孔板中(终体积1 000 μL/孔,500 条线虫/孔,设3 个复孔),20 ℃培养2 d 后, 加入10 μL 百草枯溶液(终浓度为10 mmol/L),之后于20 ℃下继续培养2 d,收集每个处理组的虫液,并用液体培养基洗涤3 次以除去样品、 大肠杆菌和百草枯, 用400 μL PBS 重悬线虫, 采用研磨机在4 ℃下研磨匀浆6 min(研磨45 s,间隔15 s),离心(4 ℃,12 000 r/min,10 min),收集上清即酶液。 采用Pierce BCA蛋白定量分析试剂盒和ROS 检测试剂盒分别测定酶液的蛋白质浓度和ROS 水平。 测定结果以每mg 酶液蛋白的ROS 含量表示。
水库入库前1 km处地势平缓,有较厚淤泥层,可修建人工湿地(前置库),种植耐水湿陆生植物,耐阴常绿水生植物,并在湿地内开挖导流引水沟,净化水质。
1.3.6 秀丽线虫体内MDA 含量的测定 秀丽线虫的培养、处理、酶解液的制备及蛋白含量的测定同ROS 检测方法。 MDA 含量测定采用脂质氧化检测试剂盒测定, 结果换算为每mg 酶液蛋白的MDA 含量。
1.3.7 抗氧化酶活性的检测 秀丽线虫的培养、处理、酶解液的制备及蛋白含量的测定同ROS 检测方法。SOD、CAT 和GPx 的活力测定采用总SOD活性检测试剂盒、 过氧化氢酶检测试剂盒和总谷胱甘肽过氧化物酶检测试剂盒, 结合全波长酶标仪测定,测定结果换算为每mg 酶液蛋白的抗氧化酶活力。
1.3.8 转录因子入核的检测 转录因子SKN-1的入核试验通过转基因线虫LG345 进行观察[20],DAF-16 的入核试验通过转基因线虫GR1352 进行观察[21]。 将同步化的L1 期秀丽线虫置于24 孔板中培养并给予多糖处理,其中LG345 线虫在20℃下多糖处理24 h, 在线虫L2 期进行观察;GR1352 线虫在20 ℃下多糖处理48 h,在L3 期进行观察。 收集指定时间线虫,M9 缓冲液洗去残留细菌,重悬于50 μL M9 缓冲液中,取约20 μL 虫液转移至新的24 孔板的正中央,加盖14 mm 圆形盖玻片,用Image Xpress Micro 设备拍照。 收集线虫荧光图片, 统计SKN-1 和DAF-16 的入核情况。 每个试验组随机挑选50 条线虫进行统计,并计算发生入核转移的线虫比例。 判断转录因子入核的标准:GFP 在线虫肠道或者体细胞中形成分散的、聚集样荧光斑块。
1.3.9 RNA 提取及定量PCR 检测 将同步化的L1 期N2 线虫、大肠杆菌NA22(OD570nm≈0.70)及多糖样品溶液(终质量浓度为0.1 mg/mL)一同加入24 孔板中 (终体积1 000 μL/孔,500 条线虫/孔,设4 个复孔),对照组以液体培养基代替样品。20 ℃继续培养72 h 后收集各组线虫约2 000 条。采用Trizol 法提取线虫总RNA,Primer 5 设计相关基因引物。 SYBR Green 为DNA 荧光染料,以Real-Time PCR 的2-△△CT值表示相关基因在秀丽线虫体内的mRNA 的相对表达水平。
1.3.10 寿命试验 秀丽线虫寿命试验参考Zhang等[22]的方法。 将同步化的成虫初期线虫(10~15 条/孔),2′-脱氧-5-氟脲苷(终质量浓度75 μg/mL)、氨苄青霉素(终质量浓度100 μg/mL)、食物NA22(OD570nm≈0.70) 和不同质量浓度样品一同加入96孔板中(终体积100 μL/孔),空白对照组以液体培养基代替样品,做液体寿命试验。每个样品质量浓度设置10 个复孔, 以开始给药为第0 天, 在20℃、120 r/min 条件下培养,每隔2 d 统计1 次秀丽线虫的存活状况,直至全部死亡。统计过程中将身体僵直不动并对轻微震动无反应的秀丽线虫判断为死亡。
1.3.11 脂褐素水平的测定 脂褐素水平检测参照Gerstbrein 等[23]的方法。按照寿命试验方法准备秀丽线虫,加入黑色96 孔板中,每个浓度设10 个复孔,20 ℃下培养24 h,采用全波长酶标仪测定脂褐素相对荧光强度,激发波长355 nm,发射波长460 nm,记为第1 天。 每隔2 d 测定1 次,连续测定3 次。
1.3.12 数据处理 所有试验均进行3 次以上独立重复试验。 存活曲线以重复试验中最具代表性的试验结果表示, 其统计学分析采用GraphPad Prism 的时序检测(Mantel-Cox test)方法。 与对照组相比,P<0.05 被认为具有显著性差异。食物清除率试验以10 个复孔检测值的(±s)表示。 其它试验数据以(±SEM)表示,统计学分析采用Graph-Pad Prism 5 的one-way ANOVA 分析和邓尼特多重比较检验 (Dunnett's multiple comparisons test)比较试验组和对照组的差异性。 与对照组相比,P<0.05 被认为具有显著性差异(*P<0.05;**P<0.01)。

表1 引物序列Table 1 Primer sequence
2 结果
2.1 菌菇多糖的体外自由基清除率
为了确定菌菇复合多糖是否具有比单一多糖更优的体外抗氧化效果, 首先检测XGP、HZP、LMP 和FHP 的体外·OH 和DPPH·的自由基清除效率,结果见表2。 与对照组比较,质量浓度为1.0 mg/mL 的XGP、HZP、LMP 和FHP 对·OH 和DPPH·均表现出明显的清除活性。相同条件下,菌菇复合多糖的体外自由基清除能力均大于单一菌菇多糖,表现出更好的体外抗氧化效果。
表2 菌菇多糖的自由基清除能力(±s, n=3)Table 2 Free radical scavenging ability of mushroom polysaccharide(±s, n=3)
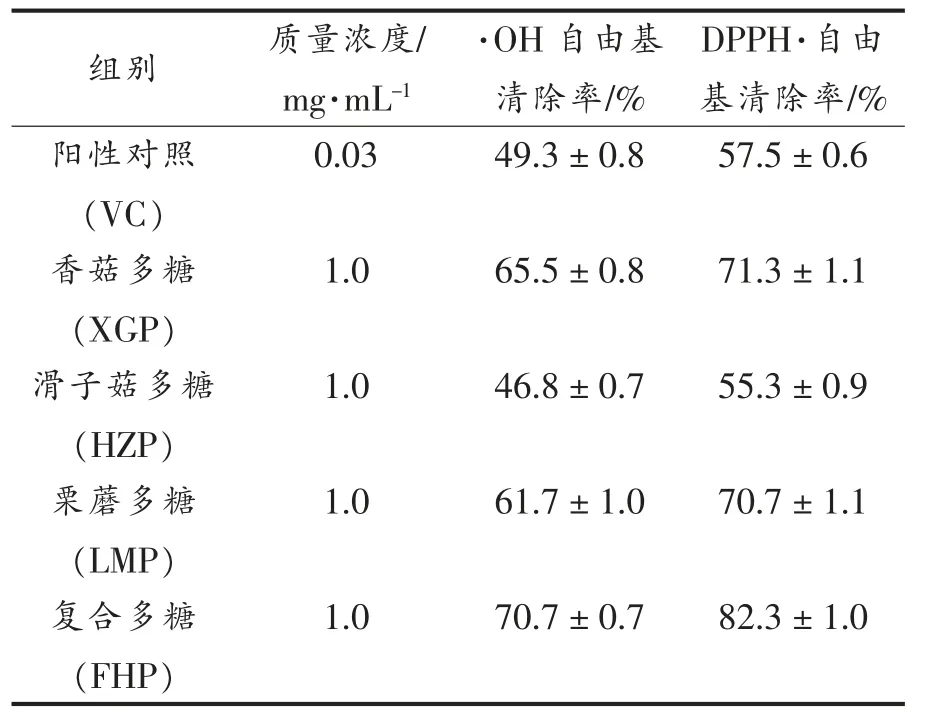
表2 菌菇多糖的自由基清除能力(±s, n=3)Table 2 Free radical scavenging ability of mushroom polysaccharide(±s, n=3)
组别 质量浓度/mg·mL-1·OH 自由基清除率/%DPPH·自由基清除率/%阳性对照(VC)0.03 49.3±0.8 57.5±0.6香菇多糖(XGP)1.0 65.5±0.8 71.3±1.1滑子菇多糖(HZP)1.0 46.8±0.7 55.3±0.9栗蘑多糖(LMP)1.0 61.7±1.0 70.7±1.1复合多糖(FHP)1.0 70.7±0.7 82.3±1.0
2.2 菌菇多糖对秀丽线虫氧化胁迫存活率的影响
在体外检测基础上, 通过模式生物秀丽线虫的氧化胁迫存活率试验研究菌菇多糖的体内抗氧化活性。 首先通过N2 线虫的食物清除率试验,摸索菌菇多糖合适且不影响线虫正常生长的体内质量浓度。 其结果如图1a 所示。 随着培养时间的延长,培养板中OP50 的含量呈降低趋势。 与空白对照组曲线相比,在质量浓度0.5 mg/mL 下,不论是单一组分多糖还是复合多糖对N2 线虫的食物清除速率均未产生明显影响, 曲线变化趋势与对照组一致。 质量浓度达到1.0 mg/mL 和2.0 mg/mL时,曲线变化趋势与对照组相比,均出现减缓或加速变化趋势, 说明较高的多糖质量浓度对秀丽线虫正常生长繁殖产生一定影响。 体内抗氧化活性试验中各多糖处理组均采用≤0.5 mg/mL 的质量浓度。之后,检测了菌菇多糖对N2 线虫抵抗百草枯氧化胁迫能力的影响。 结果如图1b 所示。 当随机选择质量浓度0.3 mg/mL 时,不论是单一多糖组分XGP、HZP、LMP,还是复合多糖FHP,均表现出对秀丽线虫氧化胁迫存活时间的延长作用。 重复试验结果表明,FHP 处理组的延长效果最显著,其不仅延长N2 线虫在百草枯胁迫下的中位存活时间,而且延长了线虫的平均存活时间和最大存活时间。该结果表明,菌菇复合多糖的体内抗氧化效果同样优于单一多糖。进一步的研究表明,FHP 对秀丽线虫的体内抗氧化效果与质量浓度存在负相关性,结果如图1c 所示,质量浓度越低,对秀丽线虫体内的氧化胁迫抗性越明显。

图1 菌菇多糖对N2 线虫的体内抗氧化活性的影响Fig.1 Effects of mushroom polysaccharides on antioxidant activity of N2 nematodes in vivo
2.3 菌菇复合多糖对秀丽线虫体内氧化胁迫水平的影响
在确定复合多糖FHP 较单一组成多糖更好的抗氧化效果后,就FHP 对秀丽线虫体内氧化胁迫抗性机制进行探讨。 线虫氧化胁迫存活率试验中,造模试剂百草枯是公认的ROS 诱导剂。 为了验证FHP 增加线虫氧化胁迫存活率的抗氧化效果是否与其体内自由基清除相关,检测FHP 对百草枯胁迫下秀丽线虫体内ROS 水平,ROS 介导的脂质氧化产物MDA 含量的影响。 其中,线虫体内ROS 水平检测采用DCFH-DA 探针法, 通过探针在体内与ROS 反应产物的荧光强度间接反映体内ROS 的水平。结果如图2a 所示。随着检测时间的延长,探针检测到的ROS 含量增多。 与对照组相比,FHP 处理组能显著降低线虫体内ROS 水平, 其中0.1 mg/mL FHP 处理组的效果最显著。ROS 介导的细胞膜脂质氧化产物MDA 含量检测结果(图2b)也表明,与对照组相比,FHP 处理可有效降低胁迫条件下N2 线虫体内的MDA 水平。其中,低质量浓度(0.1 mg/mL 和0.3 mg/mL)FHP处理组的效果最明显。以上结果表明,菌菇复合多糖的抗氧化活性应与其降低胁迫条件下线虫体内ROS 水平和MDA 含量, 抑制线虫体内氧化胁迫水平相关,而这一活性与质量浓度存在相关性。
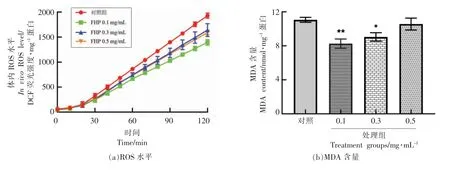
图2 菌菇复合多糖对胁迫条件下N2 线虫体内氧化胁迫水平的影响Fig.2 Effects of FHP on the oxidative stress levels in N2 nematodes under stress
2.4 菌菇复合多糖对秀丽线虫胁迫响应关键转录因子活性的影响
研究表明,胰岛素信号通路(IIS)中与胁迫应激响应相关的关键转录因子SKN-1/Nrf2 和DAF-16/FOXO 被证实可以对氧化胁迫信号分子ROS作出响应并激活下游的抗氧化酶基因, 增强机体的抗氧化能力[24]。 为了验证菌菇复合多糖的抗氧化活性是否与上述应激响应机制相关, 检测FHP对关键转录因子SKN-1 和DAF-16 活性的影响。
转录因子的入核转移是其被激活的前提。 在试验过程中, 选用与SKN-1 和DAF-16 共表达GFP 融合蛋白的转基因线虫LG345 和GR1352,检测FHP 对SKN-1 和DAF-16 的入核转移的影响。 正常情况下,与SKN-1 共表达的GFP 聚集在ASI 神经元的细胞核, 同时以弥散的小点状分散在肠道细胞的细胞质中 (图3a,LG345-对照);与DAF-16 共表达的GFP 则分布在线虫多个部位的细胞质中,线虫表现为通体荧光(图3a,GR1352-对照)。 当转录因子被激活时,GFP 从细胞质转移并聚集到细胞核内, 形成分散的、 荧光聚集斑块(图3a,以热激处理为阳性对照)。 通过荧光聚集斑点的有、无可以间接判定转录因子的激活情况。以被检测的线虫体内出现荧光聚集斑块的线虫比例进行统计,结果如图3b 所示。 与各组的空白对照相比,FHP 处理组显著增加了转录因子SKN-1入核的线虫比例, 而对DAF-16 入核转移线虫的比例虽有增加趋势,但差异不显著。 该结果表明,FHP 处理有效激活了线虫体内胁迫应激关键转录因子SKN-1 的活性, 而DAF-16 的活性仍需验证。

图3 菌菇复合多糖对秀丽线虫胁迫响应关键转录因子活性的影响Fig.3 Effects of FHP on the activities of key transcription factors in response to stress in Caenorhabditis elegans
2.5 菌菇复合多糖对SKN-1 和DAF-16 转录因子靶基因表达的影响
为了进一步验证FHP 对SKN-1 和DAF-16的激活情况,探究FHP 对IIS 信号通路的影响。 选择野生型秀丽线虫N2, 提取总RNA。 采用qRTPCR 法分别检测FHP 对SKN-1 下游靶基因gcs-1(γ 谷酰基半胱氨酸合成酶),gst-4(谷胱甘肽S-转移酶),gst-10(谷胱甘肽S-转移酶)和DAF-16 下游靶基因sod-3(超氧化物歧化酶),gsh-px(谷胱甘肽过氧化物酶),ctl-1(过氧化氢酶酶)的mRNA 表达量的影响,结果如图4 所示。 与对照组相比,FHP处理后,N2 线虫体内SKN-1 和DAF-16 的下游靶基因gcs-1、gst-4 和sod-3、gsh-px 的转录水平均有显著增加。 该结果验证了FHP 对SKN-1 和DAF-16 的激活活性,表明FHP 可有效调控IIS 信号通路下游胁迫响应效应基因的表达。
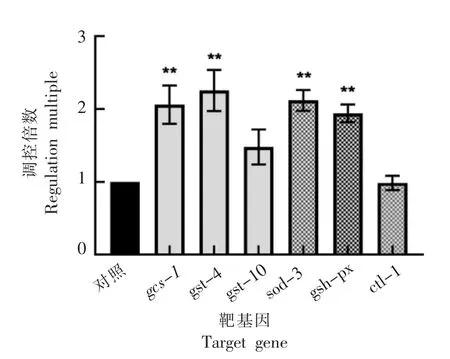
图4 菌菇复合多糖对N2 线虫胁迫响应效应基因表达的影响Fig.4 Effects of FHP on expression of stress responsive genes in N2 nematodes
2.6 菌菇复合多糖对秀丽线虫体内抗氧化酶活性的影响
抗氧化酶是细胞内抗氧化系统中的关键物质,增强抗氧化酶活力有助于清除过量ROS 和缓解氧化胁迫。 为进一步验证FHP 通过调控IIS 信号通路增强秀丽线虫氧化胁迫抗性的作用机制,测定FHP 对秀丽线虫体内SOD、CAT 和GPx 活性的影响,结果如图5 所示。 与对照组相比,FHP 处理组可显著提高SOD 和GPx 的酶活力 (图5a、5c),尤其在低质量浓度处理组(0.1,0.3 mg/mL)效果最明显。 而对CAT 的酶活力无显著影响。 该结果表明,FHP 的自由基清除活性应主要与其提升线虫体内SOD 和GPx 的活性相关, 而与CAT 的关系不大。该结果与FHP 对SKN-1 和DAF-16 下游效应基因的影响相一致, 即虽然在入核转移实验中DAF-16 的入核激活并不显著,但是FHP 的抗氧化效果仍与DAF-16 的激活及其下游效应体相关。
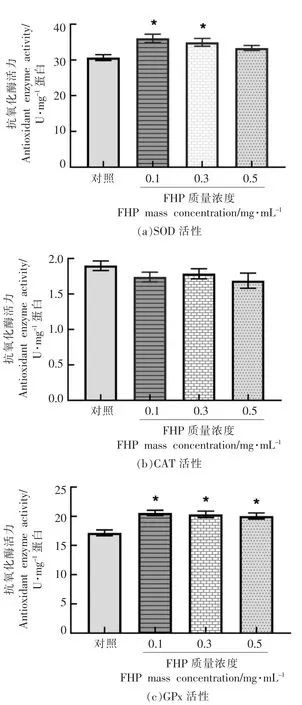
图5 菌菇复合多糖对胁迫条件下N2 线虫体内抗氧化酶活性的影响Fig.5 Effects of FHP on the activity of antioxidant enzymes in N2 nematodes under stress
2.7 菌菇复合多糖对秀丽线虫衰老的影响
根据衰老的自由基学说, 衰老的产生与体内过量自由基的生成及由此产生的氧化胁迫环境直接相关。 在确定菌菇复合多糖对秀丽线虫良好的自由基清除及氧化胁迫抗性的生物活性基础上,研究了菌菇复合多糖的抗衰老活性。 首先观察了FHP 对N2 线虫生存曲线的影响, 结果如图6a 所示。与对照组相比,FHP 处理组线虫的生存曲线没有明显差异, 即便是抗氧化效果最好的质量浓度组(0.1 mg/mL 的FHP 处理组)也并未延长秀丽线虫的寿命。
与此同时, 检测了FHP 对N2 线虫体内可间接反映衰老进程的脂褐素积累水平的影响。 根据脂褐素的光学性质, 结合秀丽线虫通体透明的特点, 采用荧光酶标仪法定量分析线虫体内的脂褐素,结果如图6b 所示。与对照组相比,FHP 的处理未显著影响线虫体内脂褐素的积累水平, 即FHP未延缓N2 线虫的衰老进程。 综上,菌菇复合多糖虽具有较好的抗氧化效果, 但未表现出延缓秀丽线虫衰老的抗衰老活性。
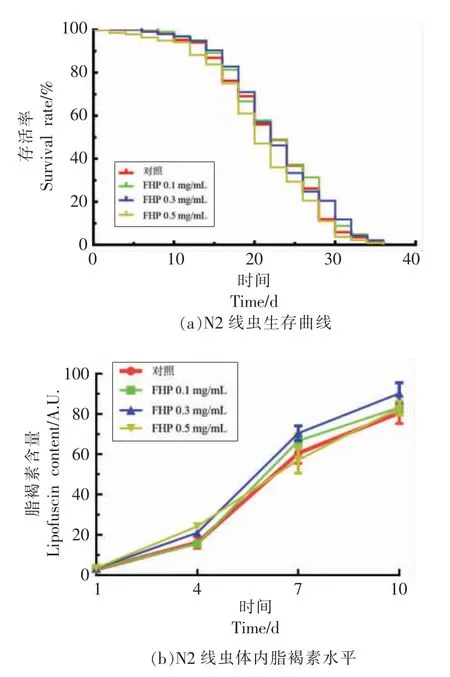
图6 菌菇复合多糖对N2 线虫衰老的影响Fig.6 Effects of FHP on the senescence of N2 nematodes
3 讨论与结论
近年来,复合多糖的研究表明,不同的生物活性多糖之间的协同效应往往会获得优于单一多糖的活性效果[16,25]。 菌菇多糖作为“生物应答调节剂”,目前的应用更多偏向于单一应用。 探究菌菇复合多糖的生物活性及机制有利于菌菇多糖的高效利用及开发。
本研究结果表明:由香菇多糖、滑子菇多糖和栗蘑多糖组成的菌菇复合多糖(FHP)较单一组成多糖具有更好的体外自由基清除效率和延长秀丽线虫氧化胁迫存活率的协同抗氧化效果。 其增强秀丽线虫体内氧化胁迫抗性的作用机制与其降低线虫体内ROS 水平及MDA 含量等氧化胁迫水平, 激活胁迫应激关键转录因子SKN-1 和DAF-16 的活性及其下游效应基因表达和增强抗氧化酶活性相关。 FHP 的抗氧化效果与质量浓度存在负相关性,即在较低质量浓度处理时,FHP 的抗氧化效果好。 推测可能与粗多糖没有进一步纯化以及多糖质量浓度过高影响细胞渗透压相关。 以后还需对复合多糖的纯化做进一步研究。此外,研究结果还表明, 虽然FHP 具有较好的抗氧化活性,但是其对秀丽线虫的衰老并无明显影响, 这可能与其对胰岛素信号通路中与衰老相关的DAF-16的调控力度不够有关,后期需继续探索。此结果与竹荪多糖[18]和淫羊藿多糖[26]的研究结果相一致,即虽然具有良好的体内抗氧化及自由基清除活性,但是竹荪多糖和淫羊藿多糖同样不能延缓秀丽线虫的衰老,未表现出抗衰老活性。 同样,生育酚[27]虽具有强大的抗氧化能力, 但其对模式生物寿命的影响不明显。 这表明寿命调节和应激响应存在更复杂的机制。
综上所述,菌菇复合多糖FHP 具有良好的协同增效的体内外抗氧化活性, 不具备明显的抗衰老活性。 其增强秀丽线虫氧化胁迫抗性的作用机制与其激活胁迫应激转录因子SKN-1 和DAF-16,影响其下游效应体活性有关。研究结果为菌菇多糖的高效利用及复合多糖的深入开发提供了理论依据。

