超声波协同马克思克鲁维酵母Z17胞内粗酶处理降低乳清蛋白的致敏性
舒 琴, 赵文俊, 刘思宇, 何国庆, 陈启和
(浙江大学食品科学与营养系 杭州310058)
乳清是酪蛋白凝结后牛乳中剩下的液体成分,是奶酪制作中产生的副产物。全球每年乳清产量约为1.8 亿~1.9 亿t[1],每年增长约2%[2]。 过去,乳清被视为废品而排入河流, 因乳清中有机物含量高, 化学需氧量 (Chemical oxygen demand,COD)50~102 g/L, 生物需氧量(Biological oxygen demand, BOD)27~60 g/L[3-4],故对生态系统构成危害。随着奶酪类产品的增加,乳清引起的环境问题日益严重。为了解决乳清的处置问题,生产者将乳清分离,并加以利用。从乳清中分离出的多种球状蛋白质总称为乳清蛋白,占牛乳总蛋白的20%[5]。 乳清蛋白中约含65%的β-乳球蛋白 (Beta-lactoglobulin, β-LG),25%的α-乳白蛋白 (Alphalactalbumin, α-LA),8%的牛血清白蛋白(Bovine serum albumin, BSA) 以及少量的免疫球蛋白(Immunoglobulin, Igs)、 乳铁蛋白(Lactoferrin,Lf)、乳过氧化物酶(Lactoperoxidase, Lp)和糖巨肽(Glymacropeptide, GMP)等,这些蛋白质具有特定的功能、生理和营养特性[6]。
食物过敏是全球主要的公共卫生问题。 据估计, 食物过敏影响约1%~2%的成年人和5%~8%的3 岁以下儿童[7-9]。 牛乳是联合国粮农组织(FAO)认定的8 种主要过敏食物之一,由牛乳引起的过敏症状威胁着婴幼儿的健康, 严重时甚至会导致死亡。 牛乳蛋白过敏 (Cows milk protein allergy, CMPA)在临床中是由一种或多种乳蛋白引起的免疫反应, 包括IgE 介导的和非IgE 介导的免疫反应,是婴幼儿中最常见的过敏症[10],它影响全球1.9%~4.9%的婴儿[11],0.6%~2.5%的学龄前儿童,0.3%的5~16 岁的青少年,以及小于0.5%的成年人[12-13]。
物理、化学及生物等不同的食品加工方式,包括热、高压、辐射、超声和生物化学方法被用于致敏蛋白的改性以降低牛乳蛋白的致敏性[14-15]。发酵作为一种微生物加工过程[16],自埃及文明开始,便是保存食物(尤其是牛乳和水果)的古老加工技术[17]。 马克思克鲁维酵母 (Kluyveromyces marxianus)在酒精、酸奶和奶酪的发酵过程中多次被发现[18]。Li 等[19]发现马克思克鲁维酵母可以发酵乳清蛋白产生血管紧张素转换酶(ACE)抑制肽。 此外,超声波也是常见的蛋白改性的处理方式, 由于压缩和扩张作用, 导致食品体系内剧烈震动并形成气泡,这些气泡在达到临界尺寸时发生爆炸,局部区域的温度和压力可能高达5 000 K 和101.325 MPa, 局部范围内的极端条件导致蛋白质过敏原的结构发生变化[20]。
本文以α-LA 和β-LG 为抗原性表征,研究超声波协同马克思克鲁维酵母胞内酶系降低乳清蛋白致敏性的最优酶解条件, 探讨加工过程中乳清蛋白构象的变化机理, 为低致敏乳清蛋白产品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂 马克思克鲁维酵母Z17,中国普通微生物菌种保藏管理中心; 乳清浓缩蛋白WPC 80,新西兰恒天然集团有限公司;0.22 μm 微孔滤膜,阿拉丁科技(中国)公司;截留分子质量5 000 u 的透析袋, 北京索莱宝科技有限公司;偶氮酪蛋白、N,N-二甲基甲酰胺 (dmf)、N-苯甲酰基-L-酪氨酸-对硝基苯胺 (NBTpNA)、L-赖氨酸对硝基苯胺二氢溴酸盐(Lys-pNA),西格玛集团有限公司;木瓜蛋白酶(≥3 U/mg),上海麦克林生化科技有限公司;其余试剂均为分析纯级。
1.1.2 仪器设备 ZQLY-300 振荡培养箱, 上海知楚仪器有限公司;超净工作台,苏州净化公司;MLS-3750 立式高压灭菌锅,日本三洋公司;5418高速冷冻离心机,Eppendorf 公司;ZYCGF 常规分析型超纯水机, 宁波优普有限公司;J-1500-150S圆二色谱仪,日本JASCO 公司;SCIENTZ JY92 -ⅡD 超声波细胞粉碎机,宁波新芝生物科技有限公司;JB-5A 磁力搅拌器,常州市伟嘉仪器制造有限公司。
1.2 试验方法
1.2.1 粗酶制备 配置含有0.05 g/mL WPC 和0.04 g/100 mL 乳糖的发酵培养基,108 ℃、15 min灭菌处理。活化后的马克思克鲁维酵母按1%的接种量接种于发酵培养基中,置于摇床中30 ℃、150 r/min 培养。 30 h 后,马克思克鲁维酵母生长至对数期, 将发酵液以12 000 r/min 离心10 min,用0.22 μm 微孔滤膜将上清液进行过滤, 所得液体即为胞外酶液。将沉淀用蒸馏水清洗两次,再次离心,将菌体悬浮于50 mmol/L pH 7.5 Tris-HCl 缓冲液中(内含1 mmol/L 二硫苏糖醇),冰浴中超声波破碎(300 W,工作5 s,间隔15 s,全程10 min),4 ℃、10 000 r/min 下离心10 min, 收集上清液,所得液体即为胞内酶液。
取100 mL 酶液加入硫酸铵达到20%饱和度,离心除去沉淀后加入硫酸铵使饱和度到达60%,离心弃上清, 将沉淀装入透析袋, 磁力搅拌下用10 mL 10 mmol/L pH 6.4 的PBS 缓冲液透析60 h,即可分别得到分离纯化后的胞内、胞外粗酶溶液,冻干得到胞内、胞外粗酶晶体。
1.2.2 蛋白酶活性测定 通过消化偶氮酪蛋白测量蛋白水解活性[21]。 反应系统组成为:400 μL 1.25%偶氮酪蛋白(溶于100 mmol/L pH 7.0 磷酸盐缓冲液)和100 μL 无细胞酶液,混匀后37 ℃反应60 min,加入500 μL 10%三氯乙酸(TCA)终止反应,10 000 r/min 离心10 min,取100 μL 上清液与100 μL 0.1 mol/L NaOH 混匀, 测定波长440 nm 处吸光度。 试验重复3 次, 将10 mmol/L pH 6.4 PBS 缓冲液替代酶液作为空白对照。 在测定条件下与空白对照相比每分钟吸光度增加0.1 所需的酶量定义为1 个酶活力单位(U)。
1.2.3 氨肽酶和羧肽酶活性测定 分别采用LyspNA 和NBTpNA 作为底物测定氨肽酶和羧肽酶活性[22]。 Lys-pNA 和NBTpNA 分别溶于蒸馏水和N,N-二甲基甲酸胺(DMF)配制成20 mmol/L 底物溶液。 酶反应体系总体积为1 mL, 包括850 μL 100 mmol/L pH 7.5 Tris-HCl 缓冲液,50 μL 20 mmol/L 底物溶液和100 μL 无细胞酶液。 各组分混匀后37 ℃反应10 min,然后加入0.5 mL 1 mol/L HCl 终止反应, 混合物10 000 r/min 离心10 min,取上清测量波长410 nm 吸光度,吸光度通过对硝基苯胺(p-Nitroaniline)标准曲线换算得到酶反应所释放对硝基苯胺的量。 在测定条件下与每分钟生成1 μmol 对硝基苯胺所需的酶量定义为1个酶活力单位(U)。
1.3 酶解条件优化
1.3.1 单因素实验 通过对胞内、 胞外酶活性的测定, 可以判断马克思克鲁维酵母水解转化乳清蛋白的主要酶系存在于胞内或胞外。在此基础上,通过单因素实验来确定各个条件对酶解效果的影响。酶解反应物为:0.2 mL 乳清蛋白液(5%)和0.2 mL(1%)酶液,其余各条件设置如表1,反应结束后测定蛋白质水解度。
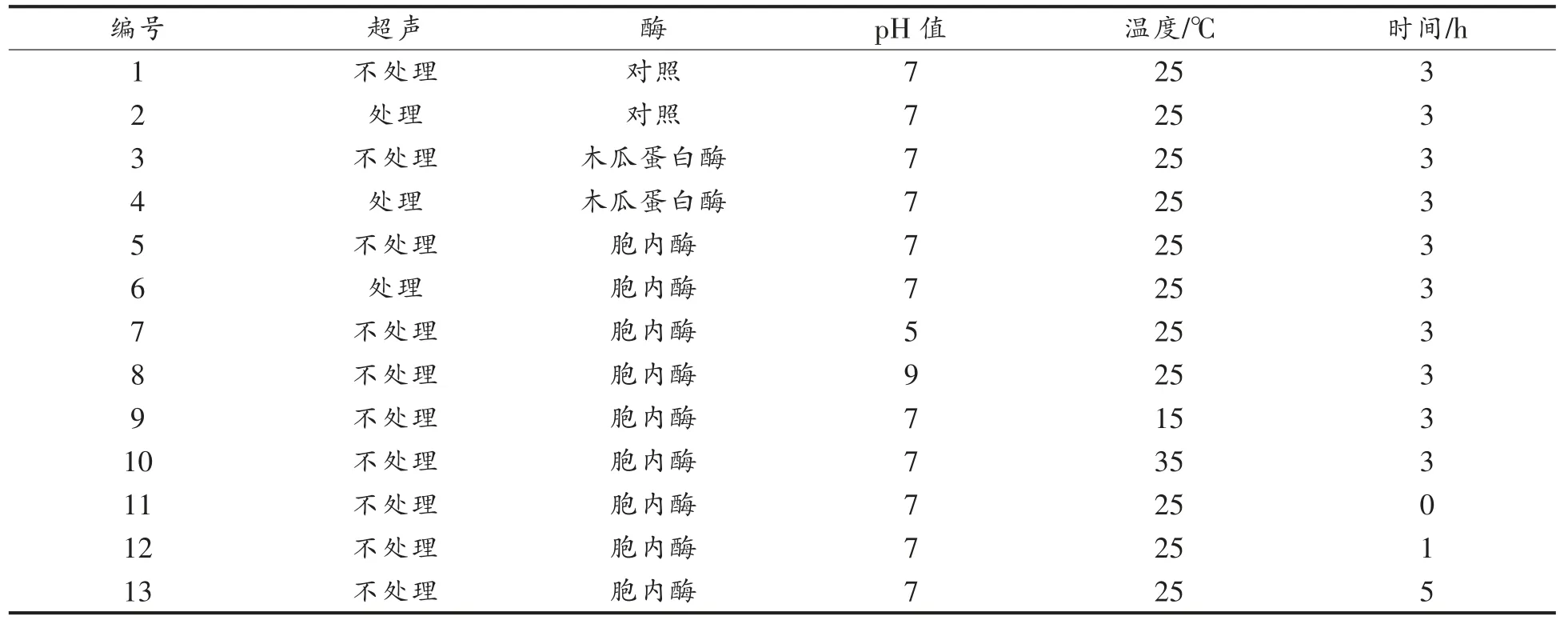
表1 酶解条件单因素实验设计Table 1 Single factor experimental design of enzymatic hydrolysis conditions
1.3.2 响应曲面法试验 在单因素实验的基础上,采用Design Expert (Version10.0.4.0)设计四因素三水平的中心组合设计 (Central Composite DESIGN,CD)试验考察不同酶解条件对乳清蛋白致敏性的影响。 试验变量为超声间歇时间(X1),超声功率(X2),初始pH 值(X3),酶解温度(X4)为试验因素,以蛋白质水解度和致敏性(以α-LA 和β-LG 的抗原性表征)降低率为响应值进行试验。 每个因素选3 个水平,以(-1,0,1)编码,各因素编码值和实际值如表2 所示,CCD 试验设计如表3 所示。 试验结果进行方差分析后对试验数据进行二次回归拟合,采用下列二次多项式描述响应量(应变量)和自变量关系的经验模型:
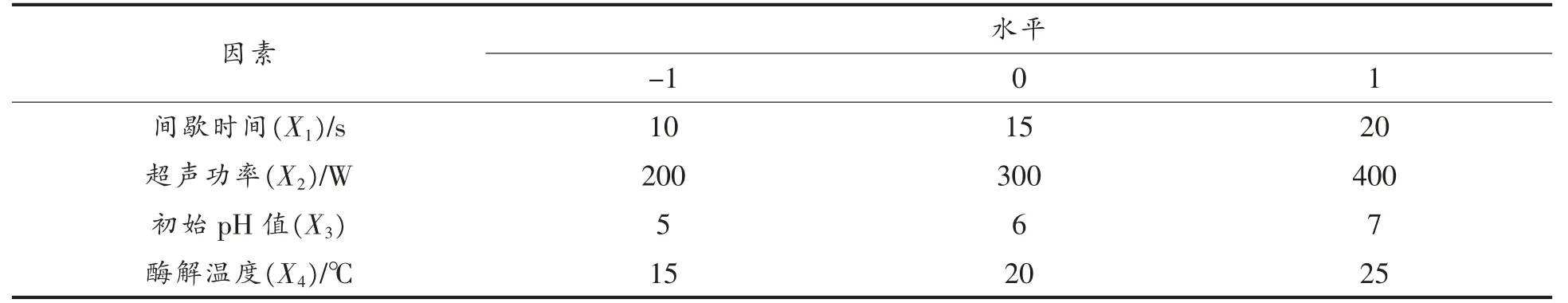
表2 CCD 试验设计因素水平及编码Table 2 Factor level and coding of CCD experiment
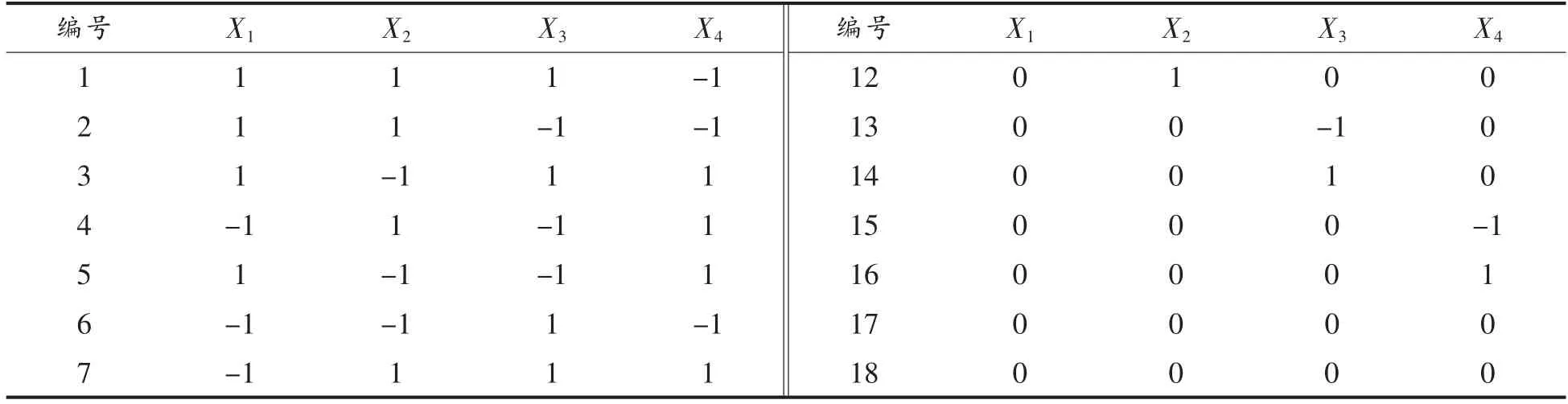
表3 CCD 试验设计Table 3 Design of CCD experiment
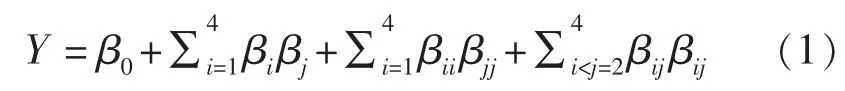
式中,Y——预测响应值(蛋白质水解度、致敏性抑制率);β0——常数项;βi——一次项系数;βii和βij——二次项系数。

(续表3)
1.3.3 邻苯二甲醛法测定蛋白质水解度 在超声处理后的的乳清蛋白样品中加入5 000 U/mL 木瓜蛋白酶,37 ℃下反应30 min 后, 根据Spellman等[23]描述的方法,采用邻苯二甲醛(OPA)法测定样品的水解度。 以L-丝氨酸溶液(0.1 g/L)作为标准品。 取400 μL 待测样品加入到盛有3 mL OPA 溶液的试管中,振荡混匀5 s,避光反应2 min,以去离子水作为空白对照。 用紫外分光光度计测量样品在340 nm 处的吸光值。 OPA 指数定义为:用OPA 法测量波长340 nm 吸光度的差值所对应于标准曲线丝氨酸的量(mg/mL),用于表示蛋白质的水解程度。
1.3.4 酶联免疫法测定产物致敏性 根据酶联免疫吸附法原理[24]测定样品中β-LG 以及α-LA 的含量。 将样品稀释至1 mg/mL,利用β-LG 以及α-LA 试剂盒检测样品中两种蛋白的含量。
1.4 数据处理
每个试验重复3 次。使用Excel 2016、Origin 95、SPSS Statistics 22、Design Expert 10 对数据进行处理,显著水平设定为P <0.05。
2 结果与讨论
2.1 胞内、胞外粗酶的活性
已有文献表明可以从马克斯克鲁维酵母的细胞内、外提取出能水解蛋白质的酶。 Foukis 等[25]从马克斯克鲁维酵母IFO 0288 培养物中纯化了分子质量约为45 ku 的胞外水解酶KM-IFO-0288-A,在温度10~60 ℃、pH 6.00~10.25 范围内具有较高活性。Ramírez-Zavala 等[26]从分离自牛乳中的马克思克鲁维酵母中纯化了分子质量约为46 ku 的赖氨酸氨肽酶,最佳pH 值为7.0,最佳温度为45℃。 本研究测定了从马克思克鲁维酵母Z17 发酵液中分离出的胞内和胞外粗酶中的蛋白酶、 氨肽酶、羧肽酶活性。 结果如图1 所示,马克思克鲁维酵母Z17 胞内粗酶有蛋白酶、 氨肽酶和羧肽酶活性,而胞外粗酶均不具有。由此可见,蛋白质、多肽的水解是胞内酶系起作用, 因此选择胞内粗酶作进一步研究。
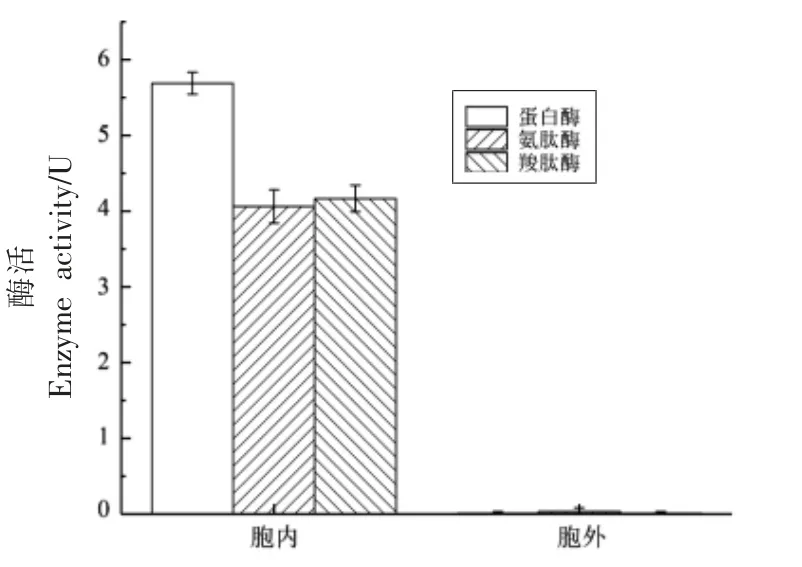
图1 胞内及胞外蛋白酶、氨肽酶、羧肽酶活性Fig.1 Activities of intracellular and extracellular protease, aminopeptidase and carboxypeptidase
2.2 不同因素对乳清蛋白水解度的影响
通过单因素实验研究不同因素对胞内粗酶水解乳清蛋白的影响,结果见图2,由试验组1、2 可知,超声处理不会改变乳清蛋白中丝氨酸含量,不会对蛋白质水解度产生直接影响; 由试验组3、4及5、6 可知, 超声处理可以促进木瓜蛋白酶及马克思克鲁维酵母Z17 胞内酶对乳清蛋白的水解;由试验组5、7、8 可知, 发酵初始pH 值在5 左右时比pH 值为7、9 时酶解能力更强; 由试验组5、9、10 可知,发酵温度为15 ℃时,相比25 ℃和35℃时酶解能力更强; 由试验组5、11、12、13 可知,在0~3 h 之间随着酶解时间延长, 蛋白质水解度逐渐增大,3~5 h 之间变化不显著。因此,可以选择超声间歇时间、超声功率、初始pH 值和酶解温度为试验因素进一步研究最优的超声-酶解条件。
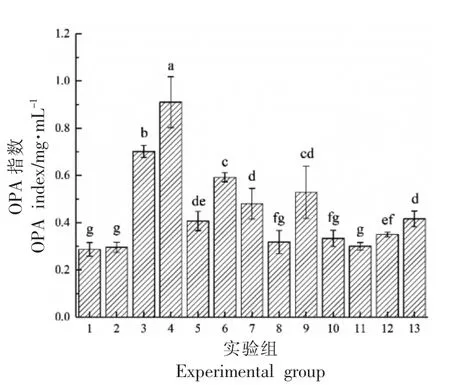
图2 单因素实验结果Fig.2 Results of single factor experiment
2.3 响应面法优化结果
采用RSM 优化降低乳清蛋白抗原性的超声-酶解工艺条件,基于对试验结果的统计分析,采用二次模型描述蛋白质水解度、α-LA 以及β-LG 致敏性降低率和不同发酵工艺条件:超声间歇时间、超声功率、初始pH 值、酶解温度之间的关系(式2~4,式中各变量均为实际值)。Y1、Y2、Y3分别为蛋白质水解度、α-LA 抗原性降低率和β-LG 抗原性降低率的预测值,X1、X2、X3、X4分别为超声间歇时间、超声功率、初始pH 值、酶解温度的实际值。
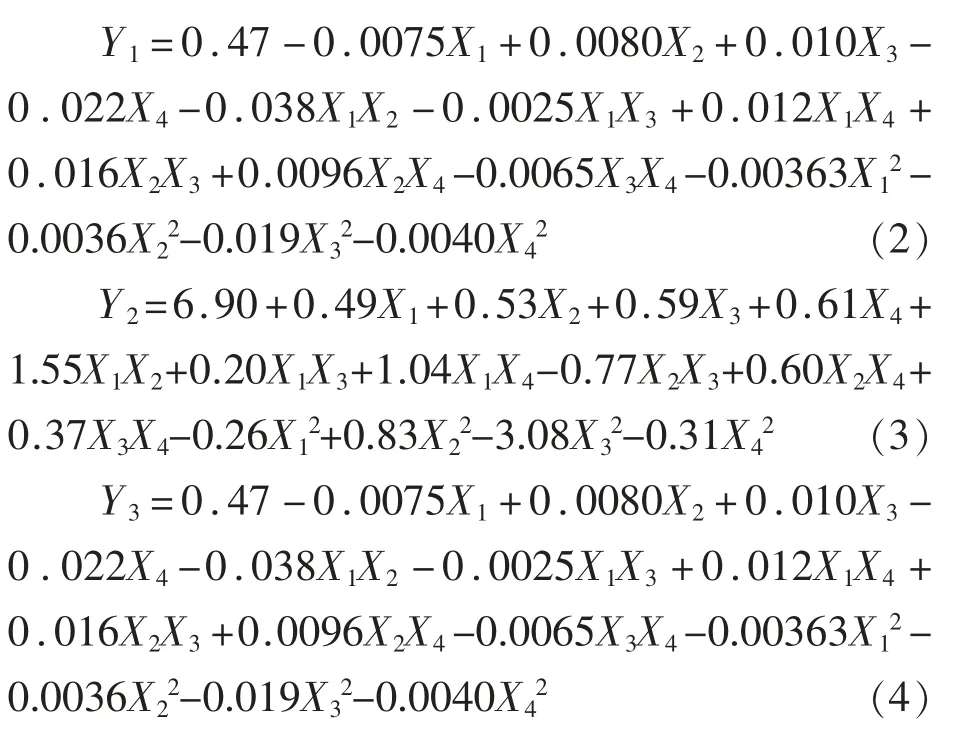
2.3.1 蛋白质水解度响应面优化分析结果 蛋白质水解度模型系数显著性检验结果表明 (表4),该模型极显著(P<0.01),失拟项(P=0.2510)不显著,表明模型与试验结果拟合较好。采用方差分析对模型方程的适用性进行了评价(表5),结果表明,试验模型拟合较好,适合于预测响应值蛋白质水解度。 预测值与实测值之间具有高度的相关性(相关系数R2=0.9523), 表明95.23%试验结果的实际值与模型预测值对应, 有4.77%的变异不能被该模型解释(校正系数RAdj2=0.8411)。 变异系数(CV=2.28%)值较低表明试验结果的可靠性较高。
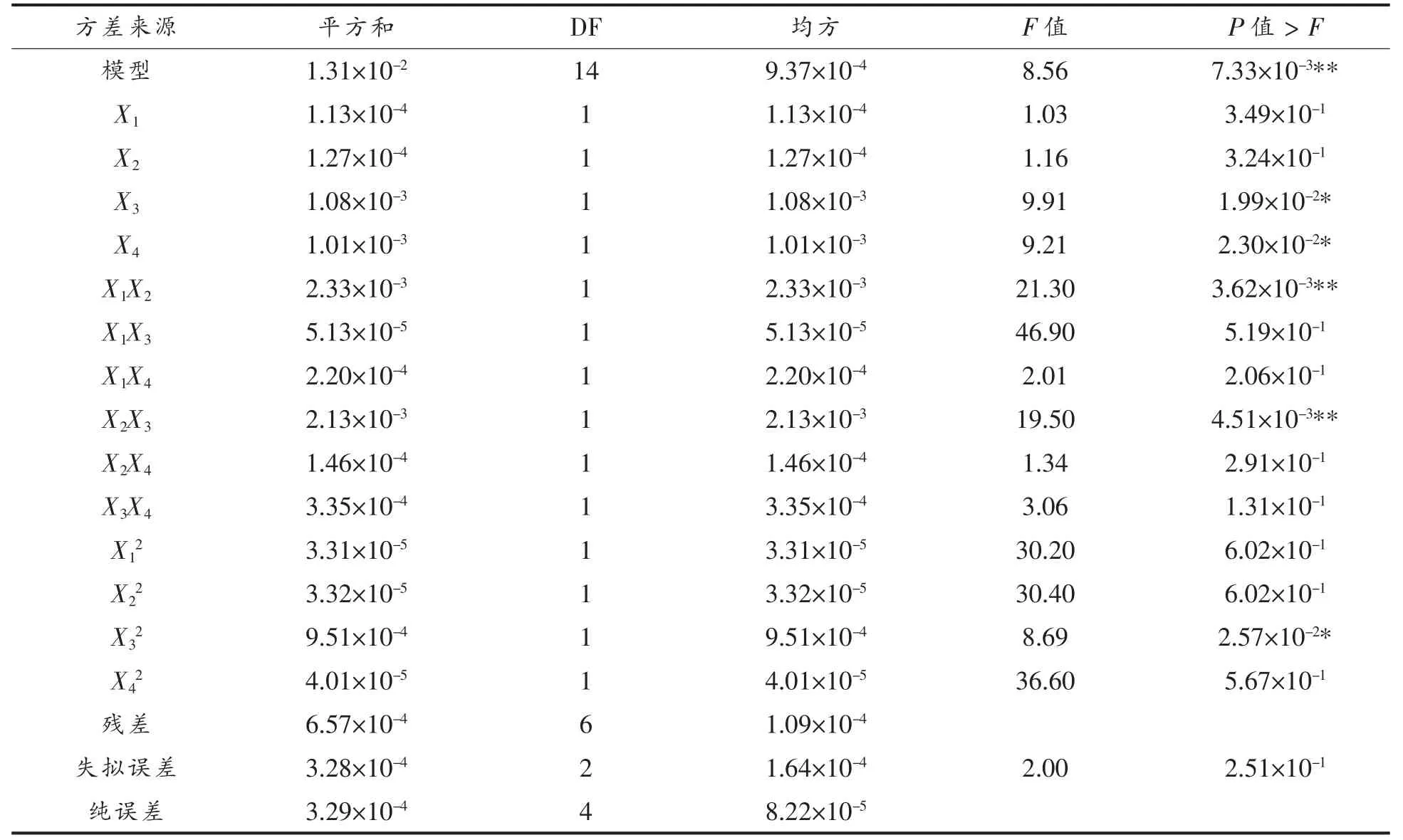
表4 蛋白质水解度响应面二次系数显著性检验Table 4 Response surface fitting quadratic coefficient significance test of protein hydrolysis

表5 蛋白质水解度响应面二次模型的方差分析Table 5 Analysis of variance of quadratic model of response surface experiment for protein hydrolysis degree
由模型方程的回归系数显著性检验(表4)可知,试验中初始pH 值(X3)、酶解温度(X4)对蛋白质水解度线性效应显著(P<0.05),初始pH 值(X3)二次项的P 值小于0.05, 说明对响应值的曲面效应显著,而超声间歇时间(X1)、超声功率(X2)线性效应不显著(P 均大于0.05),超声间歇时间(X1)、超声功率(X2)、酶解温度(X4)二次项的P 值均大于0.05,说明对响应值的曲面效应不显著。蛋白质水解度受酶活性影响,而初始pH 值、酶解温度能够对酶的活性造成直接的影响。 在试验的温度范围内,初始pH 值从5 逐渐增加到7,温度从15 ℃逐渐增加至25 ℃,水解度均呈现先升高后降低的趋势,酶解温度(X4)的一次项回归系数(-0.022)在4 个因素中绝对值最大, 表明在试验范围内温度对响应值的影响最大, 这可能归因于温度增加提高了酶的活性,从而促进了蛋白水解。
参数间的交互效应也会对响应值蛋白质水解度产生影响,超声间歇时间(X1)与超声功率(X2)、超声功率(X2)与初始pH 值(X3)交互作用对响应值的曲面效应影响极显著((P <0.01)。 如图3 所示,在试验范围内,当超声间歇时间和超声功率、超声功率与初始pH 值向最优点增加时, 蛋白质水解度显著增加,通过最优点后继续增加,蛋白质水解度则显著降低。
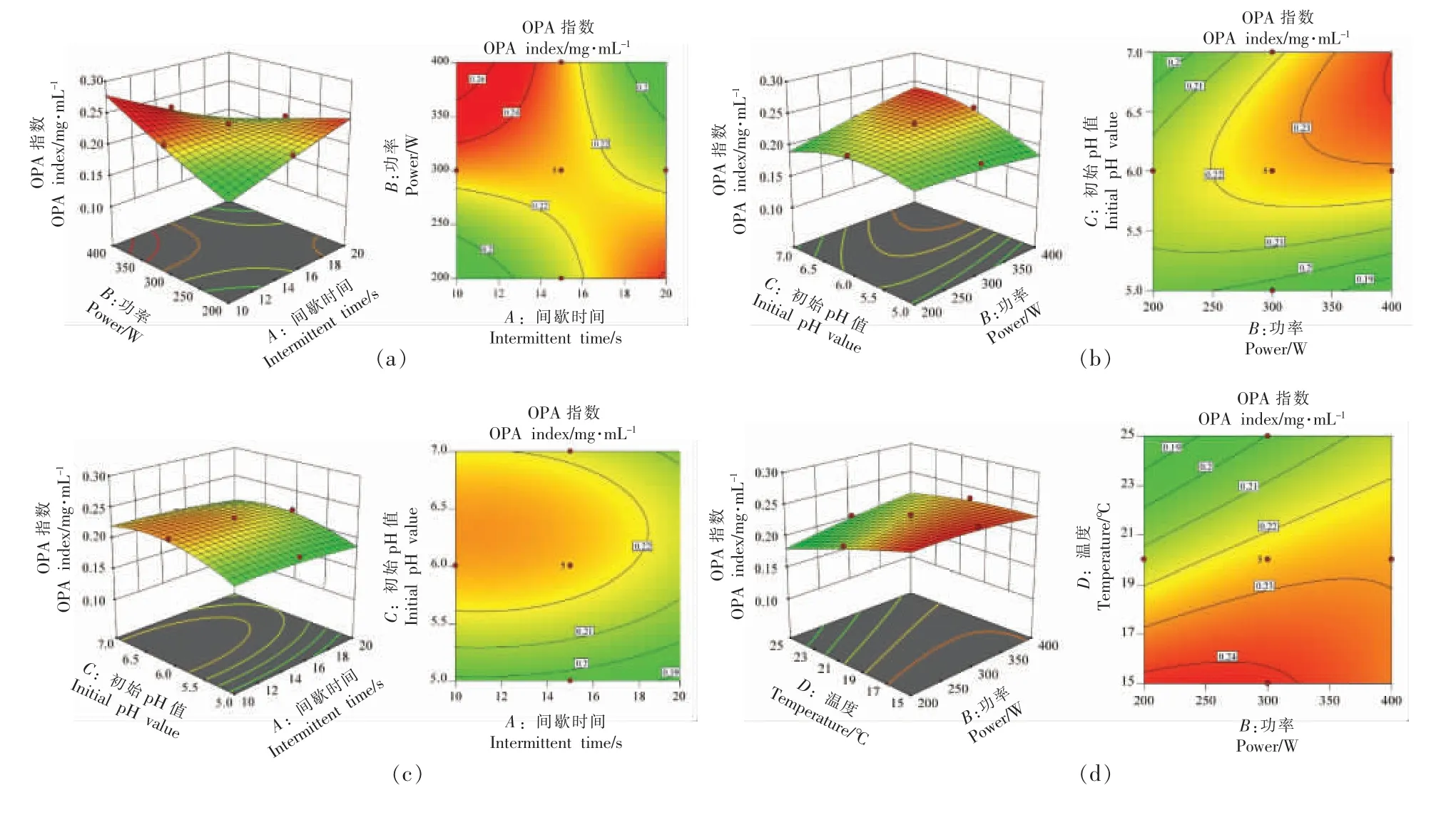

图3 交互作用对蛋白质水解度影响的三维曲面图Fig.3 3D surface plots of interaction effect on proteins hydrolysis degree
2.3.2 α-LA 抗原性降低率的响应面优化分析结果 α-LA 抗原性降低率模型系数显著性检验结果表明(表6),该模型极显著(P<0.01),失拟项(P=0.2874)不显著,表明模型与试验结果拟合较好。采用方差分析对模型方程的适用性进行了评价(表7),结果表明,试验模型拟合较好,适合于预测响应值α-LA 抗原性的降低率。 预测值与实测值之间具有高度的相关性(相关系数R2=0.9872),表明98.72%试验结果的实际值与模型预测值对应,只有1.28%的变异不能被该模型解释(校正系数RAdj2=0.9574)。 变异系数(CV=6.88%)值较低表明试验结果的可靠性较高。
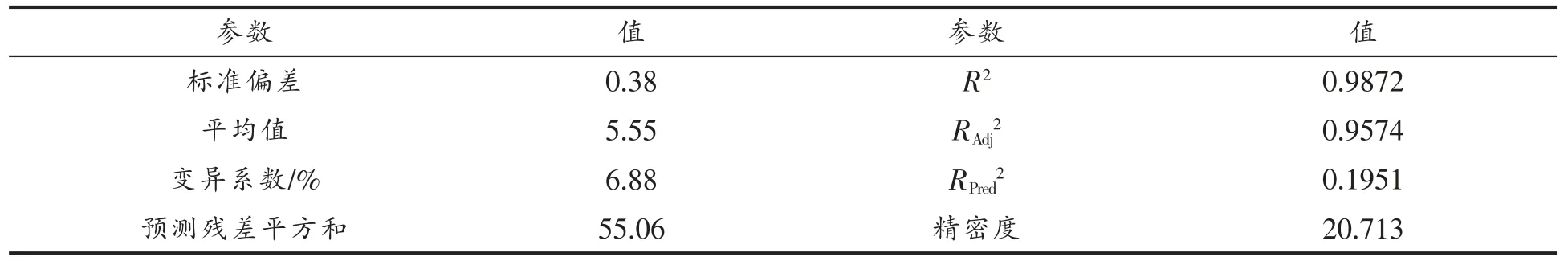
表7 α-LA 抗原性降低率降低率响应面二次模型的方差分析Table 7 Analysis of variance of quadratic model of response surface experiment for α-LA antigenicity reduction rate
由模型方程的回归系数显著性检验(表6)可知,试验中初始pH 值(X3)及其二次项的P 值均小于0.01, 说明初始pH 值对响应值的线性和曲面效应极显著;超声功率(X2)二次项的P 值小于0.01,说明超声功率对响应值的曲面效应显著;而超声间歇时间(X1)、超声功率(X2)、酶解温度(X4)线性效应不显著,超声间歇时间(X1)、酶解温度(X4)曲面效应不显著(P 值均大于0.05)。
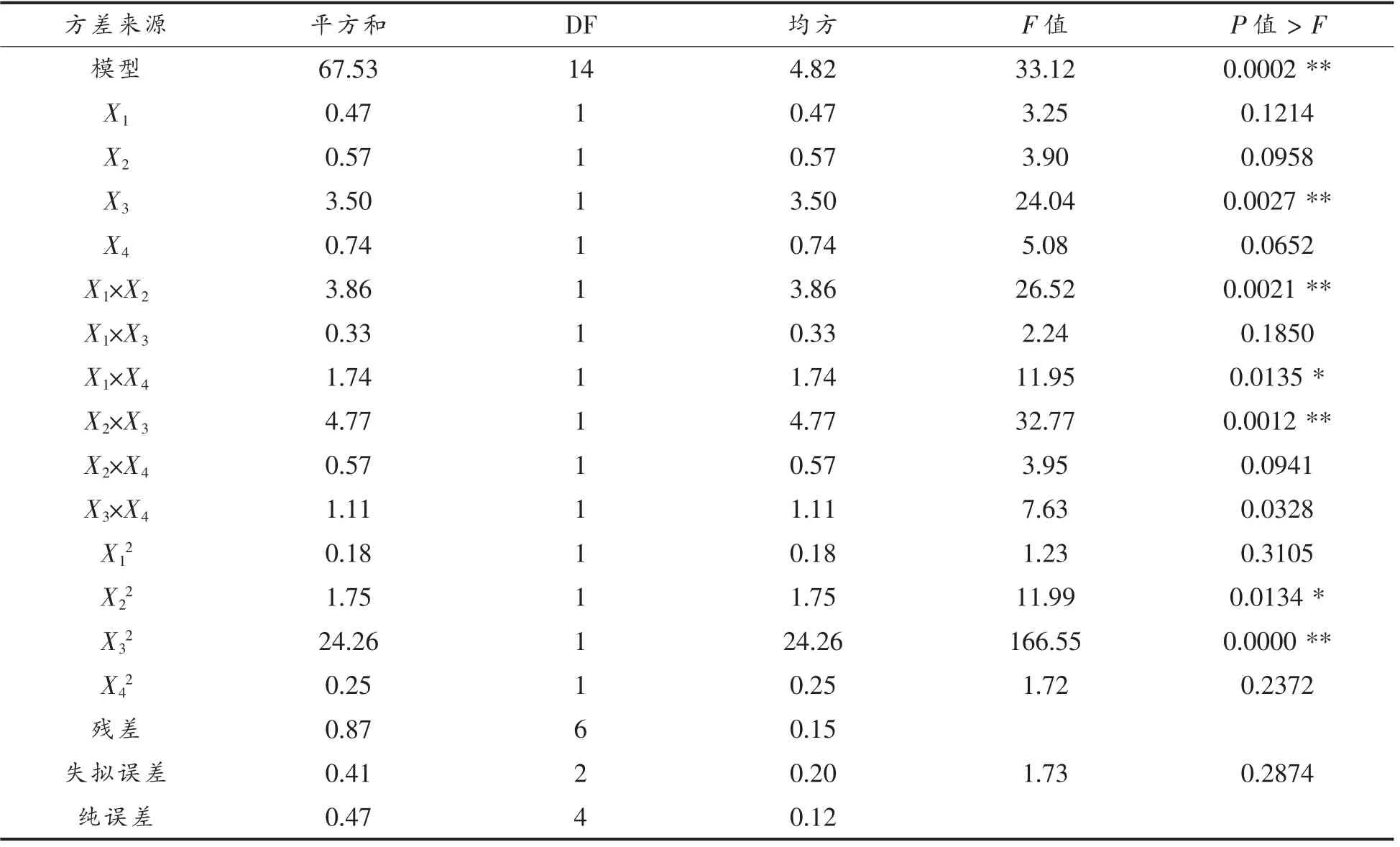
表6 α-LA 抗原性降低率响应面二次系数显著性检验Table 6 Response surface fitting quadratic coefficient significance test of α-LA antigenicity reduction rate
超声间歇时间(X1)和超声功率(X2)之间、超声功率(X2)和初始pH 值(X3)的相互作用对α-LA抗原性降低有极显著影响(P<0.01),超声间歇时间(X1)和酶解温度(X4)对α-LA 抗原性降低有显著影响(P<0.05)。 如图4 所示,在试验范围内,当超声间歇时间、超声功率、初始pH 值、酶解温度向最优点增加时,α-LA 抗原性显著降低; 通过最优点后继续增加,α-LA 抗原性升高。
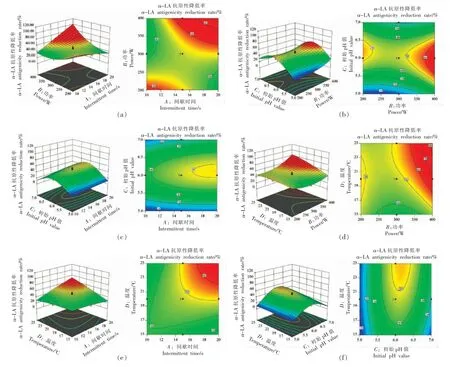
图4 交互作用对α-LA 抗原性降低率影响的三维曲面图Fig.4 3D surface plots of interaction effect on α-LA antigenicity reduction rate
2.3.3 β-LG 抗原性降低率响应面优化分析结果
β-LG 抗原性降低率模型系数显著性检验结果表明(表8),该模型极显著(P<0.01),失拟项(P=0.4696)不显著,表明模型与试验结果拟合较好。采用方差分析对模型方程的适用性进行了评价(表9),结果表明试验模型拟合较好,适合于预测响应值β-LG 抗原性降低率。 预测值与实测值之间具有较高的相关性(相关系数R2=0.9851),表明98.51%试验结果的实际值与模型预测值对应,有1.49%的变异不能被该模型解释(校正系数RAdj2=0.9504)。变异系数(CV=6.47%)值较低表明试验结果的可靠性较高。

表9 β-LG 抗原性降低率响应面二次模型的方差分析Table 9 Analysis of variance of quadratic model of response surface experiment for β-LG antigenicity reduction rate
由模型方程的回归系数显著性检验(表8)可知,试验中初始pH 值(X3)及其二次项P 值均小于0.05,说明初始pH 值对β-LG 抗原性降低率的线性及曲面效应显著;超声间歇时间(X1)和酶解温度(X4)的二次项的P 值均小于0.01,说明对响应值的曲面效应极显著。 超声功率(X2)及其二次项的P 值均大于0.05,说明对响应值的影响不显著。
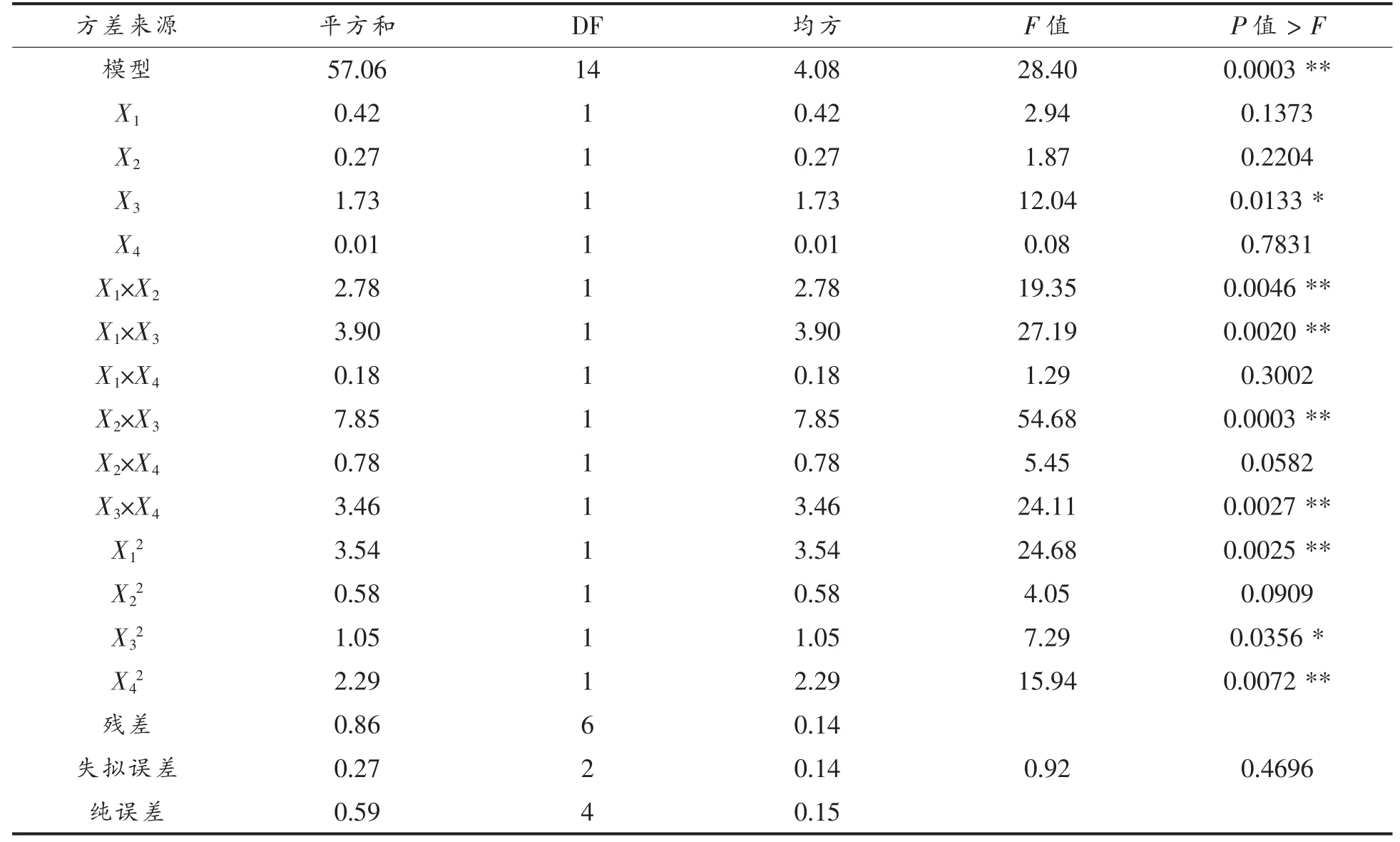
表8 β-LG 抗原性降低率响应面二次系数显著性检验Table 8 Response surface fitting quadratic coefficient significance test of β-LG antigenicity reduction rate
超声间歇时间(X1)和超声功率(X2)、超声间歇时间(X1)和初始pH 值(X3)、初始pH 值(X3)和酶解温度(X4)间的交互效应对响应值β-LG 抗原性降低率影响极显著(P<0.01)。 如图5 所示,在试验范围内,当超声间歇时间、超声功率、初始pH 值和酶解温度向最优点增加时,β-LG 抗原性显著降低, 通过最优点后继续增加时,β-LG 抗原性则显著升高。

图5 交互作用对β-LG 抗原性降低率影响的三维曲面图Fig.5 3D surface plots of interaction effect on β-LG antigenicity reduction rate
2.3.4 优化结果验证 为了获得马克思克鲁维酵母Z17 胞内酶水解乳清蛋白的最优酶解条件,即使得蛋白质水解度、α-LA 抗原性降低率和β-LG抗原性降低率协同达到最大值时的超声-酶解条件, 利用Design Expert 软件对模型方程求解,得到曲面的极值点即α-LA 抗原性、β-LG 抗原性降低率的最大值分别为65.56%和57.96%时,对应的超声间歇时间为16 s,功率为400 W,初始pH 值为6.16,酶解温度为18.48 ℃。 按照模型预测极值点的条件进行验证性试验, 结果和预测值吻合较好,说明该模型能较准确地预测实际情况。
3 结论
以超声预处理的乳清蛋白为酶解底物, 研究马克思克鲁维酵母Z17 粗酶转化乳清蛋白的主要酶解条件。 经提取、 分离得到马克思克鲁维酵母Z17 的胞内、胞外粗酶,测定后发现胞内粗酶具有蛋白酶、氨肽酶和羧肽酶活性,而胞外粗酶不具有以上活性。为了研究胞内粗酶系水解乳清蛋白、降低乳清蛋白致敏性(以α-LA 和β-LG 的抗原性表征)的最优超声预处理-酶解条件,设计了四因素三水平的CCD 试验,发现乳清蛋白水解度受初始pH 值、酶解温度影响显著,α-LA、β-LG 抗原性受初始pH 值影响显著, 超声间歇时间和超声功率的交互作用对α-LA、β-LG 抗原性影响也显著。通过对模型方程求解得到最优条件: 超声间歇时间16 s,超声功率400 W,初始pH 6.16,酶解温度18.48 ℃时,预测α-LA 抗原性、β-LG 抗原性的降低率达到最大,分别为65.56%和57.96%。

