基于肠-脑对话的食物奖赏在肥胖中的作用
付王威, 姚于飞, 王蕊艳, 吴睿婷, 万 敏, 李文娟*
(1 南昌大学 食品科学与技术国家重点实验室 南昌330047 2 江西中医药大学附属医院 南昌330006 3 江西省儿童医院 南昌330006)
饮食种类多样化、 食物获取方便、 能量密度高、 人们的生活方式趋向于长期静坐的低能耗状态等导致肥胖迅速蔓延[1]。 2019年《世界粮食安全和营养状况》报告显示,全球罹患肥胖症的人群超过6.7 亿[2]。 研究已证实,肥胖是癌症、心血管疾病、II 型糖尿病等慢性疾病发病及致死的主要诱因和共同病理基础, 现成为世界重大公共卫生问题之一, 其内在分子机制及应对策略研究亟待突破[3-4]。面对肥胖,目前的防治策略多集中于饮食控制和体能锻炼, 忽略了食物奖赏对健康体重维系的影响。食物奖赏表现为对食物的喜爱,尤其是面对美食,人体可通过食物奖赏效应,使得机体不论饥饿与否,有意识地发生过度摄食行为,产生能量过剩。近几年的研究发现,脑肠肽、瘦素、胰岛素和肠道微生物菌群可直接或间接地通过肠-脑对话影响机体的食物奖赏效应, 在肥胖进程中起重要作用[5-7]。本综述旨在分析肠-脑对话和食物奖赏之间的关联性, 探讨它们在肥胖中的重要作用及可能机制,以期为肥胖防治研究拓展思路。
1 肥胖与食物奖赏
食物是一种自然馈赠, 对人类的生命和健康至关重要。 研究已证实食物摄入的能量大于消耗会导致肥胖,涉及机制复杂,与生物遗传、心理及环境密切相关, 其中食物奖赏在肥胖的发生及进程中扮演着重要角色[8]。食物奖赏体现为对食物的青睐, 主要涵盖3 个核心环节:“进食的动机(wanting)”、“进食的愉悦与享受(liking)”以及“进食的认知, 信息的联结与强化 (learning & reinforcement)”,每个环节都有相应的神经通路表征。过去,在频繁饥荒的食物供给不足的年代,食物奖赏产生的摄食驱动与进食后的反馈, 允许机体在食物供给充足时大量进食,且不受饱腹感的影响,最大程度地存储食物,以度过食物不足/匮乏的艰难时期, 食物奖赏对人类的生存与繁衍起至关重要的作用[9]。 当下,食物供给的富余及食品精加工的升级,使得在更易获取食物的同时,其美味性和能量密度均大幅度提升, 这极大地增加了机体膳食摄入过剩的概率,介导体重增加及肥胖。一般情况下,由于食物奖赏的作用,机体趋于选择美味可口的食物, 同时美食产生的神经系统的适应性及幸福值,均可推动个体的过度摄食。 因此,食物奖赏能促进摄食驱动,且在特定条件下,食物奖赏效应持续增强,即使在没有能量需求的信号反馈下,仍有进食的欲望,尤其是面对高糖、高脂的美味食物,继而介导机体能量摄入过剩,导致肥胖的形成[10-11]。 大量研究已证实肥胖患者食欲特征偏高,对食物有很高的摄食驱动。 薛坤[12]通过儿童饮食行为问卷调查发现,与体重正常的人群相比,肥胖儿童人群中“食物享受”指数水平高,而“饱食反应”显著滞后。因此,随着生活水平的不断提升,肥胖的发生率持续攀高,严重威胁人类健康。
2 食物奖赏的脑神经基础
食物奖赏是食物摄入的一种生理基础, 通过刺激大脑奖赏系统神经通路, 调控能量摄入与消耗的平衡,维系身体新陈代谢的正常需要。美味的食物会给人以愉悦的情绪,为了体验这份愉悦,不论饥饿与否, 机体都可能会有意识的发生摄食行为,即食物奖赏效应。食物奖赏效应由中脑边缘皮质多巴胺系统介导[13]。 该通路起始于腹侧被盖区(Ventral tegmental area, VTA)的多巴胺(Dopamine, DA)能神经元,经内侧前脑束最终投射至伏隔核 (Nucleus accumben, NAc)、 海马体(Hippocampus, Hippo)、 杏仁核(Amygdala,Amg)、前额叶皮层(prefrontal cortex, PFC)和纹状体(Striatum, STR)等脑区。 NAc 是产生愉悦感的核心,其DA 的含量与奖赏效应有着直接联系;Hippo 和Amg 决定了摄食的喜好, 与伴随愉悦感的特殊经历和记忆密切相关;PFC 主要负责情感信息和感官信息(如视觉、嗅觉、味觉等)的整合统筹,是机体摄食决策和执行的区域[14]。 研究显示,在VTA 到NAc 的投射通路中,mu-阿片受体发挥了关键作用。 向NAc 局部注射选择性mu-阿片受体激动剂DAMGO 会导致机体摄食量大量增加,尤其是高糖和高脂食物[15]。 目前普遍认为食物奖赏是由大脑发出信号并通过中枢神经系统介导,驱动机体进食和放大食物愉悦感的进程。 阿片肽是中枢奖赏系统中一种重要的神经递质, 临床使用的选择性mu-阿片受体拮抗剂的研发是目前肥胖防治控制食物奖赏的主要策略[16]。 然而,越来越多的研究显示大脑神经元(又称神经细胞)除了通过中枢奖赏,还可通过肠-脑对话,调控食物奖赏效应。 因此,有关肠-脑对话及其对食物奖赏效应的调控研究已成为一个新的热点。
3 肠神经系统与肠-脑对话
现代医学提出, 胃肠道存在一个相对独立于中枢神经系统 (Central nervous system, CNS)的神经系统, 被称为肠神经系统 (Enteric nervous system, ENS),由分散在食管、胃、小肠、结肠组织上的神经元和神经传感器组成[17]。 类似于脑组织的工作原理,ENS 神经元之间能快速地传递信息,独立地感知、接受信号,对胃肠道环境的变化做出反应, 继而启动与条件改变相适应的功能协调程序。 因此,肠除作为一个重要的消化器官之外,生物学界将其定义为人体的“第二大脑”[18]。 最新研究发现, 肠和脑之间通过神经回路, 存在复杂的“对话” 现象。 实际上, 在机体胚胎时期,ENS 是CNS 中的一部分, 后期才随着细胞发育转移到肠壁之中, 最终分化为一个相对独立的神经系统,ENS 仍保留着与CNS 的双向沟通通路,这个基于胃肠道和脑组织之间的通路即为肠-脑对话的桥梁[19]。
4 肠-脑对话在食物奖赏中的作用
摄食行为的发生是能量需求的本能, 情感愉悦是通过神经回路产生的摄食后效应。 研究显示食物奖赏与药物成瘾性的神经环路机制相似,然而与药物成瘾性相比, 食物奖赏的神经机制更为复杂。 个体嗜好的食物通过奖赏效应提高人体对食物的依赖性, 通过愉悦感的级联放大作用使得食物依赖成瘾性转变为暴饮暴食的摄食失控行为[16]。 早期啮齿动物脑损伤试验表明,下丘脑是脑组织中能量平衡和食欲控制的关键部位, 它能够整合机体外周体液信号, 并通过脑干和相关高级皮质中枢的神经元信号转导有关饮食摄入和能量消耗的信息,同时做出应答[20]。 下丘脑能量稳态调节的关键传入和传出区域(ARC)位于第三脑室两侧,与正中隆起相毗连。 由于缺乏完整的血脑屏障[21],ARC 可与血液循环中的激素和营养物质等相互接触,接收外周信号,随后通过两个不同类型神经元群的神经肽释放做出应答:1)ARC 侧面的神经元群共同表达厌食性神经肽前阿黑皮素(Pro-opiomelanocortin, POMC)和可卡因-安非他明调节转录肽 (Cocaine-amphetamine-regulated transcript, CART)。 POMC 是一种大型前体蛋白,加工后可裂解为α-黑色素细胞刺激素 (α-Melanocyte-stimulating hormone, α-MSH)[22]。 α-MSH 的受体MC3R 和MC4R 广泛分布于下丘脑和其他脑区, 研究显示中枢注射α-MSH、α-MSH类 似物美拉诺坦II (Meranotan II, MTII)或MC3R/MC4R 兴奋剂均可引起实验动物的食欲减退和体重减轻[23]。 2)ARC 中部的神经元群共同表达促食性神经肽刺鼠肽基因相关蛋白(Agouti-related protein, AGRP) 和神经肽Y(Neuropeptide Y, NPY)。AGRP/NPY 是食物摄取的主要驱动力,能够刺激机体进食和体重增加,在这个过程中,AGRP 主要通过拮抗MC3R 和MC4R 抑制POMC神经元的活性, 而NPY 主要通过分泌γ-氨基丁酸(γ-Aminobutyric acid, GABA),作用于Y1 和GABA 受体发挥促食效应[24-25]。 POMC/CART 和AGRP/NPY 这两种神经元群对摄食行为和能量代谢的影响投射于整个脑区, 它们的关系类似于汽车的刹车和油门,彼此间相互协调、相互影响,共同维持机体的体重稳态。
5 脑肠肽与肠-脑对话
脑肠肽是一类在胃肠道和脑组织中双重分布的小分子多肽,兼具内分泌激素和神经递质功能,是肠脑对话的介质。机体摄食后,膳食信息在脑肠肽的搭载下, 可通过迷走神经或血液循环传递到中枢神经系统,发挥促食或厌食效应[26]。 临床研究发现,重度肥胖患者减肥手术前、后,其脑肠肽循环水平会出现显著改变(表1)[27],说明脑肠肽与肥胖进程关系密切。 目前发现的脑肠肽有数十种之多,而研究主要集中于胃饥饿素、缩胆囊素、酪酪肽、 胰高血糖素样肽1 和胃泌酸调节素5 种。 此外,肠-脑之间的复杂对话也与肠道微生物菌群密切相关, 可改变饮食习惯及摄食驱动, 影响肥胖症。
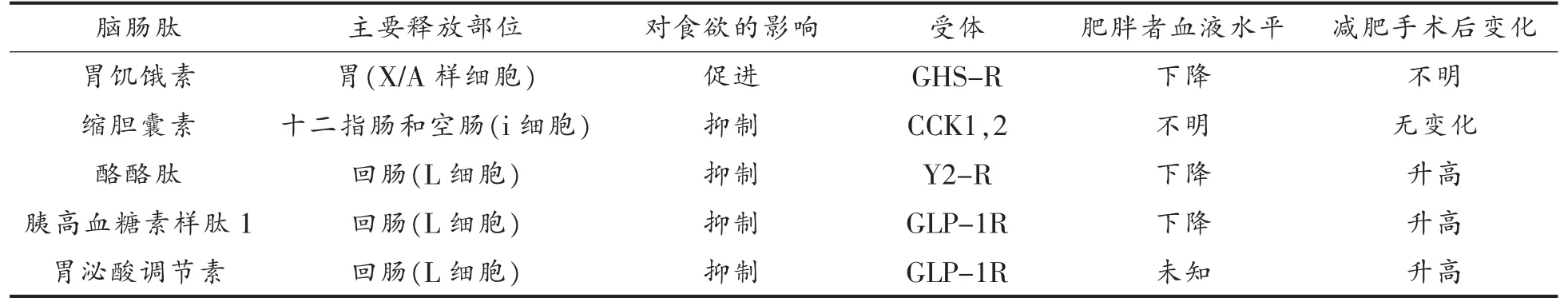
表1 常见胃肠肽及其在减肥手术后循环水平变化Table 1 Common gastrointestinal peptides and their changes in circulating levels after bariatric surgery
5.1 胃饥饿素
胃饥饿素, 由28 个氨基酸组成的脑肠肽,主要通过胃X/A 样细胞分泌, 是目前唯一一种已知的、促食欲的、外周活跃的脑肠肽。 注射外源性胃饥饿素可促进生长激素分泌, 使机体的摄食量增加30%而没有典型的餐后饱腹感[28]。 近年来,营养学和临床研究者已将其作为厌食症和相关恶性疾病条件下的重要靶点,进行促食性干预[29]。
饥饿状态下, 胃饥饿素在血液循环中的水平较高,一旦机体摄食,其含量则会迅速下降,显示营养物质的摄入可能是调节胃饥饿素水平的主要因素。有趣的是,研究者发现肥胖受试者在食物摄入后胃饥饿素水平下降不明显, 提示胃饥饿素可能参与肥胖的病理生理学进程。 进一步研究显示胃饥饿素兼具神经递质作用,可在下丘脑ARC 和脑室周围区域表达,Al 等[30]发现破坏NPY/AgRP表达神经元区域, 可消除中枢给予胃饥饿素产生的促食效应,证实胃饥饿素促食机制可能与NPY/AgRP 表达神经元有关。
5.2 缩胆囊素
缩胆囊素(Cholecystokinin, CCK)是首个被人类发现的厌食胃肠肽, 兼具内分泌激素和神经递质功能,由十二指肠和空肠的i 细胞分泌,以多种分子形式存在于肠道、脑和周围神经之中,其血液水平在饭后15 min 内逐渐升高, 半衰期较短,分泌量主要受蛋白质和脂肪摄入量的影响[31]。
研究表明[32]CCK 能够向中枢神经系统的饱腹感中枢发出信号, 而该效应可通过迷走神经传入神经失活进行抑制,提示CCK 不能直接作用于中枢神经系统,只能通过迷走神经反射发挥效应。虽然CCK 具有显著的抑食作用,但其对于肥胖领域的应用仍存在一定的局限性。Kopin 等[33]发现啮齿类动物外周给予CCK, 可剂量依赖性地抑制饮食摄入量,而持续给予可能会产生耐受性。West 等[34]发现间歇性餐后CCK 输注可抑制啮齿动物的进餐量, 然而同时也观察到了进餐频率的补偿性增加。不仅如此,Kim 等[35]还发现慢性给予CCK 可诱发机体产生胰腺炎, 显示该肥胖防治策略在人类中应用的可行性有限。
5.3 酪酪肽
酪酪肽(Peptide YY, PYY),由36 个氨基酸组成的抑食性脑肠肽,主要通过回肠、结肠和直肠上皮组织的L 细胞分泌,并且在胰腺内分泌细胞、中枢神经系统和末梢神经系统中也有所表达。 该肽的血浆水平在机体摄食后立即增加, 并在餐后达到峰值,其分泌量与机体摄入的热量成正比[36]。
循环系统中,PYY 存在PYY1-36和PYY3-36两种形态,然而PYY1-36入血后易被酶解为n 端截断的PYY3-36,因此PYY3-36是机体血液循环的主要形态[37]。PYY3-36进入血液循环后,可经血脑屏障进入神经中枢, 作用于下丘脑ARC 的Y2受体发挥抑制摄食作用,而该效应可通过特异性Y2拮抗剂和切断迷走神经进行抑制。 啮齿动物实验显示ARC靶向和外周给予PYY3-36均可显著减少食物的摄入量,其生理机制可能与其激活ACR 中POMC 表达神经元及抑制NPY 表达神经元有关[7]。 值得注意的是,研究者发现肥胖个体餐后循环PYY 水平较低, 提示该激素在肥胖发生过程中具有推动作用。
5.4 胰高血糖素样肽1
胰高血糖素样肽1(Glucagon-like-peptide 1,GLP-1)是一种抑食性脑肠肽,为胰高血糖素原基因翻译后加工产物,可被二肽基肽(DPP-IV)酶灭活。 该肽与PYY 一样,由L 细胞分泌,分泌量与机体摄入的热量成正比[38]。
GLP-1 的抑食效果显著,可抑制胃酸分泌,减缓胃排空,同时促进胰岛β 细胞分泌胰岛素,并抑制胰岛α 细胞分泌胰高血糖素, 而该效应可通过切断迷走神经消除, 说明迷走神经在调节GLP-1厌食作用中起着重要作用[39]。 GLP-1 受体广泛分布于大脑、胃肠道和胰腺之中,为G 蛋白偶联受体B 家族成员。据报道,给予GLP-1 受体兴奋剂可显著减少健康志愿者的食物摄入量, 已成为当前防治肥胖症和糖尿病的新思路[40]。
5.5 胃泌酸调节素
胃泌酸调节素(Oxyntomodulin, OXM),由37个氨基酸组成的抑食性脑肠肽, 为胰高血糖素基因转录后加工产物,与GLP-1 和PYY 一样,由L细胞分泌,可被DPP-IV 酶灭活,其分泌量受机体热量摄入的影响[41]。
OXM 生物学功能主要表现为抑制胃酸分泌、减少食欲、增加能量消耗和动员脂肪分解。研究表明OXM 进入血液循环后,可经血脑屏障进入下丘脑ARC,与GLP-1 受体结合,激活饱腹感信号,发挥抑食效应[42]。 与GLP-1 相比,OXM 对GLP-1 受体的亲和力较低,作用区域也有所不同。 Dakin等[43]发现ARC 给予GLP-1 受体拮抗剂exendin9-39 能有效抑制小鼠外周注射OXM 的抑食效应,而对外周注射GLP-1 的抑食效应不产生影响,显示外周OXM 可能作用于ARC, 而GLP-1 则可能作用于脑干极后区发挥效应。 据报道,人体OXM静脉输注可显著降低食欲和食物摄入量, 且反复施用效果更佳。 然而,OXM 抑制食欲作用短暂,主要被DPP-IV 酶灭活,目前对于OXM 肥胖防治的方向主要集中于耐DPP-IV 酶OXM 类似物的研发[44]。
6 肠道微生物菌群与肠-脑对话
肠道微生物菌群是人体内环境最大的共生体系, 在人类健康和疾病中发挥着极为重要的作用[45]。 临床试验表明减肥手术可影响肠道微生物菌群的组成,使肥胖患者和小鼠体内γ-变形菌和疣微菌门的丰度增加,厚壁菌门的丰度减少[46]。 此外, 将减肥手术小鼠的粪便微生物菌群移植到无菌小鼠体内,可使受体小鼠摄食减少、体重减轻,提示肠道微生物与机体肥胖存在直接联系[47]。 进一步的研究表明, 肠道微生物能够将机体难以利用的膳食营养转化为其代谢产物,如短链脂肪酸、GABA、5-羟色胺和其它神经递质, 它们具有不同的外周和中枢调节作用, 可经迷走神经直接或免疫-神经-内分泌网络间接改变宿主的食欲和体重。其中,短链脂肪酸可与胃肠道内分泌细胞上的受体结合, 改变胃饥饿素、PYY、GLP-1 等脑肠肽的释放水平。不仅如此,一些特殊的短链脂肪酸还具有其它效应,如结肠丙酸盐可降低机体对高糖、高脂食物的预期奖赏效应, 其生理机制与中脑边缘皮质多巴胺系统有关。 GABA 和5-羟色胺均具有神经活性, 可在下丘脑突触传递中发挥促食和抑食效应。除了上述机制外,肠道微生物菌群还可通过胆汁酸代谢影响机体的体重。研究表明,一些肠道细菌可将胆汁酸及其结合物作为能量来源,导致法尼醇X 受体(Farnesoid X receptor, FXR)和武田G 蛋白偶联受体5 (Takeda G-proteincoupled receptor 5, TGR5)活化,它们是维持肠道和肝脏中葡萄糖耐受量和胰岛素敏感性的必需受体,可影响脑肠肽的分泌,预防肥胖[48]。
7 结语
近年来越来越多的研究提出,肠-脑对话可通过食物奖赏介导肥胖症的形成。 人类和啮齿类动物的研究证实脑肠肽及肠道微生物菌群,是肠-脑对话作用介导食物奖赏效应调节的主要因素。 基于肠-脑对话调控的肥胖防治策略, 如GLP-1 受体兴奋剂和DPP-IV 抑制剂, 已经在营养学和临床中得到应用,尽管如此,还需要进一步的研究来阐明食物奖赏复杂的调控机制。 总之,肠-脑对话相关的脑肠肽类似物和肠道微生物菌群移植,已成为调控食品奖赏反馈机制,为饮食紊乱、肥胖及代谢综合征等提供新的研究方向和防治策略。

