冠突散囊菌抑菌产物培养基优化及分离鉴定
张 雯, 王明钰, 尤静观, 倪 莉
(福州大学 食品科学技术研究所 福州350108)
冠突散囊菌(Eurotiumcristatum)是发菌科散囊菌属的一种益生真菌,俗称“金花”菌,是茯砖茶“发花”过程中的优势菌。 目前报道的散囊菌属真菌在生长代谢过程中会产生多种次级代谢产物,被认为有抑菌活性[1-5]。 冠突散囊菌在茯砖茶中生长,该过程中会产生具有抑菌活性的代谢产物,抑制其它微生物的生长, 并大量的繁殖成为优势菌[6]。从黑茶中分离得到的冠突散囊菌发酵液的乙酸乙酯提取物, 对枯草芽孢杆菌和白色链球菌具有抑菌性, 且有良好的热稳定性和酸碱稳定性[7]。Du 等[8]从冠突散囊菌EN-220 中分离得到多种芳香族糖苷,对大肠杆菌具有抑制活性。
本课题组在前期研究中分离得到1 株冠突散囊菌FS-10, 其发酵滤液对鱼源腐败菌具有明显的抑制作用。为此,本研究采用响应面法优化冠突散囊菌FS-10 产抑菌活性物质的液体发酵培养基;采用高效液相色谱(HPLC)、基质辅助激光解吸电离/飞行时间质谱(MALDI-TOF-MS)和傅里叶红外光谱(FT-IR)对冠突散囊菌FS-10 发酵液中的抑菌活性物质进行分离纯化和鉴定。
1 材料与方法
1.1 试验用菌和培养
1.1.1 供试菌株 冠突散囊菌(E. cristatum)FS-10,保藏于福州大学食品科学技术研究所;食源性腐败菌,包括嗜冷菌(Psychrophile)DHY-1,希瓦氏菌(Shewanella spp.)JC-20、HC-44、R3-2,假单胞菌(Pseudomonas spp.)LP-3、LP-6,分离自大黄鱼鱼肉与鱼肠, 保藏于福州大学食品科学技术研究所。
1.1.2 菌体培养 抑菌活性测定用菌液体培养。用无菌接种环取1 环供测菌, 接入牛肉膏蛋白胨液体培养基(牛肉膏0.5 g,氯化钠0.5 g,蛋白胨1 g,蒸馏水定容100 mL,pH 7.0~7.2,121 ℃、高压灭菌30 min), 于恒温振荡培养箱中30 ℃,200 r/min培养24 h,将菌液稀释至1 000 倍,得到浓度约为1×105CFU/mL 的供测菌菌悬液,备用。
冠突散囊菌菌株FS-10 发酵无菌上清液的制备方法:采用菌块接种法制备发酵上清液[9]。 将菌株FS-10 在马铃薯葡萄糖琼脂培养基 (PDA)(马铃薯200 g,无水葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,pH 自然)平板上培养7 d,取1 个直径为8 mm 的菌块接入马铃薯葡萄糖液体 (PDL)培养基中, 在恒温振荡培养箱中以28 ℃,200 r/min条件培养7 d。 培养结束后,13 000 r/min 离心15 min,上清液用0.22 μm 滤膜过滤,得到无菌发酵滤液,于4 ℃保存,备用。
1.2 发酵滤液抑菌活性的测定
采用浊度法测定抑菌活性[10-11]。 取1 mL 牛肉膏蛋白胨液体培养基注入微孔板中, 加入10 μL 1.1.2 节得到的指示菌菌悬液, 在试验组中加入100 μL 无菌发酵滤液或待测组分,在对照组中加入100 μL PDL 培养基, 将试验组和对照组同时置于30 ℃,200 r/min 的培养箱中振荡培养24 h。
培养结束后,测定并记录各组在波长600 nm处的吸光值,抑菌率计算公式如下:

式(1) 中,A600nm’——对照组样品的吸光值;A600nm——试验组样品的吸光值。
1.3 响应面法优化产抑菌物质培养基成分
1.3.1 Plackett-Burman 试验设计 以无菌发酵滤液的抑菌率为响应值 (以嗜冷菌DHY-1 为供测菌), 以葡萄糖为碳源、 硝酸钠作为氮源, 采用Plackett-Burman 试验设计研究碳源、 氮源以及微量元素(氯化钠、氯化钾、硫酸锌、硫酸锰)对抑菌活性的影响。采用Minitab 软件对所选水平进行试验设计、数据处理及模型的建立,设计六因素二水平试验优化抑菌效果,试验因素与水平见表1。

表1 Plackett-Burman 试验设计因素及编码水平Table 1 The factor and code level of Plackett-Burman experimental design
1.3.2 最陡爬坡试验 以Plackett-Burman 试验得出的回归方程的系数(正、负)确定各因素的爬坡方向,以各因素效应值的大小确定变化步长,从而快速逼近最大值响应值。 最陡爬坡试验除去影响显著因子,其它各因素均保持不变。
1.3.3 Box-Behnken 试验设计 从Plackett-Burman 试验结果确定培养基中对冠突散囊菌的抑菌物质具有显著影响的因子, 结合最陡爬坡试验结果和实际情况, 选择下一步试验水平的中心点和各水平的步长。 设计三因素三水平试验优化抑菌效果,试验因素与水平见表2。
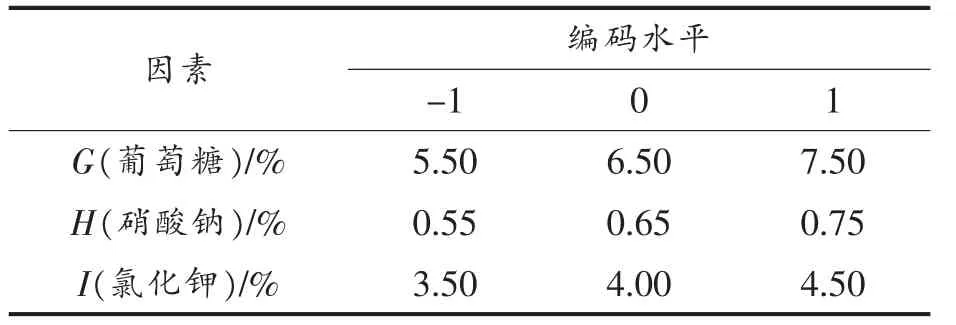
表2 Box-Behnken 试验设计因素及编码水平Table 2 The factor and code level of Box-Behnken experimental design
1.3.4 验证试验 用优化得到的培养基成分、质量分数条件做3 次平行验证试验。 若所得试验值与预测值较接近, 则说明该响应面模型有参考价值。
1.4 抑菌活性物质的分离纯化和鉴定
1.4.1 超滤和透析 各组分抑菌活性比较采用截留分子质量为10 ku 的超滤膜和7 ku 的透析袋分步收集。 首先采用截留分子质量为10 ku 的超滤膜分离菌株FS-10 无菌发酵滤液, 得到分子质量范围大于10 u 的浓缩液和分子质量小于10 ku 的滤液。冻干后复溶为质量浓度为4 mg/mL 的溶液,分析2 个组分的抑菌活性。 将活性高的滤液采用截留分子质量为7 ku 的透析袋, 将其置于10 倍于样品溶液体积的去离子水中透析4 h,得到2 个组分(截留液、透过液),冷冻干燥后,将冻干粉末复溶为4 mg/mL 溶液,做抑菌试验。
1.4.2 凝胶色谱柱层析 以葡聚糖凝胶G-75 为填料,选用30 cm×Φ2.6 cm 的层析柱,将1.4.1 节所得抑菌活性组分的冻干粉加少许缓冲液稀释,用0.22 μm 滤膜过滤后上样, 用去离子水以0.3 mL/min 的流速洗脱, 在波长280 nm 处检测吸光度,收集各洗脱峰,冷冻干燥备用。 将冻干粉末复溶为4 mg/mL 的溶液,做抑菌试验,选出具有抑菌活性的洗脱峰。
1.4.3 反相高效液相色谱 将1.4.2 节所得具有抑菌活性的洗脱峰冻干粉加少许缓冲液稀释,用0.22 μm 滤膜过滤后上样, 采用C18 柱进行液相色谱分离。 检测波长分别为280 nm 和220 nm;流动相A 为0.01%三氟乙酸水溶液, 流动性B 为0.01%三氟乙酸乙腈溶液;进样量10 μL,流速0.3 mL/min。 梯度洗脱条件:0~10 min,80% A、20% B;10~40 min,A 变化为80%~20%,B 为20%~80%;40 ~50 min,20% A、80% B;50 ~60 min,A变化为20%~80%,B 为80%~20%。 富集各组分后,减压浓缩除去有机溶剂,取沉淀物质用去离子水复溶为0.4 mg/mL 的样品溶液,做抑菌试验。
1.4.4 结构鉴定 活性组分委托福建中医药大学采用基质辅助激光诱导解析飞行时间质谱进行分子质量鉴定。 质谱分析采用Autoflex speed MALDI-TOF 质谱仪,电喷雾(ESI)正离子模式。采用Nicolet iS50 傅里叶红外光谱仪对纯化的抑菌组分进行结构鉴定。 利用溴化钾压片法,在400~4 000 cm-1波段对样品进行扫描分析。
1.5 冠突散囊菌FS-10 抑菌活性物质的特性
1.5.1 抑菌谱测定 按1.1.2 节所述制备嗜冷菌DHY-1、希瓦氏菌(JC-20、HC-44、R3-2)、假单胞菌(LP-3、LP-6)等6 株细菌的菌悬液,用1.4.3 节抑菌活性组分测定抑菌率。
1.5.2 抑菌浓度测定 采用两倍连续稀释方法将1.4.3 节纯化得到的抑菌活性组分配成质量浓度分 别 为2 000,1 000,500,250,25,62.5,31.25 μg/mL 的样品溶液, 以0.25 μg/mL 氯霉素为阳性对照,水为空白对照,PDL 培养基为阴性对照,以嗜冷菌DHY-1 为指示菌,采用琼脂扩散法[10]做抑菌试验,试验重复3 次。
1.5.3 热稳定性的测定 取等量 (0.4 mg/mL)将1.4.3 节纯化得到的抑菌活性组分分别置于-20,4,25,100,121 ℃环境中30 min, 在室温放置10 min 后,以嗜冷菌DHY-1 为指示菌,做抑菌试验,试验重复3 次。
1.5.4 酸碱稳定性的测定 取等量 (0.4 mg/mL)1.4.3 节纯化得到的抑菌活性组分, 调节pH 值分别为2.0,5.0,7.0,9.0,13.0, 室温放置30 min 后,采用3 mol/L HCl 溶液和NaOH 溶液将样品调回原始pH 5.0,加去离子水定容1.5 mL。 以嗜冷菌DHY-1 为指示菌,做抑菌试验,试验重复3 次。
2 结果与分析
2.1 冠突散囊菌FS-10 产抑菌活性物质培养基的优化
2.1.1 Plackett-Burman 试验设计与分析 采用Plackett-Burman 试验设计,以抑菌率为响应值,对葡萄糖、硝酸钠、氯化钠、氯化钾、硫酸锌、硫酸锰6 个成分进行考察。 试验设计及结果见表3,各因子效应分析见表4。

表3 Plackett-Burman 试验设计及结果Table 3 Design and results of Plackett-Burman experiments
经回归分析得回归方程:Y (抑菌率)=0.36434+0.03191A+0.06667B+0.01972C+0.00416D-0.00214E+0.00556F。由表4 可知,系数项A(葡萄糖)、B(硝酸钠)、C(氯化钾)3 项因子是培养基中影响菌株FS-10 发酵液抑菌效果的关键因子(P<0.05)。
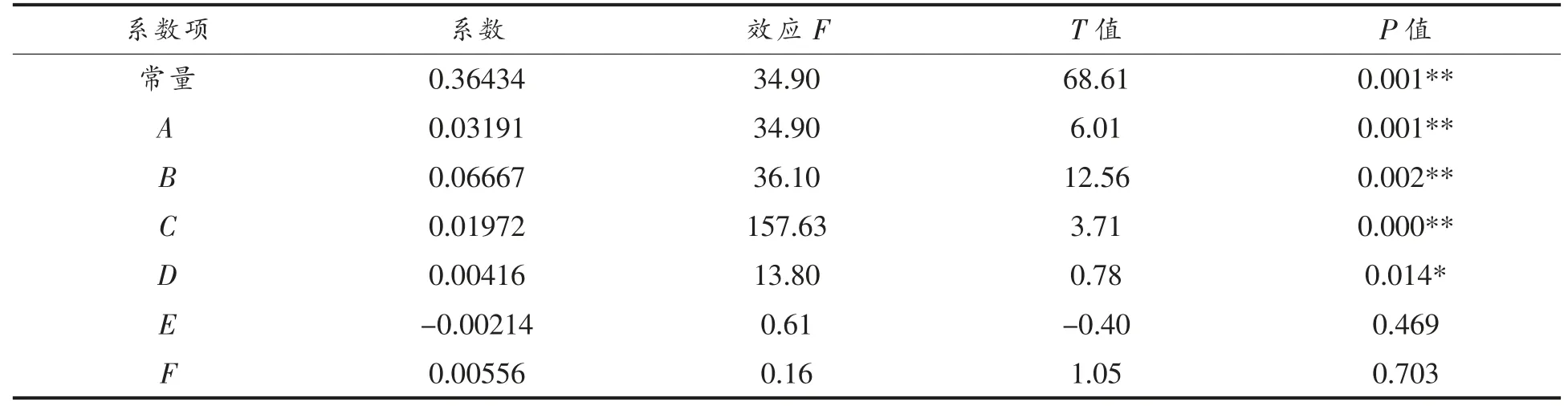
表4 Plackett-Burman 试验设计回归各因子效应分析Table 4 Regression factor analyses of Plackett-Burman experimental design
2.1.2 最陡爬坡试验 通过Plackett-Burman 试验设计筛选出关键因子,即葡萄糖、硝酸钠、氯化钾。最陡爬坡试验以这3 者为考察对象,固定其它条件不变。 试验结果见表5。
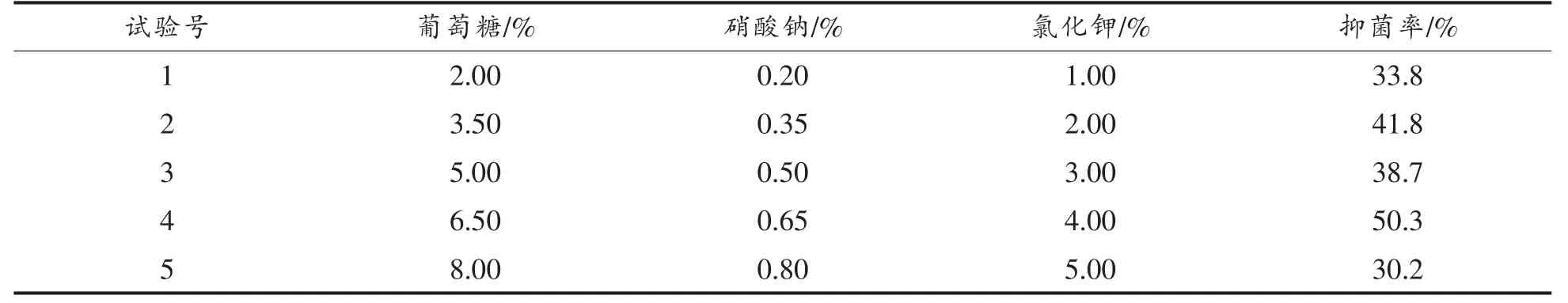
表5 最陡爬坡试验梯度设计及结果Table 5 Design and results of steepest ascent experiments
由表5 可得,最陡爬坡试验5 组试验的抑菌率整体呈先上升后下降的趋势。 在质量分数为6.50%无水葡萄糖、0.65%硝酸钠、4.00%氯化钾时,所对应的发酵液抑菌率最高,为三因素的最大响应值区域。 选择第4 组作为响应面的中心点。
2.1.3 响应曲面与验证模型的建立 结合Plackett-Burman 试验设计和最陡爬坡试验所得结果,利用Minitab 软件进行Box-Behnken 试验设计和数据分析,其试验结果见表6。
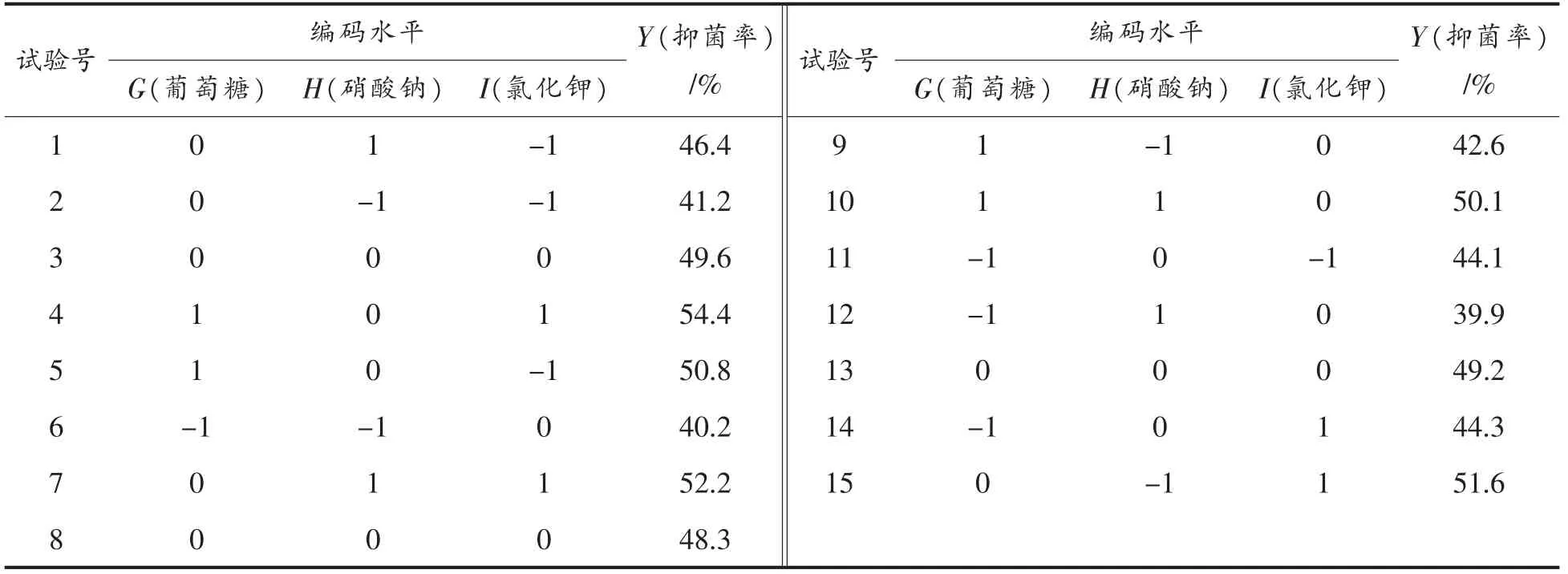
表6 Box-Behnken 试验设计及结果Table 6 Design and results of Box-Behnken experiments
由表7 可得,G(葡萄糖)和I(氯化钾)显著性较高,对于抑菌率的影响较大(P<0.05)。 二次项中H2、G2、I2的P 值依次增大,H2的显著性较高。交互项中3 项的P 均大于0.05, 因此GH、GI、HI 之间的交互作用不是很明显。

表7 Box-Behnken 试验设计回归系数和显著性验证Table 7 Significance test and coefficient of Box-Behnken experimental design
根据试验设计和数据分析, 得出冠突散囊菌FS-10 发酵液抑菌率对葡萄糖(碳源)、硝酸钠(氮源)、氯化钾的二次多项回归方程为:Y(抑菌率)=0.4904+0.03689G+0.01613H+0.02521I-0.0265G2-0.0319H2+0.0201I2+0.0193GH +0.0085GI -0.0114 HI。
由表8 可以看出该模型的P=0.022,在一定程度上可看出该二次多项模型具有显著性(P<0.05),方差分析该模型的R2=92.79%,说明模型与试验数据的吻合性较好。 R2Adj=79.82%, 大于70%,存在相关性,而与R2值之间差距仍较大。
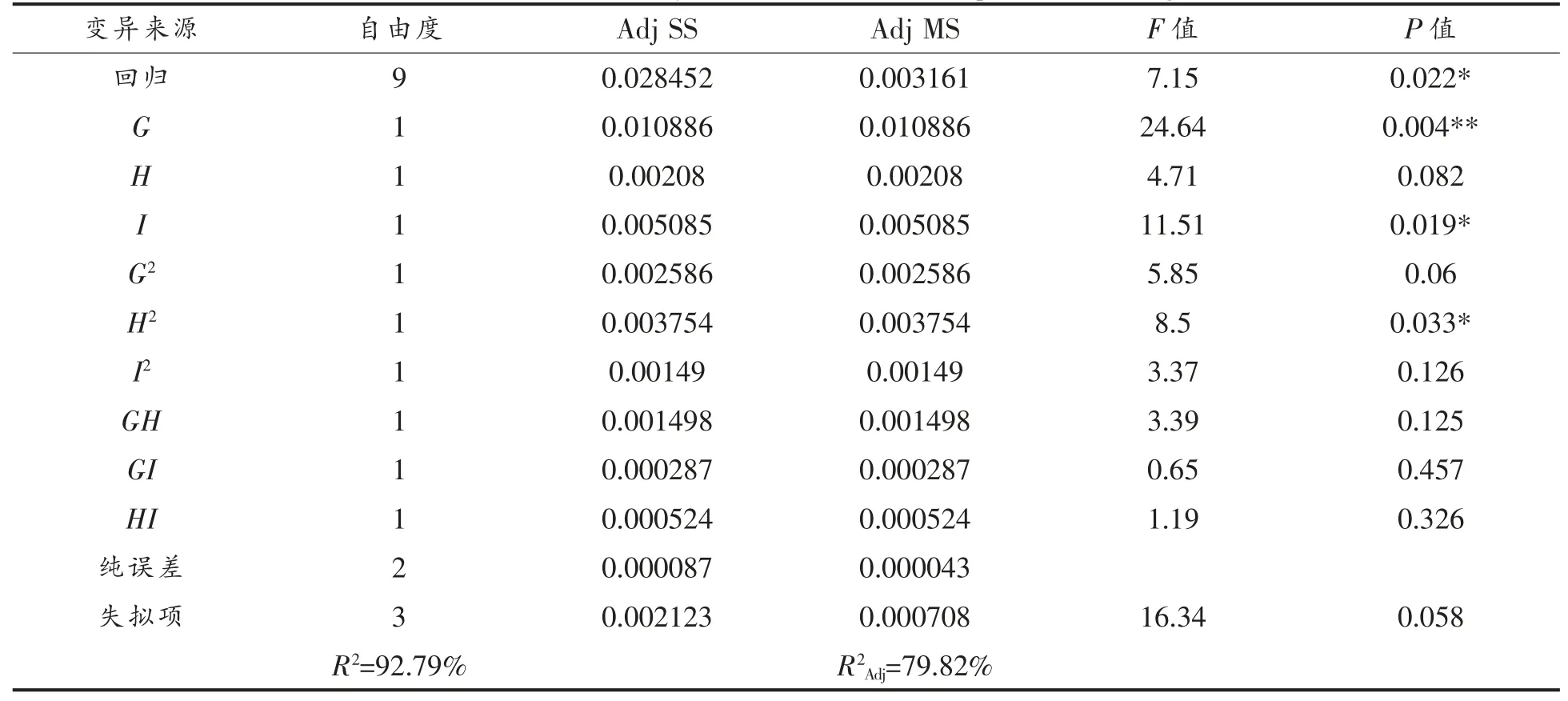
表8 Box-Behnken 试验设计回归模型分析Table 8 Variance analysis of Box-Behnken experimental design
根据上述回归方程运用Minitab 软件绘制响应曲面图与等值线图,见图1。
由图1a、1b 可知, 当硝酸钠质量分数保持不变时,随着葡萄糖质量分数的增加,抑菌率提高;当葡萄糖质量分数在7.0%~7.5%, 硝酸钠质量分数在0.65%~0.75%范围时,抑菌率较高。该响应曲面图初具模型, 若将葡萄糖和硝酸钠质量分数增大,则出现响应曲面完整的高位点。
由图1c、1d 可知,当葡萄糖质量分数较低时,抑菌率随氯化钾质量分数变化不大; 当葡萄糖质量分数大于6.5%时,抑菌率增大。 抑菌率响应面高点出现在高质量分数葡萄糖和高质量分数氯化钾区域。
由图1e、1f 可知,当氯化钾质量分数不变时,抑菌率随着硝酸钠质量分数的增加呈先升后降的趋势, 抑菌率响应面高点出现在硝酸钠中质量分数区域。

图1 各因子交互作用的响应曲面和等高线图Fig.1 Surface maps and contour maps for each factor interaction
2.1.4 回归模型验证试验 利用响应优化器证实预测值与真实值之间的拟合程度, 得出培养基最优条件为7.5%葡萄糖、0.65%硝酸钠、4.5%氯化钾,预测抑菌率为54.44%。 以此条件做验证试验,其抑菌率为(51.0±4.4)%,说明利用响应面法优化得到的培养基配方条件有参考价值。
2.2 冠突散囊菌FS-10 抑菌活性物质分离纯化和鉴定
将发酵液经10 ku 超滤膜过滤后, 活性较高的过滤液进一步采用7 ku 的透析膜透析,各组分进行活性测定,如表9 所示。该透过液冻干后经凝胶色谱分离,得到1 个高纯度的单峰,见图2,经抑菌活性测定,该峰(4 mg/mL)抑菌率为74.5%。进一步利用反相高效液相色谱分离得到6 个组分(FS-I、FS-II、FS-III、FS-IV、FS-V、FS-VI),如图3所示。 收集各组分峰,检测各组分的抑菌活性,结果组分FS-IV 和FS-VI 具有明显的抑菌效果,对嗜冷菌DHY-1 的半抑制质量浓度(IC50)分别为0.4 mg/mL 和0.3 mg/mL。 其余4 个组分均无明显的抑菌作用。具有抑菌活性FS-IV 和FS-VI,采用基质辅助激光解吸电离/飞行时间质谱 (MALDITOF-MS)分析,结果见图4,两个目标抑菌活性组分的分子质量分别为1 630.8 u 和840.5 u。

表9 超滤和透析后各组分的抑菌活性Table 9 Antibacterial activity of each component after ultrafiltration and dialysis

图2 凝胶过滤柱层析洗脱曲线Fig.2 Elution curve of gel filtration column chromatography
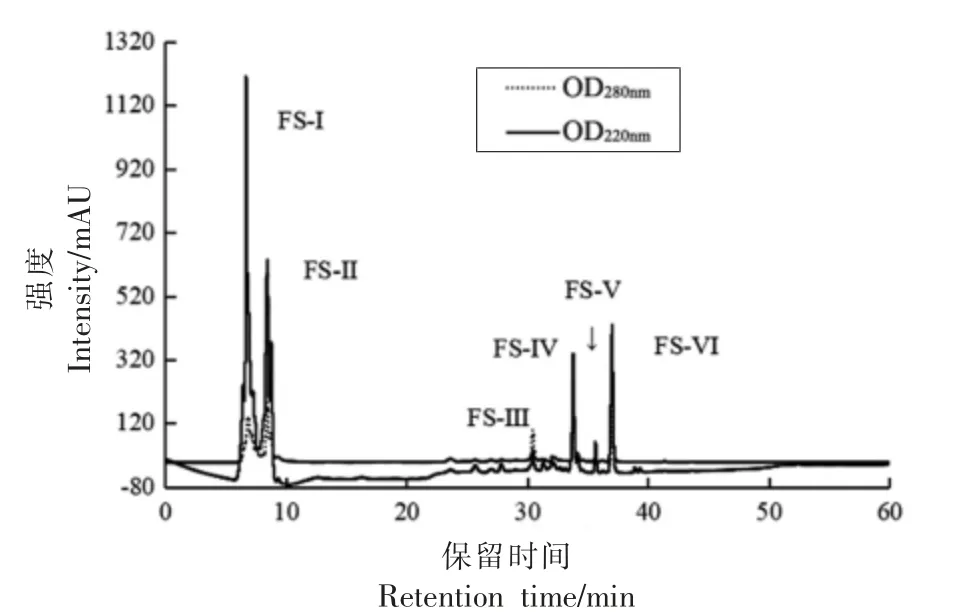
图3 反相高效液相色谱图Fig.3 RP-HPLC absorption of active compounds
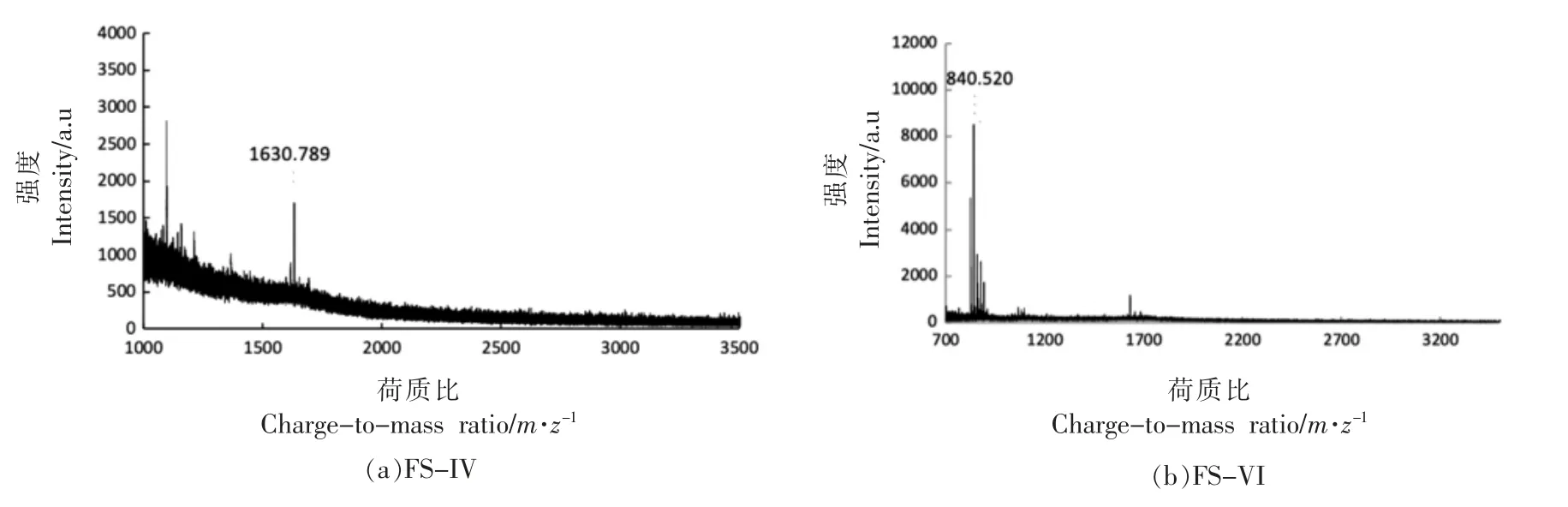
图4 组分FS-IV 和FS-VI 的MALDI-TOF-MS 图Fig.4 MALDI-TOF-MS of components FS-IV and FS-VI
利用傅里叶红外光谱分别扫描经由高效液相色谱分离得到的两个抑菌组分FS-IV 和FS-VI(图5)。 组分FS-IV 和组分FS-VI 在3 550~3 200 cm-1范围出现宽而散的吸收峰,存在缔合型羟基;在1 600 cm-1附近显示C=C 振动;在1 300 cm-1附近显示C-N 振动。
如图5a 所示, 标志组分FS-IV 在2 934.163 cm-1处的弱吸收峰为C-H 的不对称伸缩振动;1 150~1 060 cm-1范围为醚或其它化合物中C-OC 的不对称伸缩振动;900 cm-1附近为C-C 振动;<500 cm-1为C-C-C 振动。 综上,推测组分FS-Ⅳ是杂多糖衍生化合物。
如图5b 所示, 标志组分FS-Ⅵ在1 092.477 cm-1处的吸收峰和在905.4153,854.3109 m-1和781.9933 cm-1处的吸收峰为酯类化合物中C-O键的两个吸收峰; 在1 000~700 cm-1范围明显的吸收峰为烯烃C=C-H 振动;614.2167 cm-1处为炔烃C≡C-H 的变形振动。 综上,推测组分FS-Ⅵ是酰胺类衍生化合物。
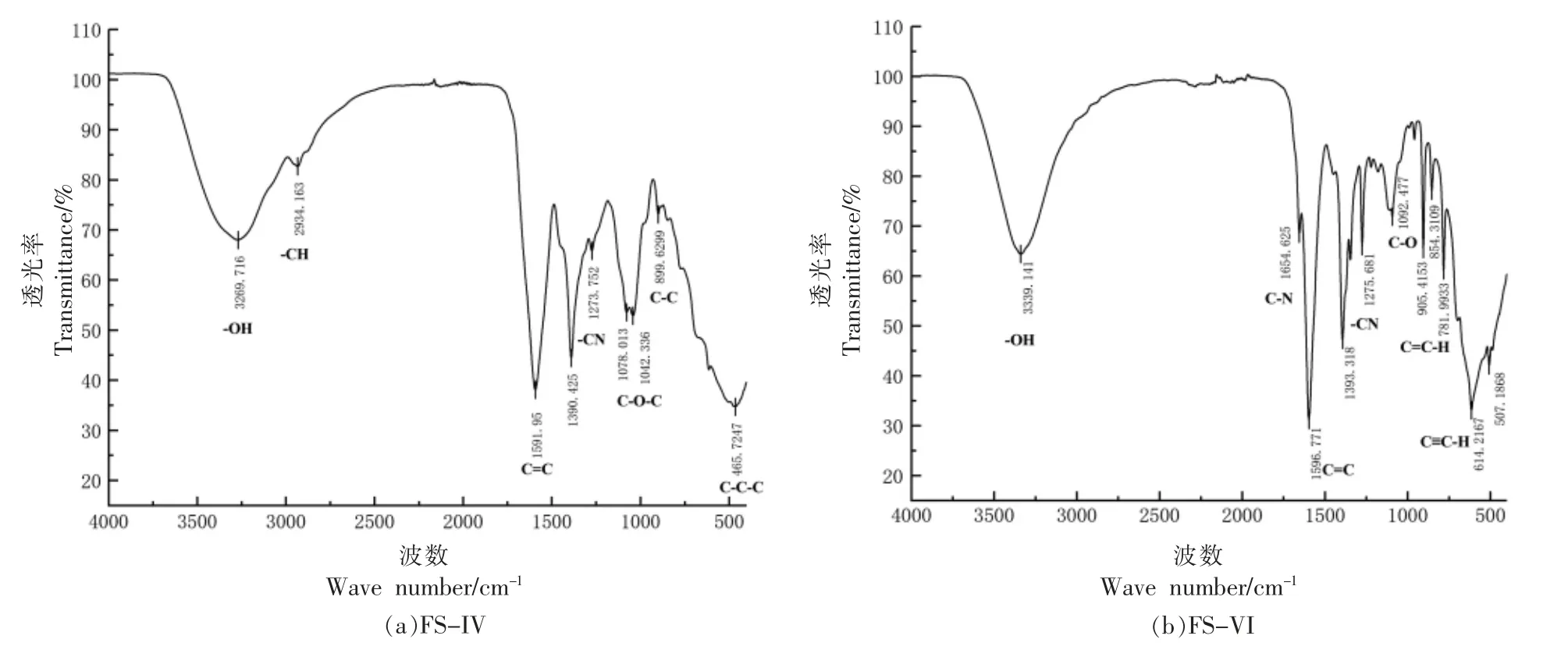
图5 组分FS-IV 和FS-VI 的傅里叶红外吸收光谱Fig.5 FT-IR absorption of components FS-IV and FS-VI
多位学者从冠突散囊菌发酵液中分离得到多种吲哚生物碱[12-14],对大肠杆菌、金黄色葡萄球菌等致病菌有不同的抑制作用。 吲哚生物碱是一类含氮的化合物, 由色氨酸衍生而来, 多为环状结构。 彭晓赟等[15]从冠突散囊菌中分离到多种苯甲醛类化合物, 认为冠突散囊菌中的主要代谢产物是苯甲醛类化合物, 试验分离得到的灰绿曲霉黄色素、2-(2′, 3-环氧基-1′, 3′-庚二烯基)-6-羟基-5-(3-甲基-2-丁烯基) 苯甲醛、2-(2′, 3-环氧基-1′, 3′ 5′-庚三烯基)-6-羟基-5-(3-甲基-2-丁烯基) 苯甲醛、酪醇、对羟基苯甲酸、苔黑酚等对多种肠道致病菌有抑制作用。 李莹[16]从冠突散囊菌中分离纯化得到大黄素等多种蒽醌类活性化合物,蒽醌是一类具有环状结构的化合物,颜色多为橙色和黄色,具有抑菌活性。前期研究分离自冠突散囊菌发酵液的抑菌活性物质分子质量均小于500 u[14-15,17-21],而本研究首次得到分子质量大于800 u 的两种抑菌活性组分,推测得活性物质中含有杂多糖的衍生化合物、 带有酰胺类衍生化合物等多种物质。
2.3 冠突散囊菌FS-10 抑菌活性物质的特性
2.3.1 抑菌广谱性和抑菌浓度 两个活性组分(FS-IV、FS-VI)对嗜冷菌DHY-1、希瓦氏菌(JC-20、HC-44、R3-2)、假单胞菌(LP-3、LP-6)的抑制活性见图6。 活性组分对这6 株细菌均有抑制作用,其中对嗜冷菌DHY-1 和希瓦氏菌R3-2 的抑菌率超过50%, 且组分FS-VI 抑菌活性略高于组分FS-IV。 图7 所示,两个抑菌活性组分(FS-IV、FS-VI)对嗜冷菌的抑制作用都随活性组分质量浓度的增加而增强,0.25 μg/mL 氯霉素对嗜冷菌的抑制活性与250~500 μg/mL 的FS-IV、FS-VI 相当(抑菌圈17.3~18.8 mm)。
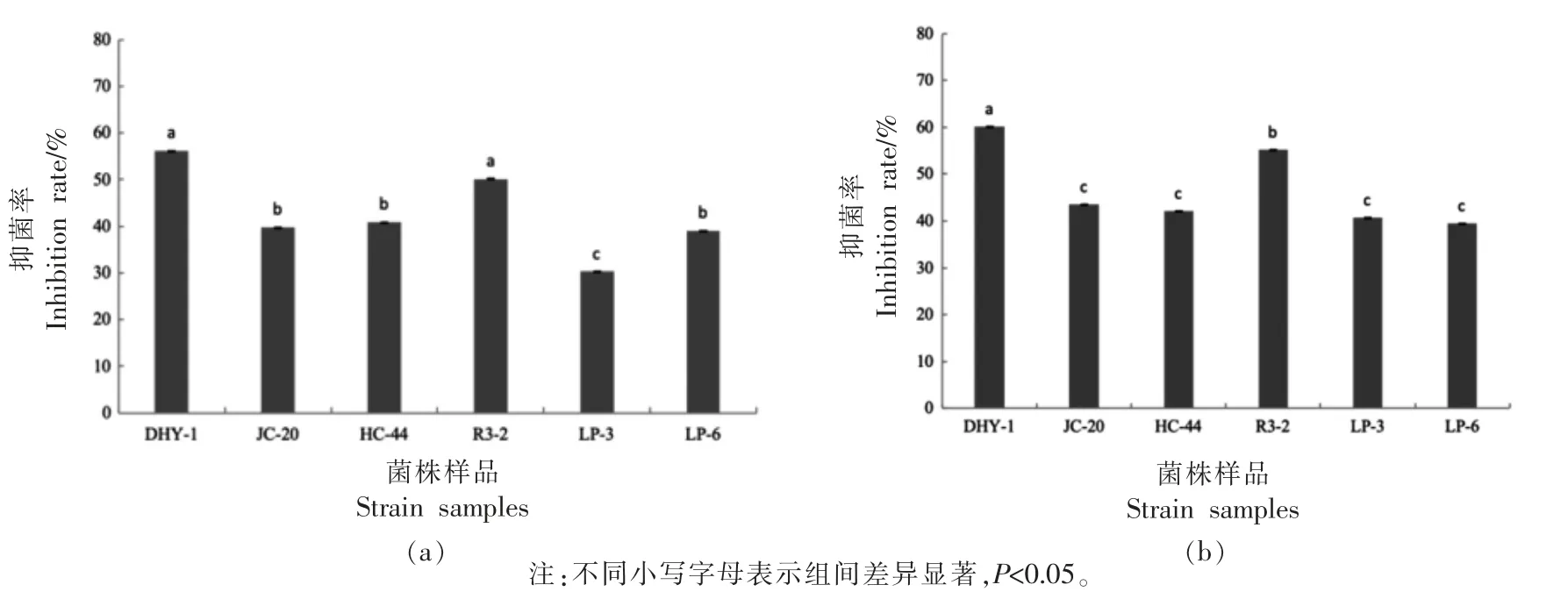
图6 组分FS-IV(a)和FS-VI(b)对食源腐败细菌的抑制Fig.6 Inhibition of components FS-IV (a) and FS-VI (b) on foodborne spoilage bacteria
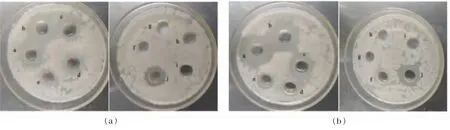
图7 组分FS-IV(a)和FS-VI(b)拮抗嗜冷菌DHY-1Fig.7 Inhibition effect of components FS-IV (a) and FS-VI (b) against Psychrophile DHY-1
乳酸链球菌素Nisin 是目前少数允许用作食品添加剂的生物保鲜剂,其对金黄色葡萄球菌、肉毒梭状芽孢杆菌、溶血链球菌、李斯特菌等一些革兰氏阳性菌有较为明显的抑制作用, 而对革兰氏阴性菌抑制效果不明显, 且存在单一保鲜剂效果有限,易受环境因素影响,抗菌时效短等不足[22]。有研究表明,冠突散囊菌PDA 发酵液对枯草芽孢杆菌、 金黄色葡萄球菌等革兰氏阳性菌和大肠杆菌有抑制作用[6]。有研究人员从冠突散囊菌中分离出次级代谢产物,对大肠杆菌、金黄色葡萄球菌和普通变形杆菌有不同程度的抑制作用[14-15]。本研究从发酵液中分离得到新的活性组分, 对多种食源性革兰氏阴性菌有较强的抑制活性。综上,冠突散囊菌在生物保鲜剂领域的开发和应用前景广阔。
2.3.2 稳定性 两个活性组分 (FS-IV、FS-VI)在-20~100 ℃范围稳定,甚至在121 ℃高温处理后抑菌活性几乎未损失(图8a)。 处理温度-20~121℃对组分的抑菌活性稳定性无显著影响, 表明两个抑菌活性组分的热稳定性较好。
两个活性组分(FS-IV、FS-VI)在pH 2~13 对嗜冷菌DHY-1 有较好的抑制作用 (图8b)。 在pH 5 时抑菌能力最佳,这可能与冠突散囊菌的自然生长环境呈弱酸性相关, 此条件下其代谢产物的活性也较高。 在pH 2 的过酸条件或pH 13 的过碱条件下抑菌率稍有下降,不显著,两个抑菌活性组分具有较好的酸、碱稳定性。
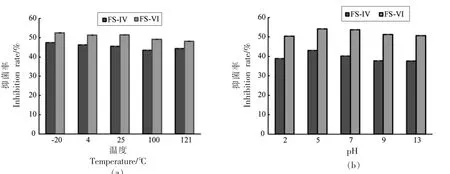
图8 组分FS-IV 和FS-VI 的稳定性Fig.8 The stability of components FS-IV and FS-VI
3 结论
3.1 冠突散囊菌FS-10 产抑菌活性物质的培养基成分
碳源对活性物质的产生影响最为显著。 通过Plackett-Burman 试验设计与响应面法相结合优化, 经回归模型验证得到的冠突散囊菌FS-10 产抑菌活性物质发酵培养基最佳配方为无水葡萄糖(碳源)7.5%、硝酸钠(氮源)0.65%、氯化钾4.5%,发酵液对浓度为1×105CFU/mL 嗜冷菌菌悬液抑菌率达54.4%。
3.2 冠突散囊菌FS-10 抑菌活性物质的生物学及理化性质
冠突散囊菌FS-10 发酵液经超滤、透析、凝胶过滤层析、高效液相色谱等一系列分离纯化,得到两个尚未报道的抑菌活性组分(FS-IV、FS-VI)。采用MALDI-TOF-MS 和傅里叶红外光谱对其进行鉴定, 组分FS-IV 和FS-VI 的分子质量分别为1 630.8 u 和840.5 u,推测组分FS-IV 是杂多糖的衍生化合物,组分FS-VI 是酰胺类衍生化合物。两个抑菌活性组分对嗜冷菌、希瓦氏菌、假单胞菌等革兰氏阴性食源性腐败细菌有不同的抑制作用,且均有良好的热稳定性和酸、碱稳定性。冠突散囊菌及其发酵液中存在多种抑菌活性物质, 它们之间可能存在协同作用。

