富马酸替诺福韦二吡呋酯对乙型肝炎病毒载量和肝肾功能影响分析
张丰晓 白雪松 胡敬华
河南省周口市中心医院感染科 460000
据世界卫生组织 (WHO) 统计,在全球 2.57亿乙型肝炎病毒(Hepatitis B virus, HBV) 感染者中,只有 10.5% 知道自己受到感染,其中不到 20% 正在接受抗病毒治疗[1]。每年有近 100 万人死于 HBV[2],主要是由于进展为肝硬化和肝细胞癌(Hepatocellular carcinoma,HCC)。由于共价闭合环状 DNA (cccDNA) 在受感染的肝细胞中持续存在,因此治愈慢性 HBV 感染具有挑战性[3]。富马酸替诺福韦二吡呋酯(TDF)是一种经济实惠、耐受性良好的核苷类药物(NA),具有较高的耐药遗传屏障[4-5],因此是HBV患者最常用的一线选择。尽管之前的研究为 TDF 治疗与 HCC 或肝硬化风险的有益关联提供了证据,但TDF对非肝硬化HBV患者肝脏炎症、纤维化演变、病毒载量的影响还需要进一步探索。本文通过前瞻性病例对照研究,以探讨TDF对乙型肝炎病毒载量和肝肾功能的影响,为乙型病毒性肝炎的临床治疗提供理论参考。
1 对象与方法
1.1 研究对象 采用前瞻性病例对照研究法,选取2018年5月—2020年8月我院感染科118例乙型肝炎患者,按照奇偶数随机分组的原则,随机分为观察组(n=59例)和对照组(n=59例)。观察组平均年龄(44.9±3.9)岁,男/女=26/33,HBeAg阳性7例, ALT为(101.8±9.4)IU/L,TBiL为(10.5±1.2)μmol/L,HBV DNA为(4.8 ±0.7)log10IU/ml;对照组平均年龄(43.3±2.9)岁,男/女=27/32,HBeAg阳性6例, ALT为(106.4±10.2)IU/L,TBiL为(9.8 ±0.9)μmol/L,HBV DNA为(4.6±0.5)log10IU/ml。两组研究对象的人口统计学、肝功能、肾功能以及外周血中HBV DNA病毒载量差异不显著(P>0.05),具有可比性。
1.2 选择标准 纳入标准:(1)CHB患者(定义为两次HBsAg检测阳性和/或HBV DNA检测至少相隔6个月); (2) 接受 TDF或 ETV单一疗法的患者(即未接受 NAs 或干扰素治疗的个体);(3)知情同意愿意参加本次研究,并签署知情同意书者。排除标准:(1)丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)或HIV合并感染患者; (2)失代偿期肝硬化患者; (3) 基线时患有 HCC 的患者; (4)年龄<18 岁; (5) eGFR 测量值<2的患者;(6)患有高血压、糖尿病疾病者。
1.3 治疗方法 观察组患者采用富马酸替诺福韦二吡呋酯片[葛兰素史克(天津)有限公司,批准文号:国药准字H20153090],300mg/d,口服,1次/d,连续服用48周;对照组患者采用恩替卡韦(中美上海施贵宝制药有限公司,批准文号:国药准字H20052237),0.5mg/d,口服,1次/d,连续服用48周。
1.4 评价指标
1.4.1 病毒载量:使用 Cobas TaqMan仪(Roche Diagnostics,Branchburg,NJ)对HBV DNA进行定量检测,检测下限为 9IU/ml。使用Abbott Architect i2000SR(Abbott Laboratories,Chicago,IL)仪定量测量血清HBVe抗原(HBeAg)和HBsAg,检测下限为0.05IU/ml。定义:(1)病毒学应答:为基线时可检测到的血清HBV DNA VL,在随访期间被抑制到<20IU/ml,之后没有从达到的最低点水平增加≥1log10IU/ml;(2)HBeAg消失:从HBeAg阳性变为HBeAg阴性;(3)HBsAg 消失为阴性: HBsAg 或在先前阳性结果后通过定量测试检测不到HBsAg。
1.4.2 肝纤维化评估:采用TE评估法[6]对肝纤维化程度评估。F0期:TE<7.0kPa;F1期:7.0kPa≤TE<8.0kPa;F2期:8.0kPa≤TE<10.0kPa;F3期:10.0kPa≤TE<14.0kPa;F4期:TE≥14.0kPa。
1.4.3 肾功能评估:通过血肌酐(Scr,μmol/L)和肾小球滤过率(eGFR,ml/(min·1.73m2))指标测量肾功能。本研究使用碱性苦味酸终点比色法检测受试者外周血Scr水平,通过肾病饮食改良 (MDRD)[7]研究方程进行eGFR计算。eGFR通常分为G1~G5 五个类别,用于监CKD的发展或进展,如下所示:
肾功能正常定义为 eGFR≥90ml/(min·1.73m2)(G1);如果 eGFR 60~89ml/(min·1.73m2)(G2),肾功能轻度下降;如果eGFR为45~59ml/(min·1.73m2)(G3a),肾功能轻度至中度丧失;如果eGFR为 30~44ml/(min·1.73m2)(G3b),肾功能中重度丧失;如果eGFR 15~29ml/(min·1.73m2)(G4),肾功能严重丧失;如果eGFR<15ml/(min·1.73m2)(G5),则肾功能衰竭。
1.5 数据收集 本文采用前瞻性病例对照研究,分析在治疗的48周内观察组和对照组患者乙型肝炎病毒载量和肝肾功能的纵向变化情况,对于每位患者,在基线和 3、6、12、18、24、30、36、42、48周的多个后续随访时间点收集相关数据。 由于这是常规收集的临床数据,随访的时间间隔不规则,在某些时间点缺少数据。 为了充分利用不规则数据进行纵向变化模式分析,本研究采用了一种插补方案,即如果某个时间点的数据缺失,使用t±1.5或3周内最接近该时间点的数据。
1.6 统计学方法 本研究使用SPSS25.0软件对所得数据进行统计学分析,对分类变量使用 Fisher精确检验,而对于连续变量,采用t检验或Wilcoxon秩和检验。为了检查TDF和ETV对乙型肝炎病毒抑制的功效,本研究通过使用配对t检验或配对Wilcoxon检验将两种不同药物治疗后不同时间点的 乙型肝炎病毒载量与基线时进行比较,应用 Kaplan-Meier (KM) 方法来估计随时间推移的病毒学反应率。为了进一步评估和比较观察组和对照组之间 HBV DNA VL、ALT、TE和eGFR 随时间的变化,本研究使用线性混合效应模型进行重复测量,并通过残差图检查两组之间的差异性,设定P<0.05为差异有统计学意义。
2 结果
2.1 HBV DNA病毒载量比较 在治疗3周后,观察组患者外周血中HBV DNA病毒载量开始显著下降,后期各时间点HBV DNA病毒载量均明显低于对照组,两组之间差异有统计学意义(P<0.05),具体见图1a。通过对每个时间点不同HBV DNA病毒载量的患者百分比做进一步的分层分析,发现随着治疗时间的延长,观察组HBV DNA病毒载量低的患者百分比呈上升趋势,具体见图1b。采用Kaplan-Meier 分析以估计每组HBV DNA病毒载量>20IU/ml 患者随时间推移的概率。 在 Kaplan-Meier 分析中,实际日期用于计算HBV DNA 病毒载量抑制<20IU/ml 的时间,而不是推算的时间点,截尾受试者在曲线上用点标记,结果发现,随着治疗时间的推移,观察组患者HBV DNA载量>20IU/ml的概率明显低于对照组,两组之间差异有统计学意义(P<0.05),具体见图1c。

图1 两组患者HBV DNA 病毒载量纵向分析
2.2 两组患者肝功能及复常情况比较 治疗后24周和治疗后48周,观察组和对照组外周血中ALT水平差异不显著(P>0.05);同时,治疗后24周和治疗后48周,观察组和对照组ALT复常率差异不显著(P>0.05)。具体见表1。
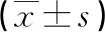
表1 两组患者肝功能及复常情况比较
2.3 两组患者肝脏硬度(瞬时弹性成像评分)的纵向分析 分析每个时间点瞬时弹性成像评分的分布,可见治疗前观察组和对照组患者肝脏硬度差异不显著(P>0.05)。观察组在治疗24周后肝脏硬度较治疗前呈现下降趋势,且观察组肝脏硬度明显低于对照组(P<0.05)。具体见图2。
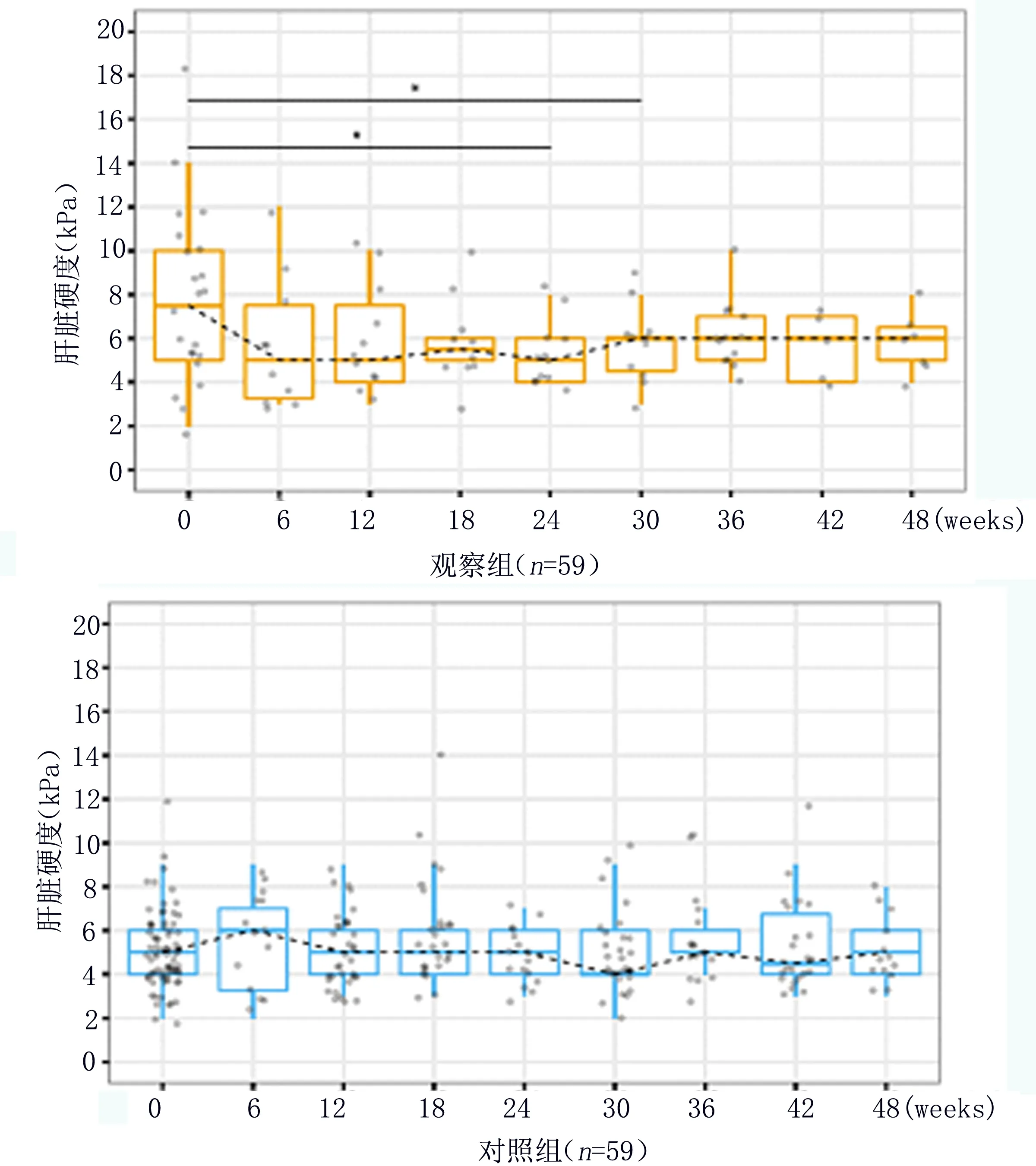
图2 两组患者肝脏硬度(瞬时弹性成像评分)的纵向分析
2.4 两组患者肾功能情况比较 治疗后24周和治疗后48周,观察组和对照组Scr和eGFR差异不显著,无统计学意义(P>0.05)。具体见表2。
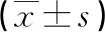
表2 两组患者肾功能情况比较
2.5 两组患者不良反应发生率情况比较 观察组不良反应发生率为11.86%,明显低于对照组的28.81%,两组之间差异有统计学意义(χ2=10.362,P<0.001)。具体见表3。
表3 两组患者不良反应发生率比较[n(%)]
3 讨论
本文通过前瞻性病例对照研究,评估TDF和ETV对乙型肝炎病毒载量和肝肾功能影响,经过48周的治疗,结果发现TDF治疗组患者外周血中HBV DNA病毒载量下降水平明显低于ETV组(P<0.05);同时,TDF组在治疗24周后肝脏硬度较治疗前呈现下降趋势,且TDF组肝脏硬度明显低于ETV组(P<0.05);TDF组的不良发生率明显低于EVT组(P<0.05);但是,治疗观察期间两组肝肾功能水平差异不显著(P>0.05)。上述结果表明TDF可显著降低乙型肝炎病毒载量,降低肝脏纤维化风险,不良反应小,不会增加肝肾功能损害,该结果与前期相关学者研究结论基本相符[8]。TDF已被确定为抗长期病毒复制的有效药物,TDF 的长期疗效已通过长期随访得到证实,证明该药具有病毒抑制、改善肝硬化患者肝脏组织学,以及降低 HCC、肝功能失代偿、死亡和肝硬化的发生率,并且发生HBV耐药突变的风险几乎为零。
TDF是核苷酸类似物替诺福韦的口服前体药物,替诺福韦是HBV DNA聚合酶/逆转录酶(pol/RT)的体外强效选择性抑制剂。TDF目前已获批用于治疗12岁及以上患者的CHB,在Cai D等[9]学者进行的一项多中心、随机、双盲、Ⅲ期研究中,比较了TDF每日1次给药与阿德福韦酯(ADV)每日1次给药治疗1年(48周)的疗效,结果显示TDF在抑制病毒和改善组织学炎症方面优于ADV。关于TDF的肾毒性仍然是一个有争议的问题。有学者研究表明[10],接受TDF治疗的患者eGFR下降率高于接受恩替卡韦(ETV)治疗的患者,TDF可能是肾功能不全的独立风险因素。但是,也有研究发现[11]:无论既往治疗史如何,TDF治疗3年期间肾小球滤过率估计值(eGFR)均无显著变化,该结论与本研究结果基本相符。同样,Trinh S等人[12]报告,在基线eGFR正常的患者中,TDF与肾功能不全风险升高无关,而在基线肾功能受损的患者中,肾功能显著恶化关于TDF在既往治疗乙型肝炎患者中的广泛使用,长期随访时应监测TDF的肾毒性。
本研究虽然得出TDF可显著降低乙型肝炎病毒载量,降低肝脏纤维化风险,不会增加肝肾功能损害。但是,也存在有以下不足:首先,由于分析能力受到样本量的限制,一些缺失的数据限制了比较分析的能力,虽然也通过在短时间内使用最近的时间点进行数据插补来减少这些关注时间点的缺失,但是可能会影响结果的准确性。其次,本研究只选取了成年患者,没有将孕妇或患有高血压、糖尿病等慢性病人群纳入研究中,使研究结论不具有全面性。今后还需要多中心、大样本量进一步分析TDF对不同群体CHB患者的功效。

