基于网络药理学探索甘草治疗皮肤基底细胞癌的机制
张良,杜蕾
(1.武汉市第一医院,湖北 武汉 430000;2.武汉市中医医院,湖北 武汉 430000)
基底细胞癌(Basal cell carcinoma,BCC)是一种常发生在表皮或皮肤附属器的皮肤恶性肿瘤[1]。中药甘草是豆科植物甘草属的干燥根及根茎。甘草有清热解毒,祛痰化湿的效果,其机制涉及甘草的抗炎、解毒、调节免疫功能、抗氧化等作用[2]。甘草的活性成分主要为黄酮类和三萜类化合物[3],已有研究证实其中异甘草素通过靶向miR-301b/LRIG1 信号抑制人类黑色素瘤生长[4]。但甘草及其活性成分对治疗BCC 的相关机制还未研究。网络药理学从系统生物学的角度和生物网络平衡的角度更全面阐释疾病的的发生机制[5-8]。因此,本研究利用网络药理学分析甘草治疗BCC 的潜在作用靶点和相关机制,并为指导评价甘草在治疗BCC 中的临床应用价值提供证据。
1 材料与方法
1.1 甘草的活性成分及靶点筛选 从中医药系统药理学数据库分析平台(TCMSP,https://old.tcmspe.com/tcmsp.php)获取甘草化学活性成分,根据药物动力学(Absorption,distribution,metabolism and elimination,ADME)筛选,脂水分配系数(ALogP)<5,Caco-2 渗透性≥-0.4,口服生物学吸收性(Oral bioavailability,OB)≥30%,类药性(Drug-like ,DL)≥0.18。同时收集这些成分的作用靶点。
1.2 BCC 相关基因 使用“basal cell carcinoma”作为搜索词,笔者合并了5 个数据库中的疾病目标,即GeneCards 数据库(https://www.genecards.org/),OMIM(https://omim.org/),TTD(https://db.idrblab.org/ttd/),PharmGKB(https://www.pharmgkb.org/)和Drugbank(https://www.drugbank.ca)。
1.3 甘草活性成分作用靶点的网络构建 利用Cytoscape 3.8.0 软件构建甘草活性成分-疾病靶标的可视化网络。韦恩分析(https://bioinfogp.cnb.csic.es/tools/venny/index.html)获得药物靶点与疾病靶点的重叠靶点,并构建蛋白质-蛋白质相互作用(PPI)网络(https://string-db.org/)。根据网络节点的拓扑特征,利用CytoNCA 以点度中心性(DC)、接近中心性(CC)和中介中心性(BC),≥中位数进行2 次筛选,获得蛋白互作网络的核心靶点(Hubs)。
1.4 基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析 R 平台上使用clusterProfiler 软件包对甘草作用于BCC 的靶点进行GO 和KEGG功能富集分析。
1.5 分子对接 从PubChem(https://pubchem.ncbi.nlm.nih.gov/)下载化学活性成分的2D 结构,使用ChemBio 3D 软件通过最小化能量来计算获得3D结构。从RCSB 蛋白质数据库中获得了蛋白质的三维结构(http://www.rcsb.org/pdb)。AutoDock Vina 对接软件(版本1.5.6)进行分子对接模拟及分析,Py-MOL 软件绘图。
2 结果
2.1 甘草的活性化学成分及靶点 TCMSP 平台获取的甘草中的化学成分,以ADME 进行筛选,获得81 个有效的活性化合物,见表1,以及相对应的199个作用靶点。
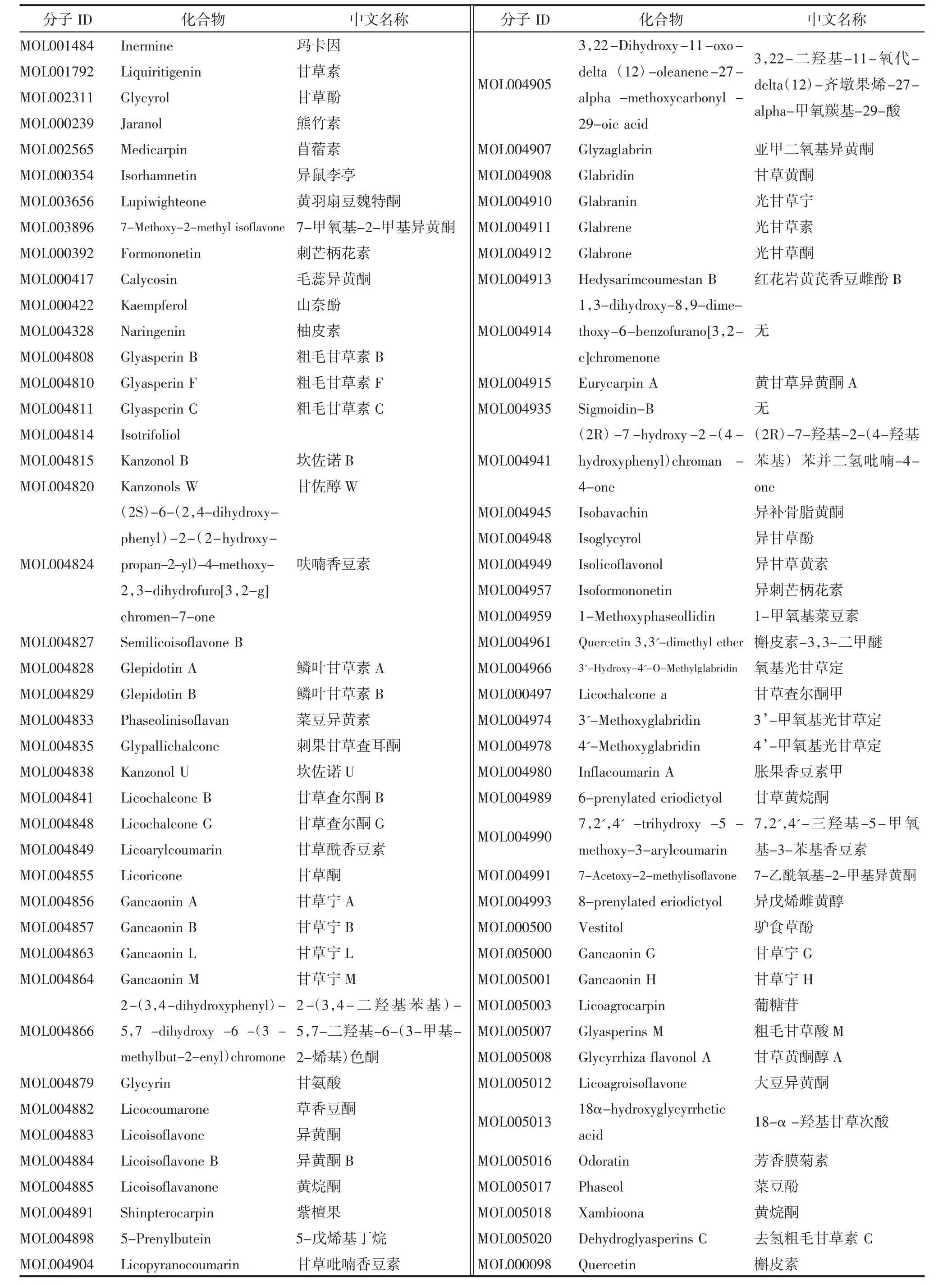
表1 甘草中有效的活性化合物
2.2 BCC 相关基因及相关的甘草作用靶点 为了获得疾病相关基因,笔者使用“基底细胞癌(Basal cell carcinoma,BCC)”作为搜索词,在GeneCards,DrugBank,OMIM,PharmGKB 和TTD 中共检索到7 196 个BCC 相关基因,见图1A。
韦恩分析获取189 个药物靶点和疾病靶点的交集基因,作为甘草治疗BCC 的潜在靶点进行后续分析,见图1B。
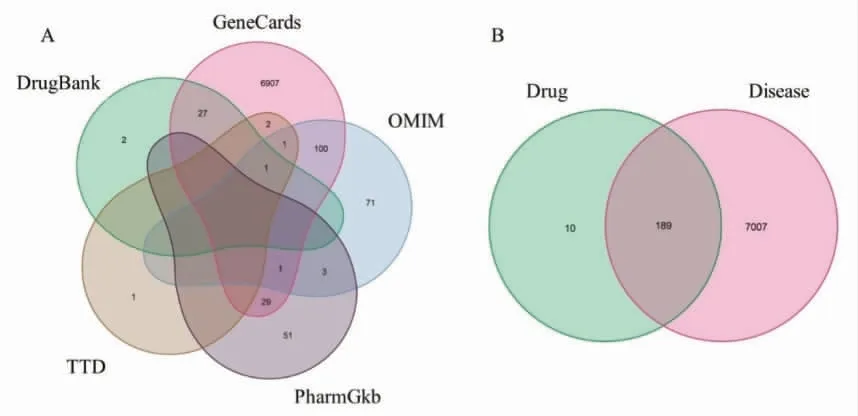
图1 BCC 相关基因和甘草作用靶点的韦恩分析
2.3 甘草活性成分与疾病相关靶点调控网络 甘草活性成分和疾病靶点网络图由268 个节点(与疾病基因交集后获得79 个活性成分及189 个靶点)和1 292 个边组成。网络中与节点相连的边数以连接度(Degree)表示,连接度越高,代表该节点在网络中起主导作用。通过网络拓扑学分析,结果显示槲皮素、山奈酚、柚皮素和甘草查尔酮甲在网络中的连接度高,表明其是治疗BCC 的主要活性成分,见图2。
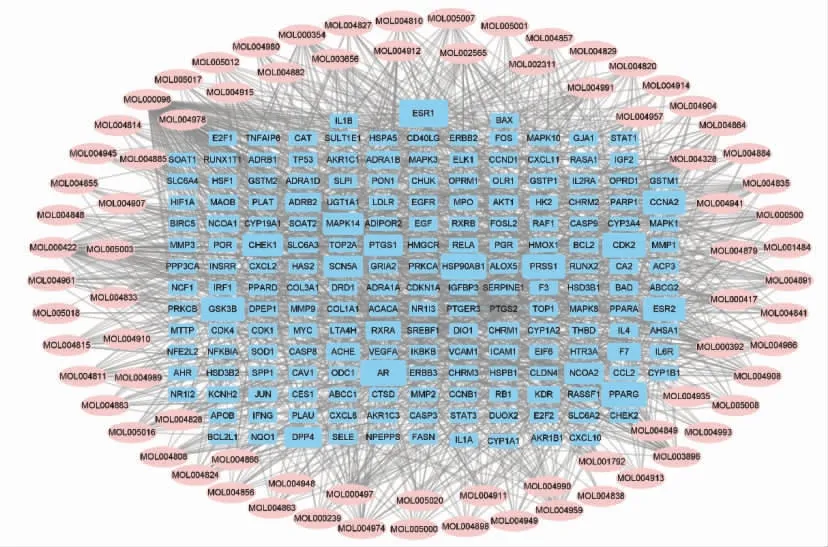
图2 甘草活性成分和疾病靶标网络图(DDN)
从靶点角度分析,38 个化合物靶向PTGS2,37个靶向 ESR1,32 个靶向 AR,31 个靶向HSP90AB1,30 个靶向PPARG,表示这几个靶点最容易受甘草的调控。
3.4 甘草作用BCC 的靶点PPI 网络构建和分析 从String 数据库中获得189 个甘草作用BCC 的靶点PPI 网络,可信度>0.9,并删除和其他靶点无相关的节点,利用Cytoscape 软件进行可视化分析。网络包括166 个节点和714 个边,见图3A,利用CytoNCA插件,通过2 次中位数筛选,获得15 个Hubs,分别为 MAPK1/3/8/14、AKT1、ESR1、EGFR、TP53、RB1、RELA、STAT3、FOS、JUN、CCND1 和MYC,其相互作用关系见图3B。
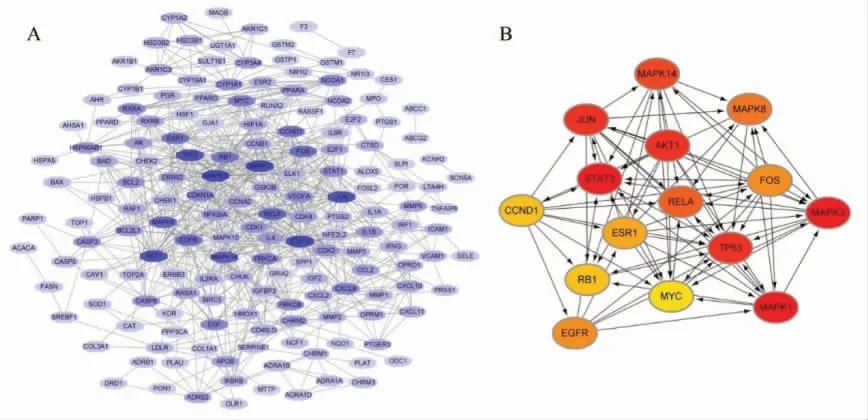
图3 药物作用靶点PPI 网络
3.5 药物作用BCC 靶点的GO 富集和KEGG 富集分析 为了更好地理解189 个交集靶基因的生物学功能,利用R 平台的clusterProfiler 软件包进行GO 和KEGG 功能富集分析。图4 分别显示了生物过程(BP)、细胞成分(CC)和分子功能(MF)中的前10 个相关功能。结果表明,甘草的靶点主要参与细胞对氧化应激、化学应激、药物和脂多糖等反应的生物学过程;细胞成分主要为膜结构组成部分、激酶组成等;分子功能方面涉及核受体活性配体的激活,转录分子结合,磷酸酶结合,泛素样蛋白激酶结合、药物结合、类固醇结合等。
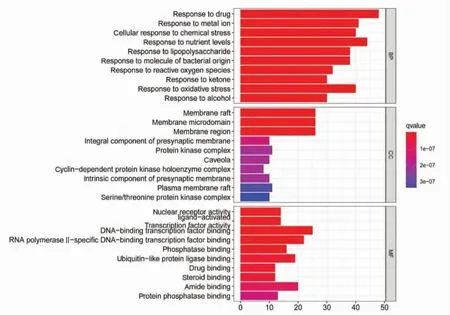
图4 交集基因的GO 富集分析
KEGG 功能富集结果显示,交集基因参与170条信号通路,图5 展示了排名前20 个通路,包括癌症相关信号通路(化学致癌-受体激活,化学致癌-活性氧,前列腺癌,胰腺癌等),感染相关的信号通路(乙型肝炎,丙型肝炎等),此外还有免疫调节相关信号通路[白细胞介素-17(IL-17)信号通路,肿瘤坏死因子(TNF)信号通路,辅助性T 细胞17(Th17)细胞分化]。图6 显示的是化学致癌-受体激活信号通路,其中红色节点为甘草调控BCC 的作用靶点。
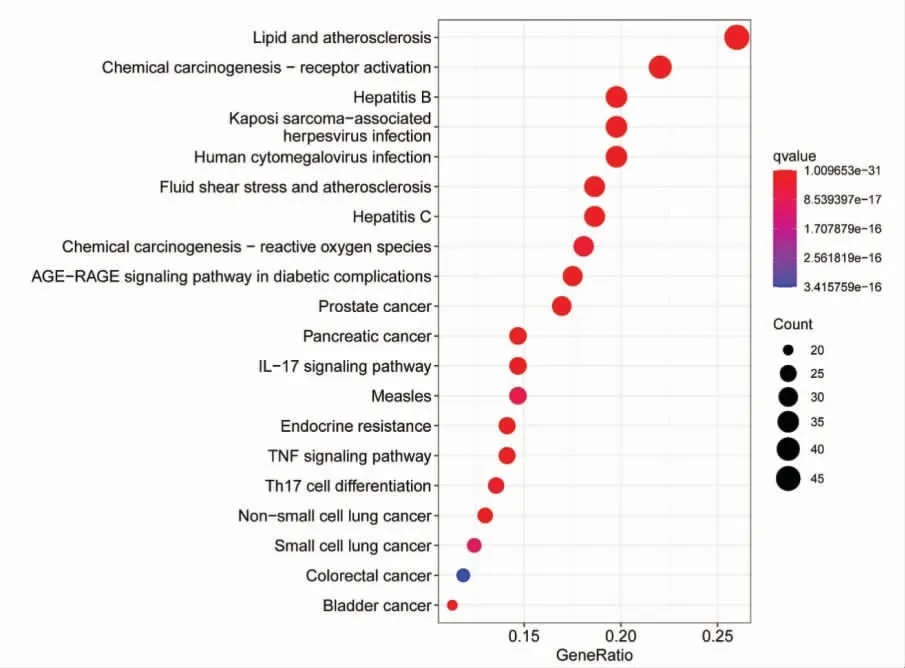
图5 交集基因的KEGG 富集分析
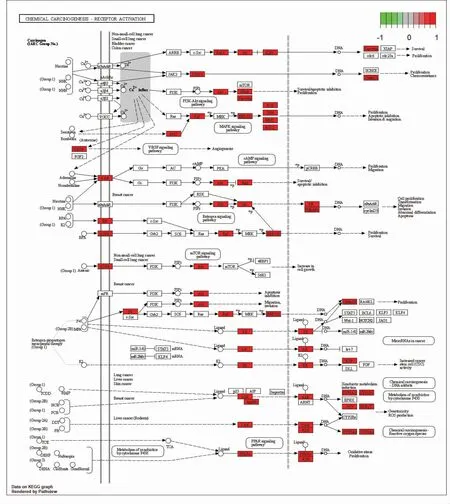
图6 交集基因在化学致癌-受体激活信号通路上的分布
3.6 分子对接分析Hubs 与甘草活性成分的相互作用 为了验证甘草的调控机制,笔者选择了交集靶点PPI 分析中的Hubs,通过分子对接进行验证其与重要的活性成分的相互作用。AutoDock 分析获得结合自由能,结合自由能越低,结合构象越稳定,分子间有较强的结合活性(<-5 kcal/mol)。MAPK1、MAPK3、STAT3、AKT1、JUN 和CCND 与甘草中重要的活性成分之间的结合自由能均较低,见表2。
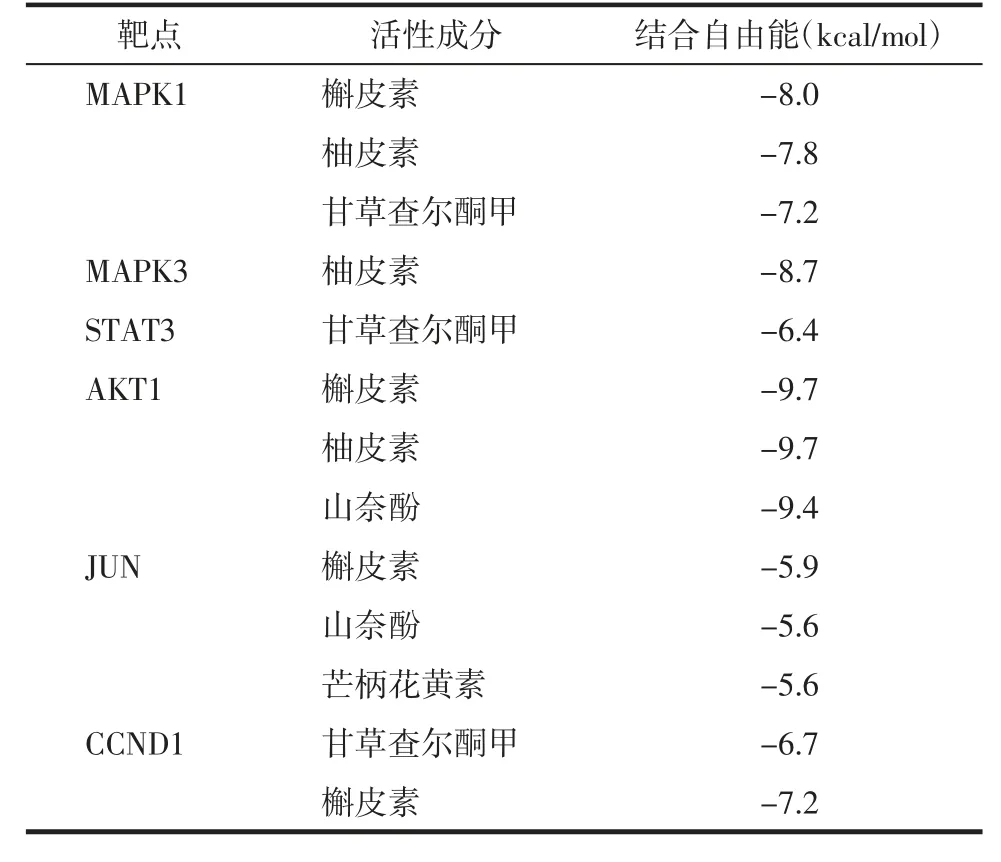
表2 Hubs 与甘草活性成分的结合自由能
笔者对Hubs 和活性成分相互作用的最近构象进行可视化分析。槲皮素、柚皮素和甘草查尔酮甲均可以很容易地进入并结合MAPK1 的活性口袋,并与相邻氨基酸有多个氢键,表示结合构象的稳定,见图7。
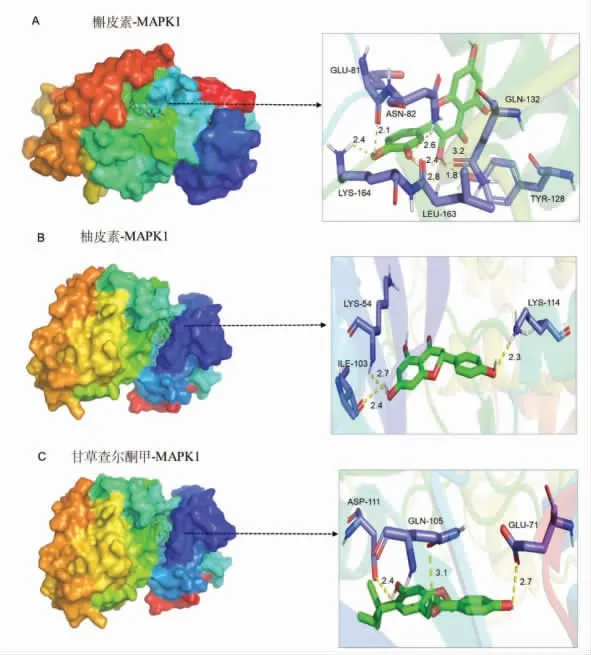
图7 分子对接结果可视化
3 讨论
BCC 是最常见的皮肤恶性肿瘤,手术治疗是基底细胞癌的首选方案,但对于转移基底细胞癌或晚期基底细胞癌需要使用药物治疗。中药及其生物活性成分在癌症治疗中的应用已有相当长的一段时间,并且有多靶点药理作用和较少的不良反应的特点。甘草是治疗BCC 重要的中草药,出现在治疗的经验方剂中,甘草活性成分复杂,已有研究表明甘草的活性成分对肿瘤有治疗作用包括甘草苷,甘草素、光甘草定,异甘草素,甘草查而酮等[3],但甘草抗肿瘤的具体作用机制不清。因此本研究利用网络药理学系统性探索甘草治疗基底细胞癌的机制,促进甘草在临床上的应用。
在TCMSP 数据库显示甘草有280 个化合物成分,通过ADME 筛选能在体内发挥作用的成分[8],通过与疾病相关基因交集,最后获得能影响BCC 相关基因的79 个有效活性成分,及189 个靶标。笔者的结果提示甘草中槲皮素,山奈酚、柚皮素和甘草查尔酮甲是主要发挥治疗BCC 作用的活性成分。已有研究证实槲皮素通过调节PI3K/AKT/mTOR 和MAPK/ERK1/2 通路促进细胞活力丧失、凋亡和自噬,从而发挥抗癌作用[9]。山奈酚有抗炎、抗氧化、抗肿瘤等活性,并已应用于癌症化疗,其作用机制包括使细胞周期停滞在G2/M 期、上皮间质转化(EMT)相关标志物的下调和影响PI3K/ PKB 信号通路[10]。柚皮素联合柚皮苷可以克服癌症中不同防御机制导致的多药耐药性,通过多种信号转导途径发挥广谱抗肿瘤作用[11]。甘草查尔酮甲通过调节癌细胞的代谢过程发挥抗肿瘤作用和/或作为化学增敏剂[12]。这些研究提示甘草的多成分协同发挥抗癌作用。
甘草的作用靶点和BCC 靶点交集基因的KEGG 功能富集结果证明了甘草参与多种癌症相关信号通路的调节。同时通过对药物靶点和疾病靶点的交集靶点相互作用网络分析,鉴定了15 个甘草治疗BCC 的Hubs。其中AKT1、FOS、JUN、RELA、CCND1、EGFR、MAPK1、MAPK3、MAPK8、STAT3、TP53、MYC 参与癌症代谢通路(癌症中的代谢途径)影响持续性血管新生、细胞凋亡、增殖、细胞周期、分化阻滞等生物学过程,发挥治疗肿瘤的作用。MAPK 家族参与调节多种细胞过程,包括细胞增殖、分化、存活、凋亡和炎性反应,其中MAPK8 通路的失调与多种免疫疾病和癌症有关[13]。EGFR 是许多上皮恶性肿瘤的预后生物标志物,激活不同信号通路的重要启动子,导致细胞增殖、侵袭和转移[14-15]。CCND1 参与调控细胞周期,BCC 中的PTCH1 突变可导致CCND1 的mRNA 水平的降低[16]。TP 53 基因的失活参与细胞周期停滞和程序性细胞死亡的活化[17]。已在50%的人类癌症(包括所有皮肤癌)中检测到失活的TP 53 基因改变。STAT3 在人类非黑色素瘤皮肤癌(NMSC)中的表达增加[18],是IL-6/JAK/STAT3 通路的关键组成部分。因此,甘草能主要通过抑制细胞的增殖迁移,并调控细胞凋亡发挥看肿瘤的作用。本研究中的分子对接结果也显示作为多种与细胞增殖相关的信号通路的关键因子MAPK1可与甘草中重要的3 个活性成分槲皮素,柚皮素和甘草查尔酮甲相结合。
BCC 是一种免疫原性肿瘤[19],以密集的淋巴细胞浸润为特征[20]。本研究发现甘草的靶点参与免疫相关信号通路,如IL-17 信号通路,TNF 信号通路,Th17 细胞分化。IL-17 是一种促炎细胞因子,在癌症发病机制中起重要作用,研究发现BCC 患者血清中IL-17 水平升高[21]。最近的一项研究表明IL-23/Th17 相关细胞因子在BCC 中的潜在作用[22]。Hubs中的AKT1,RELA,FOS,MAPK3/8/14 还参与炎性调控通路如Toll 样受体信号通路,为甘草的抗炎作用提供证据。其中MAPK8 作为免疫细胞分化和激活的关键调节因子,已有研究表明其参与多种免疫反应,MAPK8 激活促进发育中胸腺细胞的凋亡并调节T 细胞分化和存活[23]。因此,甘草可以通过调节肿瘤微环境的免疫反应,发挥抑制肿瘤发展的作用。
综上,本研究以网络药理学方法,系统研究甘草对治疗BCC 的潜在活性成分,关键因子,影响的信号通路及相应的作用机制。并结合分子对接分析方法,验证了甘草对关键基因的作用。结果表明甘草可以通过抑制肿瘤细胞增殖迁移,影响细胞凋亡,调控肿瘤微环境的免疫细胞亚群的功能,从而发挥抗BCC 作用。

