大豆蛋白纳米纤维冷凝胶对核黄素的控释研究
关琛,李萌,李宁,周航庆,张建红,李琳
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.东北农业大学食品学院)
蛋白质自组装纤维结构吸引了纳米技术、食品、医学等多个研究领域的显著兴趣[1]。大豆蛋白[2]、乳清蛋白[3]等多种食品蛋白[4]均可在酸性条件(通常在pH2.0左右)和低离子强度下,长时间加热自组装成纳米纤维。这些蛋白纳米纤维具有高纵横比(长度1~10μm,直径1~10 nm),能够在极低的蛋白质浓度下形成自支撑水凝胶,具有更好的乳化和起泡特性,可用作增稠剂、乳化剂等[5-6],在靶向、定点投放方面具有多种优势,可用于制造微胶囊、微凝胶和水凝胶等,来包封咖啡因[7]、维生素[8]等以实现控制释放[9-10]。蛋白质浓度、pH值、加热时间和温度、加热方式、离子强度、离子类型[3,11]等因素都会影响纳米纤维的形成和所得纤维的属性。纤维表面存在多种反应性的官能团,这使得它们可以被多种试剂调节。
近年来,应用食物蛋白纳米纤维制造冷固性凝胶引起了国内外学者的关注。Veerman等[12]通过Ca2+诱导β-乳球蛋白纤维冷凝胶,主要分两步进行。第一步是蛋白质溶液在远离等电点和低离子强度的条件下加热形成纳米纤维结构;在第二步中,调节pH值至中性条件后添加盐,通过降低静电斥力诱导凝胶化。该过程的蛋白浓度比热诱导凝胶法或常规冷定型凝胶法低得多。Abaee等研究表明,添加少量的CaCl2可以形成透明凝胶,其微观结构的特征是形成细丝[13]。Mohammadian等[14-15]使用不同的二价阳离子制得乳清蛋白纤维冷凝胶,其中Zn2+-冷凝胶具有更紧密的网络结构,在模拟胃液条件下降解的程度也更大。相同的蛋白质浓度和pH条件下,冷固性凝胶比热固性凝胶具有更均匀的微观结构,更高的凝胶强度和断裂性能、更好的保水性和透明度[16]。
大豆分离蛋白(SPI)具有良好的凝胶性,可以用于改善食品的质地和口感[17]。然而,传统的SPI凝胶通常是通过热处理实现的,这限制了它作为热敏化合物载体的应用。而纳米载体可以为游离的生物活性成分提供许多优点,例如增加溶解性(或分散性)和稳定性,增强吸附,甚至改善细胞内的渗透。目前,尚未见盐诱导SPI纤维冷凝胶控释性能的研究报道。核黄素具有较低的分子量和部分水溶性,并且与大豆蛋白没有很强的相互作用,易于扩散和定量分析。因此,选用核黄素作为药物模型,目的是探究SPI纤维冷凝胶作为核黄素载体,为SPI纤维冷凝胶的开发及利用提供理论基础。
1 材料与方法
1.1 材料与试剂
大豆低温脱脂豆粕;山东万得福集团实业有限公司;化学试剂均为分析纯。硫磺素T(Th T)、核黄素均为分析纯,购于美国Sigma公司。
1.2 仪器与设备
H1850R型高速冷冻离心机:湖南湘仪离心机有限公司;ALPHA 1-4 LSC型冷冻干燥机:德国Christ公司;KJ2300型凯氏定氮仪:瑞典Foss公司;Zetasizer Nano-ZS90粒度仪:英国马尔文仪器公司;LVDV-II Pro型旋转粘度计:美国Brookfield公司;U-1810型紫外可见分光光度计:北京普析通用仪器有限责任公司;F-7000荧光分光光谱仪:日本日立高新技术公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
采用碱溶酸沉法自制。将低温脱脂豆粕粉碎,按料液比1∶10加入去离子水,用1 mol·L-1NaOH调节pH至8.0,室温下低速搅拌2 h后离心(8 000×g,30 min)。取上清液用1 mol·L-1HCl调节pH至4.5。4℃静置1 h至蛋白质析出后离心(8 000×g,10 min)。取出蛋白沉淀溶于去离子水,用1 mol·L-1NaOH调节pH至7.0。离心(8 000×g,10 min)去除不溶物。蛋白液于4℃透析48 h,冻干后得到SPI。凯氏定氮法测得蛋白质质量分数为90.5%(N×6.25)。
1.3.2 SPI纤维溶液的制备
将SPI冻干粉溶解于去离子水中,室温搅拌2 h后,调节pH值至2.0,4℃水化过夜。离心(10 000×g,30 min)后,凯氏定氮法测定上清液的蛋白含量。用去离子水(预调pH 2.0)将蛋白上清液稀释到60 g·L-1。将蛋白溶液置于带密封盖的小瓶中,85℃水浴加热20 h。加热结束后,将蛋白质样品冰浴冷却10 min,并置于4℃保存。
1.3.3 SPI冷凝胶的制备
根据Veerman等[13]的方法,SPI样品用1 mol·L-1和0.1 mol·L-1NaOH将pH调节至8.0。添加适量的CaCl2溶液至终浓度为50 mmol·L-1,将溶液充分混合,室温放置24 h后测定。
1.3.4 Th T荧光测定
将8 mg Th T溶于10 mL磷酸缓冲液中(10 mmol·L-1磷酸盐和150 mmol·L-1NaCl,pH 7.0)中,使用0.22μm滤膜过滤后制得Th T的储备液。用磷酸盐缓冲液稀释50倍制得工作液。将50μL的样品加入5 mL Th T工作液后测量。激发波长为460 nm,发射波长为490 nm。
1.3.5 ζ-电位测定
在pH 2.0~10.0范围内测量SPI和SPI纳米纤维溶液的ζ-电位。样品在预设的pH值下用双蒸水稀释到1 mg·mL-1的蛋白质浓度,然后用0.2 mol·L-1的NaOH或HCl调整到所需的pH值。
1.3.6 表观粘度测定
在室温下用旋转粘度计测量溶液的流变特性。每次测试中,将约50 mL样品倒入温控测量容器中,在3 s间隔内从1~100 s-1剪切。幂律模型参数由以下方程确定以表征溶液的流动行为:

其中η是表观粘度(Pa S),K是稠度系数(Pa Sn),γˉ是剪切速率(s-1),n是流动特性指数(无量纲)。
1.3.7 载药率及包封率测定
核黄素以1.0 mg·mL-1的浓度溶于水中。然后将核黄素溶液加入SPI纤维溶液(pH 8.0)中,最终核黄素浓度分别为50、100、150、200、250μg·mL-1。添加适量的CaCl2、溶液至终浓度为50 mmol·L-1,将溶液充分混合,室温放置24 h形成凝胶后离心(4 000×g,30 min)。用紫外-可见分光光度计在446 nm波长处测定核黄素渗滤液中核黄素的含量[10]。包封率(EE)和载药率(LC)计算如下:
包封率(EE)=凝胶中核黄素/总核黄素的质量×

1.3.8 模拟胃液和模拟肠液的制备
模拟胃液(SGF):1.0 g NaCl及3.5 mL浓盐酸定溶于500 mL双蒸水,最终pH值为1.20。测定前1 h添加3.2 g·L-1的胃蛋白酶。
模拟肠液(SIF):将6.8 g磷酸二氢钾溶于250 mL去离子水中,加入去离子水450 mL,然后加入190 mL 0.2 mol·L-1的Na OH溶液,用0.2 mo1·L-1NaOH将pH值调至7.5,最后用双蒸水定容至1 000 mL并于测定前1 h加入10.0 g·L-1胰蛋白酶。
1.3.9 溶胀实验
称取一定质量的凝胶,然后将它们浸泡在不含酶的胃液或肠液中,定期取出,轻轻擦拭并重新称重。溶胀度计算如下:
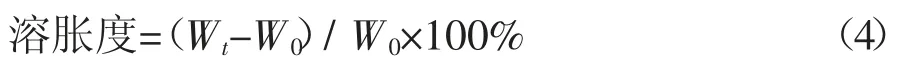
式中,Wt是在时间t的凝胶重量,W0是初始凝胶剂重量。
1.3.10 模拟胃肠液中的释放性能测定
取上述制备好的载药凝胶放入装有200 mL SGF和SIF的三角瓶中,置于37℃恒温振荡器中反应8 h,振荡速度100 r·min-1。为保证体积不变,每次取样3.5 mL的同时补充等量的模拟胃肠液。
1.4 统计分析
所有实验重复3次取均值,采用Origin 8.0软件作图。数据处理和分析采用SPSS 19.0软件。
2 结果与讨论
2.1 SPI纤维形成过程中Th T及ζ-电位的变化
硫磺素T(Th T)可以与纤维中分子间的β-折叠紧密结合[18],是一种可靠的淀粉样纤维定量技术,因为产生的荧光信号与纤维浓度成正比。如图1所示,天然SPI在pH为2.0时荧光强度较低。加热能够触发纤维的形成[19]。当SPI在85℃加热时,形成的纤维可以结合到Th T上,荧光强度随加热时间呈S形增加(图1),这证实了β-折叠存在于SPI纤维中。荧光在最初几小时变化不大(滞后期),然后迅速增加(生长期),表明在加热过程中形成了纤维,最后趋于平稳(稳定期),表明纤维逐渐进入成熟阶段,在此期间的自组装速率下降。Akkerman等[20]报道了SPI在85℃下加热可形成长的纤维状半弹性聚集体。随后将pH从2.0调整到8.0,SPI纤维荧光强度略低(数据未显示)。荧光强度的降低可能是由于纤维的部分β-折叠结构被破坏所致[21]。
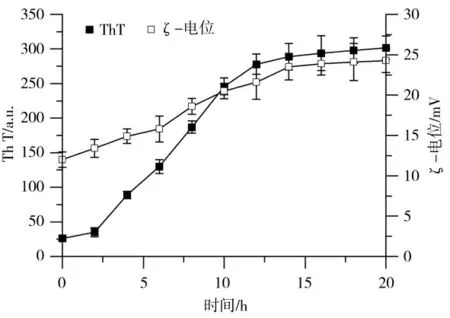
图1 SPI纤维形成过程中Th T及ζ-电位的变化Fig.1 Th T fluorescence andζ-potential of amyloid-like fibril formation of SPI
ζ-电位通常被认为是蛋白质悬浮液稳定性的指标,ζ-电位绝对值越高,稳定性越好[22]。SPI在pH 2.0时带正电荷,当pH低于其等电点时,氨基发生质子化,并随着加热时间增加,表面电荷达到了新的平衡。加热20 h后,ζ-电位值在21~25 mV之间,这与Liu等[23]结果一致。ζ-电位的增长可能是由于蛋白质在纤维化过程中发生变性、水解和结构单元自组装,导致了蛋白质的展开和带电基团的暴露[6]。这一观察结果与Th T荧光数据一致。
2.2 pH对SPI纤维ζ-电位的影响
如图2所示,将SPI纤维溶液的pH从2.0增加到10.0,SPI表面电荷由正向负变化。其等电点与天然SPI的等电点非常相似(pH~4.5)。在等电点时,由于纤维内和纤维间排斥的最小化,导致了纤维的不稳定性,纳米纤维发生破坏和聚集。由于没有静电斥力来减少纤维间和纤维内的相互作用,蛋白原纤维聚集并断裂成更短的片段[24]。中性pH下纤维的表面电荷量低于酸性pH下的纤维,说明带电基团暴露较少。在pH为8.0时(高于蛋白等电点),对照体系和纤维体系的ζ-电位没有显著差异。有报道指出,当β-乳球蛋白纤维溶液的pH值被调整到8时,仍然可以观察到线性纤维[12],纤维的断裂是一个相对缓慢的过程,完全解离可能需要很长时间。在此条件下,加入50 mmol·L-1CaCl2后,由于纤维间静电相互作用的屏蔽和Ca2+离子在SPI的带电或羧基之间形成盐桥的作用,形成冷凝胶。这种方法制备的纤维冷凝胶的最低蛋白质浓度比用传统冷凝胶法制备的最低浓度低。
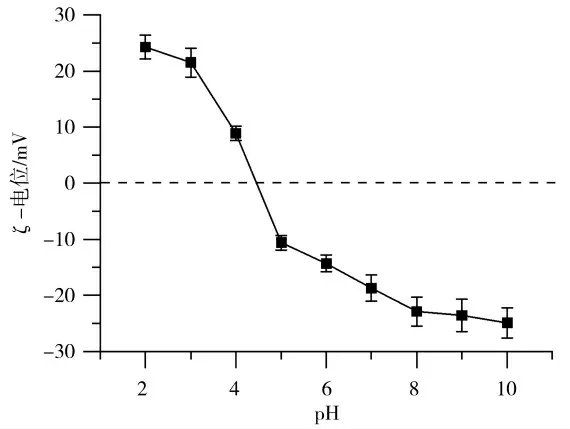
图2 pH对ζ-电位的影响Fig.2 Effect of pH onζ-potential
2.3 凝胶预溶液的粘度和流动特性
不同样品溶液的表观粘度随剪切速率的变化如图3所示,由幂律模型得到的流变参数见表1。溶液的粘度很大程度上取决于多肽的体积和分子间的相互作用。未加热的SPI溶液粘度较低,表现出牛顿流体行为。纤维溶液样品的粘度和剪切变稀程度均高于未加热的样品。这是由于蛋白溶液加热后发生变性,蛋白分子展开形成纳米纤维结构,流体力学直径增大以及形成具有高缠绕和形成密集网络能力的纳米纤维结构,导致SPI纤维溶液粘度急剧增加[25],这与Mohammadian等[26]的结果一致。将纤维溶液的pH调至8.0时,由于纤维骨架上电荷分布发生改变,导致分子间的相互作用减弱,n值略有上升,表明假塑性减弱,这与Zhang等[27]的结果一致。流变结果除了受分散体系中纤维的体积分数的影响,还会受到纤维刚性、纤维长度分布和基质的影响[3]。当pH值高于等电点时,纤维具有净负电荷,这有利于在pI时形成的聚集体的分散,但纤维由于中和过程发生断裂和长度缩短。SPI纤维溶液的粘度和稠度系数K随着pH的增加而下降,这可能是由于纤维的部分结构被破坏,与Th T结果一致。流变学结果表明性质,与天然蛋白相,SPI纤维溶液具有更高更大的尺寸,在pH 8.0时形成的缩短的纤维片段仍然具有较高的粘度,有助于改善凝胶性质。纤维缠绕产生密集的堆积结构,能够抵抗剪切场方向的流动。随着剪切速率进一步增加,纳米纤维结构逐渐解缠,表现出强烈的剪切变稀特性。SPI纤维的高粘度和剪切变稀表明它们具有良好的物理改性能力。
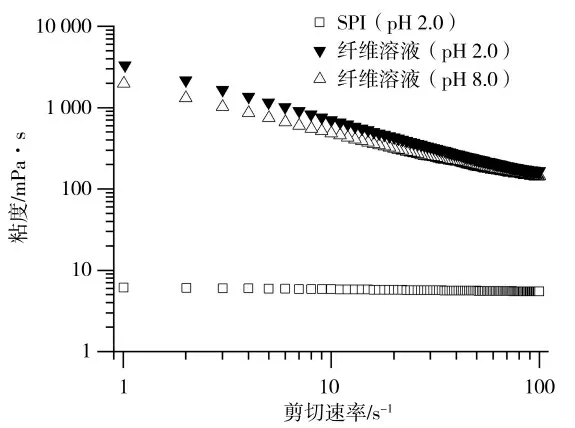
图3 不同蛋白溶液的表观粘度Fig.3 Apparent viscosity profiles of various soy protein dispersions
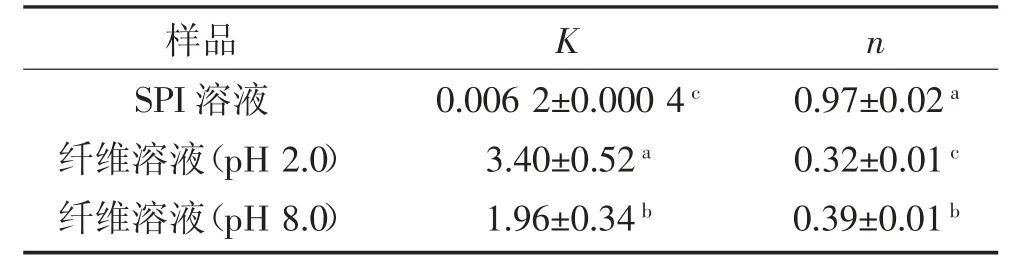
表1 SPI溶液、纤维溶液(Ph 2.0、8.0)的流变参数(n,K)Table 1 Rheological parameters(n,k)for the SPI dispersions before and after fibrillation process
2.4 溶胀实验
溶胀能力是纳米纤维凝胶的重要特征,这是由于在蛋白质结构中存在的亲水基团,如羟基、氨基和羧基。这种能力使蛋白质纳米凝胶成为封装和传递生物活性化合物的理想结构,同时也是其柔软和弹性特性的原因,是药物释放装置开发过程中需要考虑的一个重要参数[28]。大豆蛋白水凝胶是pH敏感装置,因为多肽链上存在酸性和碱性基团,可以接受或释放质子,以响应介质pH的变化[29]。通过未溶胀的聚合物的扩散比通过溶胀的聚合物慢得多。SGF(pH 1.2)和SIF(pH 7.5)中SPI纤维冷凝胶溶胀随时间的演变如图4所示。在酸性介质中浸泡24 h后,SPI纤维冷凝胶的溶胀率达到10%左右,这是由于蛋白质链上胺基的质子化所产生的静电斥力增强了水在网络中的扩散,羧基处于非离子化状态(-COOH),不与Ca2+交联,导致其结构疏松,促进了凝胶网络对水的吸收。放置在SIF(pH 7.5)中的凝胶,电离羧基(-COO-)可能通过与Ca2+形成盐桥而相互交联。钙进一步在磷酸盐缓冲液中沉淀,导致凝胶收缩,重量减少;凝胶可能会因分子重排而排出水分,减少孔隙度,从而防止溶胀。
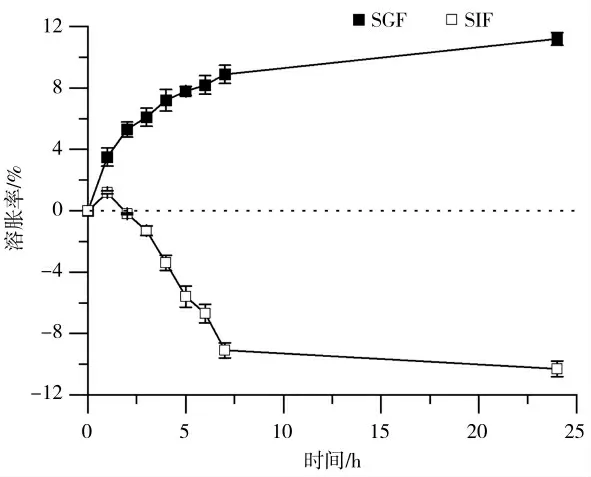
图4 SPI纤维冷凝胶在SGF、SIF中的溶胀24 h(25℃)Fig.4 SPI fibrillar cold gels swelling in SGF and SIF over a 24 h period at 25℃
2.5 荷载量和包封率
蛋白质纳米凝胶在食品应用中的使用可能会给含有热敏成分的配方带来一些限制—特别是当这些纳米系统是通过热凝胶生产的时候。此外,由于纤维凝胶是通过物理凝胶化产生的,在主干或交联中含有不稳定的键,这些键在生理条件下通过酶作用(在通过胃肠道的过程中)或者化学作用(通常是通过水解)容易受到破坏。因此,包埋在这种纳米结构中的成分可以被降解。纳米纤维冷凝胶的形成可能为食品蛋白作为热敏性营养食品化合物的载体提供机。确定包封性参数,特别是载体的包封率(EE)和载药量(LC),对于评估系统对特定药物的装载能力以及药物输送系统的治疗效果至关重要。因此,对SPI纳米纤维冷凝胶的核黄素包封率(EE)和载药量(LC)进行了测定。由图5可以看出,随着核黄素浓度的增加,凝胶中核黄素载药量(LC)呈线性增加,包封率(EE)先增加后降低。当核黄素浓度为200μg·mL-1时包封率达到86.6%,是制备核黄素纳米凝胶的最佳浓度。而天然SPI在这一蛋白浓度下(60 g·L-1)加热仍无法形成凝胶。因此,包封性参数的测定表明SPI纤维冷凝胶可以在较低蛋白浓度下用作药物的包封体,这有助于扩大核黄素在食品和药物制剂中的应用。
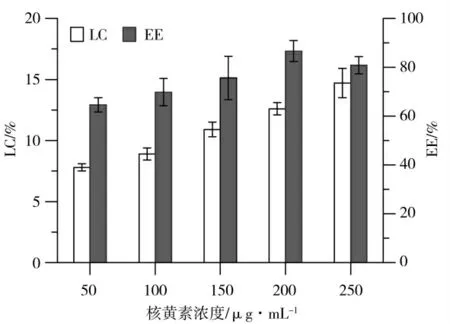
图5 不同核黄素浓度的SPI纤维冷凝胶载药量和包封率Fig.5 Drug encapsulations,loaded efficiencies of SPI fibrillar cold gels in different riboflavin concentrations
2.6 核黄素在模拟胃肠液的释放行为
给药系统的一个重要属性是其药物释放过程,药物释放过程受到不同因素的影响,例如材料基质的性质(组成、结构、膨胀和降解)、释放介质(pH、温度、离子强度和酶)以及药物(溶解性、稳定性、电荷和可能与基质的相互作用。而在模拟生理条件下测定药物释放系统的药物释放行为是非常重要的,因为它与所获得的载体对人体健康的有效性密切相关。在模拟胃肠道条件下,核黄素从SPI纤维冷凝胶的体外释放行为如图6所示。凝胶中的核黄素均随着消化时间的延长而释放。在初始120 min内,核黄素释放最快,释放量达到43.6%;当消化240 min时,核黄素释放量基本趋于稳定,释放量达到55%。说明大豆蛋白纤维冷凝胶载体在SGF中对核黄素起到了控制-释放作用。释放率的变化结果与凝胶溶胀的观察结果一致。SIF中凝胶的破坏有助于核黄素释放速率的增加,而SGF中较小的溶胀则转化为缓慢的扩散。此外,SGF中基质对水的吸收有助于稀释内部核黄素浓度,降低核黄素从基质流向溶解介质。刘晶等[30]的研究表明芸豆蛋白的纤维凝胶对咖啡因的具有缓释效果。
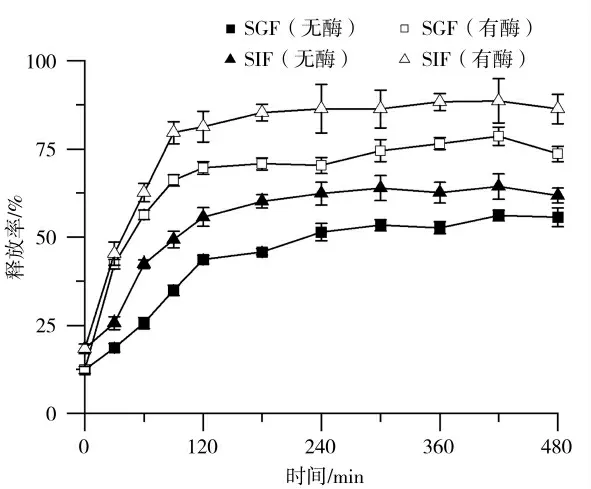
图6 添加酶前后载药SPI纤维冷凝胶在SGF、SIF中的核黄素释放率Fig.6 Riboflavin release from SPI fibrillar cold gels in stimulated gastric fluid(SGF)and stimulated intestinal fluid(SIF)with and without enzyme
消化酶的存在是影响蛋白质凝胶控释性能的另一个重要因素。这是由于消化酶能够分解蛋白质基质,从而加速分子的释放。添加胃蛋白酶能够提高核黄素的释放量,主要是由于胃蛋白酶水解蛋白凝胶,使得凝胶网络结构被破坏,蛋白质之间的相互作用减弱,核黄素迅速扩散。与SGF中核黄素的释放曲线类似,SPI纤维冷凝胶在初始120 min内,快速释放核黄素;当消化240 min时,核黄素释放量为66%且基本趋于稳定。添加胰蛋白酶后核黄素的释放量升高至88%。体外评价表明,SPI纤维冷凝胶在胃肠道模拟介质中表现出明显的缓释行为,这可以扩大其在生物活性化合物和药物的定点递送方面的应用。
3 结论
SPI在pH 2.0下加热20 h后形成的纤维,导致Th T荧光、ζ-电位、表观粘度上升。然后将pH调至8.0,并加入CaCl2制得冷凝胶。与传统的SPI凝胶相比,这种纤维冷凝胶可以在较低的蛋白浓度下形成凝胶网络,可将其用作核黄素载体。随着核黄素浓度的增加,凝胶中核黄素载药量呈线性增加,包封率先增加后降低。当核黄素浓度为200μg·mL-1时包封率达到86.6%,是制备核黄素纳米凝胶的最佳浓度。在模拟胃肠道条件下的核黄素体外释放实验也表明,SPI纤维冷凝胶表现出明显的缓释行为,可以用作核黄素的包封体。综上所述,SPI纤维冷凝胶可以作为一种潜在的多功能载体,在较低的蛋白浓度下,将核黄素引入到食品的配方中,从而改善其保健属性。

