首荟通便胶囊对慢性传输性便秘小鼠肠道屏障的影响
李翔子,李市荣,杨田野,周继栋,姚景春*,张贵民*
首荟通便胶囊对慢性传输性便秘小鼠肠道屏障的影响
李翔子1, 2, 3,李市荣1, 2, 3,杨田野1, 2, 3,周继栋1, 2, 3,姚景春1, 2, 3*,张贵民1, 2, 3*
1.鲁南制药集团股份有限公司 新药药理中心,山东 临沂 276006 2.中药制药共性技术国家重点实验室,山东 临沂 276006 3.临沂市天然药物免疫药理毒理重点实验室,山东 临沂 276006
研究首荟通便胶囊对慢性传输性便秘小鼠肠道屏障的影响。48只ICR小鼠随机分成对照组、模型组和首荟通便胶囊(300 mg/kg)组,小鼠ig复方地芬诺酯(10 mg/kg)建立便秘模型,同时给予药物进行干预。实验结束后,检测小鼠肠蠕动和排便功能,采用ELISA法检测小鼠血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和-乳酸水平;采用苏木素-伊红(HE)染色法考察小鼠结肠组织病理变化;采用Western blotting检测小鼠结肠组织紧密连接蛋白-1(zonula occludens-1,ZO-1)、Occludin、Claudin 5、基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)、MMP-2和金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)的蛋白表达情况。与对照组相比,模型组小鼠排便功能和肠蠕动功能降低(<0.05、0.01),肠道炎性细胞浸润明显;血清中-乳酸和TNF-α水平显著升高(<0.05、0.01);结肠组织Claudin 5、Occludin、ZO-1和TIMP-1蛋白表达水平降低(<0.05、0.01),MMP-2和MMP-9蛋白表达水平升高(<0.05)。与模型组相比,首荟通便胶囊组小鼠排便功能和肠蠕动功能增强(<0.05、0.01),肠道炎性细胞浸润减少;血清中-乳酸和TNF-α水平降低(<0.05);结肠组织Claudin 5、Occludin、ZO-1和TIMP-1蛋白表达水平升高(<0.05、0.01),MMP-2和MMP-9蛋白表达水平降低(<0.05)。首荟通便胶囊能够治疗小鼠便秘,其机制可能与降低便秘小鼠肠道炎症和通透性、调节肠道屏障相关蛋白的表达以及保护肠道屏障有关。
首荟通便胶囊;慢性传输性便秘;炎症;肠道通透性;肠道屏障
便秘是一种临床常见的肠道疾病,主要分为结肠慢传输型便秘、排便障碍型便秘、混合型便秘3类[1]。结肠慢传输型便秘主要表现为结肠动力不足,粪便较难或难以通过结肠,最终滞留于肠道内部,导致排便时间延长、排便困难[2]。经统计,由于生理机制、身体机能等多方面的影响,女性、老人、儿童肥胖者往往是便秘的多发人群[1,3]。首荟通便胶囊由何首乌、芦荟、决明子、枸杞子、阿胶、人参、白术、枳实组成,临床常用于治疗便秘,对不同年龄层患者、肿瘤患者及术后便秘者治疗效果良好,但目前其作用机制并不明确[4-7]。本研究采用复方地芬诺酯诱导小鼠便秘模型[8],探究首荟通便胶囊治疗便秘的作用机制。
1 材料
1.1 动物
SPF级雌性ICR小鼠48只,6~8周,体质量22~26 g,购自济南朋悦实验动物繁育有限公司,动物生产许可证号SCXK(鲁)20190003,使用许可证号SYXK(鲁)20180008。动物于SPF级实验室饲养,自由进食饮水。动物实验经鲁南制药集团股份有限公司新药药理中心实验动物管理与使用委员会批准(批准号HN-IACUC-2021-047)。
1.2 药品与试剂
首荟通便胶囊(国药准字Z20150041,批号41420005)购自鲁南厚普制药有限公司;复方地芬诺酯(国药准字H32022716,批号1503030)购自常州康普药业有限公司;-乳酸检测试剂盒购自上海越研生物科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒购自上海酶联生物科技有限公司;紧密连接蛋白-1(zonula occludens-1,ZO-1)、Occludin、Claudin 5、基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)、MMP-2、金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)、β-actin抗体购自英国Abcam公司;二抗购自碧云天生物技术有限公司。
1.3 仪器
DYY-6D型电泳仪(北京六一生物科技有限公司);化学发光成像系统(上海勤翔科学仪器有限公司);Sorvall STR Plus高速冷冻离心机(美国Thermo Fisher Scientific公司);MK3酶标仪(上海热电仪器有限公司)。
2 方法
2.1 便秘模型的建立及给药
ICR小鼠检疫7 d后,剔除不合格动物。按体质量随机分为对照组、模型组和首荟通便胶囊(300 mg/kg,相当于临床等效剂量)组,每组16只。每天9: 00时模型组和给药组ig复方地芬诺酯(10 mg/kg),对照组ig等体积纯水;15: 00时给药组ig首荟通便胶囊(10 mL/kg),对照组和模型组ig等体积纯水。实验期间对照组自由饮水,其他组不给水,连续造模并给药14 d。末次给药后各组动物随机分成2部分,分别进行排便功能和肠蠕动功能的检测。
2.2 各组小鼠排便功能的检测
末次给药后,各组动物禁食16 h(饮水不限),模型组和给药组ig复方地芬诺酯(10 mg/kg),对照组ig等体积纯水;30 min后,对照组和模型组ig墨汁,给药组ig含首荟通便胶囊的墨汁(20 mL/kg),立即将每只动物单独饲养,同时开始计时,并供给饲料和饮水,观察并记录每只动物首次排黑便所需时间。
2.3 各组小鼠肠蠕动功能的检测
按“2.2”项下方法处理,小鼠ig墨汁25 min后脱颈椎处死,剖腹取幽门至回盲部的肠管,平铺测量小肠总长度和墨汁前端到幽门的距离,计算墨汁推进率。
墨汁推进率=墨汁前端到幽门的距离/小肠总长度
2.4 各组小鼠血清TNF-α及D-乳酸水平的检测
取各组小鼠血液,室温放置2 h,1000×离心20 min,取上清,−20 ℃保存。按试剂盒说明书检测小鼠血清中TNF-α及-乳酸水平。
2.5 各组小鼠结肠组织病理变化
取各组小鼠结肠组织,于甲醛中固定后,经梯度乙醇脱水并制作石蜡切片,石蜡切片经过脱蜡至水、染色、脱水、透明、封片等步骤后,于显微镜下观察结肠黏膜病理变化。
2.6 各组小鼠结肠组织肠道屏障相关蛋白的表达情况
取各组小鼠结肠组织,剪碎后加入裂解液,于组织匀浆机中匀浆,离心取上清。通过蛋白定量变性、电泳、转膜、封闭、一抗孵育、二抗孵育、显影等步骤,检测结肠组织中肠道屏障相关蛋白ZO-1、Occludin、Claudin 5、MMP-9、MMP-2和TIMP-1的表达情况。
2.7 统计学分析
使用SPSS 19.0统计学软件对数据进行检验和方差分析,所有数据以表示。
3 结果
3.1 首荟通便胶囊对便秘小鼠排便功能和肠蠕动功能的影响
如表1所示,与对照组比较,模型组小鼠首粒黑便时间明显延长,墨汁推进率显著降低(<0.01);与模型组比较,给药组小鼠首粒黑便时间明显缩短(<0.05),墨汁推进率显著升高(<0.01),表明首荟通便胶囊能够改善肠道蠕动功能,对小鼠便秘有很好的疗效。
3.2 首荟通便胶囊对便秘小鼠血清TNF-α及D-乳酸水平的影响
-乳酸是临床常用的肠道屏障检测指标,血清中-乳酸水平在一定程度上反映了肠道通透性的变化[9]。如表2所示,与对照组比较,模型组小鼠血清中TNF-α和-乳酸水平显著升高(<0.05、0.01);与模型组比较,给药组血清中TNF-α和-乳酸水平显著降低(<0.05),表明首荟通便胶囊能够有效改善便秘小鼠的肠道炎症和通透性。
表1 首荟通便胶囊对便秘小鼠墨汁推进率和首粒黑便时间的影响(, n = 8)
Table 1 Effect of Shouhui Tongbian Capsules on ink advancement rate and time of first black stool in constipated mice (, n = 8)

表1 首荟通便胶囊对便秘小鼠墨汁推进率和首粒黑便时间的影响(, n = 8)
组别剂量/ (mg·kg−1)墨汁推进率/%首粒黑便时间/ min 对照—98.51±2.59189.75±62.64 模型—66.55±7.27**314.00±43.85** 首荟通便胶囊30080.50±7.35##243.50±27.44#
与对照组比较:*<0.05**<0.01;与模型组比较:#<0.05##<0.01,下表同
*< 0.05**< 0.01control group;#< 0.05##< 0.01model group, same as below tables
表2 首荟通便胶囊对便秘小鼠血清中TNF-α和D-乳酸水平的影响(, n = 8)
Table 2 Effect of Shouhui Tongbian Capsules on TNF-α and D-lactic acid levels in serum of constipated mice (, n = 8)
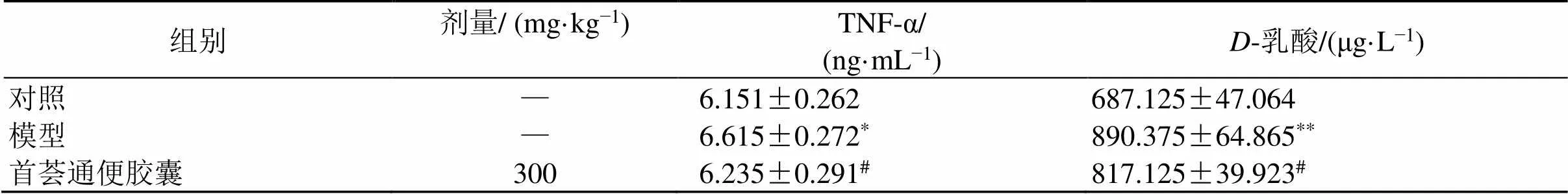
表2 首荟通便胶囊对便秘小鼠血清中TNF-α和D-乳酸水平的影响(, n = 8)
组别剂量/ (mg·kg−1)TNF-α/(ng·mL−1)D-乳酸/(μg·L−1) 对照—6.151±0.262687.125±47.064 模型—6.615±0.272*890.375±64.865** 首荟通便胶囊3006.235±0.291#817.125±39.923#
3.3 首荟通便胶囊对便秘小鼠结肠组织病理变化的影响
如图1所示,对照组小鼠结肠各段组织结构正常,模型组小鼠结肠组织肠壁较对照组明显变薄,黏液层厚度变薄,结肠黏膜有大量嗜酸性粒细胞、淋巴细胞及浆细胞浸润;与模型组相比,首荟通便胶囊组小鼠结肠结构基本正常,结肠黏膜有少量炎性细胞浸润,黏液层厚度增厚。
3.4 首荟通便胶囊对便秘小鼠结肠组织肠道屏障相关蛋白表达的影响
如图2和表3所示,与对照组比较,模型组小鼠结肠组织Occludin、Claudin 5、ZO-1和TIMP-1蛋白表达水平显著降低(<0.05、0.01),MMP-9和MMP-2蛋白表达水平显著升高(<0.01);与模型组比较,首荟通便胶囊组小鼠结肠组织Occludin、Claudin 5、ZO-1和TIMP-1蛋白表达水平显著升高(<0.05、0.01),MMP-9和MMP-2蛋白表达水平显著降低(<0.05)。
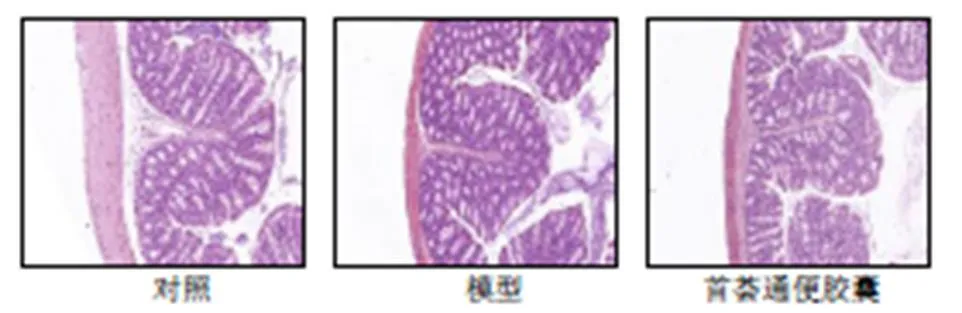
图1 首荟通便胶囊对便秘小鼠结肠组织病理变化的影响(HE, ×200)

图2 首荟通便胶囊对便秘小鼠肠道屏障相关蛋白的影响
表3 首荟通便胶囊对便秘小鼠肠道屏障相关蛋白的影响(, n = 8)
Table 3 Effects of Shouhui Tongbian Capsules on intestinal barrier-related proteins in constipated mice (, n = 8)

表3 首荟通便胶囊对便秘小鼠肠道屏障相关蛋白的影响(, n = 8)
组别剂量/ (mg·kg−1)蛋白相对表达量 OccludinMMP-9Claudin 5ZO-1MMP-2TIMP1 对照—0.843±0.0080.597±0.0220.835±0.0190.796±0.0460.781±0.0270.892±0.004 模型—0.725±0.029**0.756±0.055**0.734±0.018**0.465±0.112*0.902±0.018**0.736±0.091* 首荟通便胶囊3000.818±0.046#0.636±0.031#0.824±0.009##0.742±0.034#0.734±0.088#0.913±0.051#
4 讨论
首荟通便胶囊是一款传统的中药复方制剂,其成分主要有何首乌、芦荟、决明子、枸杞子、阿胶、人参、白术和枳实[10-11]。中医的传统理念中,便秘属津虚血少症,是由于燥热内蕴、津液亏虚肠道失润而导致,而首荟通便胶囊具有养阴益气、补泻兼施的功效,对便秘有良好的效果[12]。本研究发现,首荟通便胶囊能够有效减少慢传输型便秘小鼠首粒黑便时间,增加其墨汁推进率,对便秘小鼠的排便功能和肠蠕动功能有良好的改善作用。
肠道屏障包括机械屏障、免疫屏障、生物屏障和化学屏障,是肠道与外界接触的第一道屏障,对减少病原体的侵袭、毒素的吸收有极其重要的作用[13]。-乳酸是临床常用的肠道屏障检测指标,血清中-乳酸的水平反映了肠道通透性的变化[9]。当肠道屏障受损时,肠黏膜通透性增加,肠道中细菌产生的-乳酸会进入血液,导致血液中-乳酸水平升高[14]。本研究发现便秘会导致小鼠血清-乳酸水平升高,给予首荟通便胶囊干预后小鼠血清-乳酸水平下降,表明首荟通便胶囊能够有效地保护肠道屏障,改善便秘导致的肠道通透性增加。
ZO-1、Occludins和Claudins等连接蛋白是肠道屏障中机械屏障的重要组成部分[13]。大量研究发现炎症与肠道屏障密切相关,不同促炎细胞因子可通过不同方式影响紧密连接结构和功能,进而破坏肠黏膜屏障[15-16]。研究发现,TNF-α可通过肌球蛋白轻链激酶(myosin light chain kinase,MLCK)/肌球蛋白轻链(myosin light chain,MLC)信号通路重塑细胞骨架微丝,导致紧密连接前的肌动球蛋白环收缩,引起Occludin、ZO-1等紧密连接蛋白及周围细胞骨架蛋白重新分布,使得紧密连接结构移位,细胞旁通路开放,肠黏膜通透性增加[17]。本研究发现慢传输型便秘会导致小鼠血清TNF-α水平升高,Occludin和ZO-1蛋白表达水平降低,而首荟通便胶囊能够降低便秘小鼠血清TNF-α水平,升高Occludin和ZO-1蛋白表达水平。
Claudin 5作为细胞间紧密连接的主要功能蛋白,能够通过细胞屏障、细胞旁路转运和信号转导保持细胞内环境的平衡,同时促进MMP-2的激活[18]。王海波等[19]发现TNF-α可以促进MMP-2和MMP-9的过表达,导致细胞外基质、基膜的破坏,使炎性细胞进一步浸润到更深层次的组织中。而TIMP-1能够抑制MMPs活性,抑制基质降解[18]。本研究结果显示,首荟通便胶囊能够通过降低便秘小鼠血清TNF-α水平,上调TIMP-1蛋白表达水平从而抑制MMP-2和MMP-9的表达,减轻其对肠道屏障的破坏,同时上调Claudin 5蛋白表达水平,保护便秘小鼠肠道屏障。
综上,首荟通便胶囊能够改善慢传输型便秘小鼠的排便功能和肠蠕动功能,保护便秘小鼠的肠道屏障,其机制可能与降低便秘小鼠血清TNF-α水平,上调肠道组织中Claudin 5、Occludin、ZO-1和TIMP-1蛋白的表达,下调MMP-2和MMP-9蛋白的表达有关。
利益冲突 所有作者均声明不存在利益冲突
[1] 王佩佩, 罗雯, 禹铮, 等.慢性便秘的研究进展 [J].中国全科医学, 2017, 20(3): 370-374.
[2] 朱国栋, 朱安龙.慢传输型便秘病因机制研究进展 [J].医学综述, 2020, 26(23): 4623-4628.
[3] 王慧静, 陈佳良, 姚树坤.功能性便秘患者的社会人口学特征与精神心理状况研究进展 [J].医学综述, 2019, 25(16): 3146-3150.
[4] 李长征, 程国良.首荟通便胶囊治疗肿瘤患者化疗后便秘的疗效观察 [J].中国老年保健医学, 2020, 18(3): 57-59.
[5] 路越, 张虹玺, 韩宝, 等.首荟通便胶囊治疗功能性便秘的临床疗效研究 [J].世界中医药, 2020, 15(22): 3434-3438.
[6] 付曦, 张敏, 余朝萍.首荟通便胶囊治疗腹腔镜术后腹胀的疗效观察 [J].药物评价研究, 2021, 44(2): 394-397.
[7] 许晨, 刘婷婷, 李明森, 等.首荟通便胶囊治疗老年功能性便秘(虚秘证)的疗效观察[J].现代药物与临床, 2021, 36(2): 298-301.
[8] 马黎倩, 李成荫, 汪悦.增液汤对慢传输型便秘模型小鼠结肠VIP及AQP3表达的影响[J].北京中医药大学学报, 2015, 38(8): 532-534.
[9] 龙厚东, 陈晓旦, 郭善禹, 等.血清D-乳酸、HDC、PCT联合检测对腹部手术患者肠道屏障受损的预测价值 [J].国际检验医学杂志, 2021, 42(9): 1037-1040.
[10] 梁红宝, 李蕊, 姚景春, 等.基于网络药理学和分子对接方法研究首荟通便胶囊治疗便秘的作用机制 [J].中国中药杂志, 2021, 46(3): 511-519.
[11] 彭艳, 陶箭飞.HPLC-MS/MS法同时测定首荟通便胶囊中8种成份分析 [J].世界中医药, 2020, 15(14): 2048-2052.
[12] 郑舒泽, 郭强, 张贵民, 等.首荟通便胶囊对慢传输型便秘模型小鼠的治疗作用及机制研究 [J].中国中药杂志, 2021, 46(3): 520-525.
[13] 易俊, 刘小伟.炎症性肠病的肠道屏障功能研究进展 [J].中华炎性肠病杂志, 2019, 3(1): 41-44.
[14] 尉浩斌, 张小丹, 李苏宜.肠屏障功能损伤机制及其临床检测方法研究现状 [J].肿瘤代谢与营养电子杂志, 2020, 7(4): 407-414.
[15] Guo Y J, Li H L, Liu Z,.Impaired intestinal barrier function in a mouse model of hyperuricemia [J]., 2019, 20(4): 3292-3300.
[16] Shen S M, Zhao J J, Dai Y C,.Methamphetamine-induced alterations in intestinal mucosal barrier function occur via the microRNA-181c/ TNF-α/tight junction axis [J]., 2020, 321: 73-82.
[17] 王晓红, 刘芳, 张胜, 等.一氧化碳释放分子2对休克大鼠肠黏膜上皮屏障的保护作用 [J].中华急诊医学杂志, 2019, 28(1): 50-55.
[18] 张剑锋, 张凯, 侯英奎.基质金属蛋白酶-9 (MMP-9) 及其组织抑制因子-1 (TIMP-1) 在结直肠癌治疗前后的表达及其意义 [J].实用癌症杂志, 2018, 33(9): 1411-1414.
[19] 王海波, 俞为荣.MMP-2/MMP-9在炎症中的研究进展 [J].医学综述, 2014, 20(17): 3120-3122.
Effect of Shouhui Tongbian Capsules on intestinal barrier in mice with chronic transit constipation
LI Xiang-zi1, 2, 3, LI Shi-rong1, 2, 3, YANG Tian-ye1, 2, 3, ZHOU Ji-dong1, 2, 3, YAO Jing-chun1, 2, 3, ZHANG Gui-min1, 2, 3
1.New Drug Pharmacology Center of Lunan Pharmaceutical Group Co., Ltd., Linyi 276006, China 2.State Key Laboratory of Generic Technology of Traditional Chinese Medicine, Linyi 276006, China 3.Linyi Key Laboratory of Immunopharmacology and Toxicology of Natural Drugs, Linyi 276006, China
To study the effect of Shouhui Tongbian Capsules (首荟通便胶囊) on intestinal barrier of mice with chronic transitive constipation.Forty-eight mice were randomly divided into control group, model group and Shouhui Tongbian Capsules (300 mg/kg) group, constipation model was established by ig compound diphenoxylate (10 mg/kg), at the same time, drugs were given for intervention.After the experiment, bowel motility and defecation function of mice were detected, tumor necrosis factor-α (TNF-α) and-lactic acid levels in serum were detected by ELISA; Pathological changes of colon tissue in mice were observed by HE; Western blotting was used to detect the protein expressions of zonula occludens-1 (ZO-1), Occludin, Claudin 5, matrix metalloprotein-9 (MMP-9), MMP-2 and tissue inhibitor of metalloproteinase-1 (TIMP-1) in colon tissue of mice.Compared with control group, defecation function and bowel motility function of mice in model group were reduced (< 0.05, 0.01), infiltration of intestinal inflammatory cells was obvious;-lactic acid and TNF-α levels in serum were increased (< 0.05, 0.01); Claudin5, Occludin, ZO-1 and TIMP-1 protein expressions in colon tissue were decreased (< 0.05, 0.01), MMP-2 and MMP-9 protein expressions were increased (< 0.05).Compared with model group, bowel function and bowel motility function of mice in Shouhui Tongbian Capsules group were increased (< 0.05, 0.01), inflammatory infiltration of intestinal tissue cells was decreased;-lactic acid and TNF-α levels in serum were decreased (< 0.05); Claudin5, Occludin, ZO-1 and TIMP-1 protein expressions in colon tissue were increased (< 0.05, 0.01), MMP-2 and MMP-9 protein expressions were decreased (< 0.05).Shouhui Tongbian Capsules can treat constipation in mice, its mechanism may be related to reducing intestinal inflammation and permeability, regulating the expression of intestinal barrier-related proteins and protecting the intestinal barrier.
Shouhui Tongbian Capsules; chronic transit constipation; inflammation;permeability; intestinal barrier
R285.5
A
0253 - 2670(2022)05 - 1458 - 05
10.7501/j.issn.0253-2670.2022.05.021
2021-11-04
国家“重大新药创制”科技重大专项(2018ZX09201010)
李翔子(1991—),男,硕士,主要从事新药药理学研究。E-mail: 2642623957@qq.com
通信作者:姚景春,研究员,主要从事创新药物研发。E-mail: yaojingchun@yeah.net
张贵民,研究员,主要从事创新药物研发。E-mail: lunanzhangguimin@year.net
[责任编辑 李亚楠]