HLA-DQB2基因多态性与中国西部人群抗结核药物致肝损伤的关联性研究
江 硕,赵珍珍,周 娟,应斌武
四川大学华西医院实验医学科,四川成都 610000
结核病是威胁人类健康的全球流行性疾病,中国作为高结核病负担国,控制结核病发病率,降低致残率及致死率尤为重要。抗结核药物致肝损伤(ATDH)是抗结核药物治疗期间出现的严重不良反应,将导致患者治疗效果不佳、治疗中断,极大地增加患者的致残率和病死率[1]。目前临床治疗结核病的一线药物包括异烟肼、利福平、吡嗪酰胺、乙胺丁醇及链霉素,根据地域及纳入排除标准不同,2%~28%的患者可出现ATDH[2]。目前关于ATDH遗传危险因素的研究主要集中于药物代谢酶及转运蛋白,包括细胞色素P450家族2E1(CYP2E1)、N-乙酰转移酶-2(NAT2)、谷胱甘肽S-转移酶[谷胱甘肽S-转移酶mu1(GSTM1)和谷胱甘肽S-转移酶β1(GSTT1)]和SLCO1A2[3-4]。研究表明,先天性及适应性免疫系统参与是导致药物致肝损伤后肝细胞死亡的原因之一,细胞凋亡过程中细胞因子及CD4+T细胞被免疫反应激活,对肝细胞产生杀伤作用,参与反应的活化T细胞主要受主要组织相容性复合体(MHC)Ⅰ类及Ⅱ类分子调控[5-6]。人类白细胞抗原(HLA)是机体免疫反应的重要组成部分,有研究报道HLA基因多态性与药物致肝损伤的发生密切相关[7-8]。目前,较少有研究报道人类白细胞抗原DQB2(HLA-DQB2)与ATDH发生有关,本研究旨在探讨中国西部汉族人群HLA-DQB2基因多态性与ATDH发生、发展之间可能存在的关联,以期为临床医生监测患者肝毒性并预测ATDH的发生提供参考。
1 资料与方法
1.1一般资料 本研究中使用的所有样品均来自本院实验医学科“结核病研究”资源生物库。共纳入2016年12月至2018年4月本院1 060例高度怀疑为结核病的患者。试验开始前,均获得患者及家属知情同意。所有受试者均接受6~8个月一线抗结核药物联合治疗。方案包含两个连续阶段:第1阶段为开始治疗的前2个月,使用异烟肼(300 mg/d)、利福平(600 mg/d,若体质量<50 kg)、吡嗪酰胺(1 500 mg/d)和乙胺丁醇(750 mg/d);第2阶段(后4个月)使用相同剂量的异烟肼、利福平和乙胺丁醇进行继续治疗。剔除依从性差、失访和转用二线药物的患者后,共纳入746例结核病患者,其中包括118例ATDH患者(ATDH组)和628例非ATDH受试者(非ATDH组)。根据结核病指南[9],所有患者均通过临床症状、微生物和(或)影像学证据等进行结核病确认。本研究得到了本院临床试验和生物医学伦理委员会的批准。
1.2ATDH诊断标准 本研究纳入的所有ATDH病例均符合《美国传染病学会临床实践指南:药物敏感结核病的治疗》[10]推荐的纳入标准:(1)使用抗结核药物治疗前患者血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、血清碱性磷酸酶(ALP)、γ-谷氨酰转移酶(GGT)、总胆红素(TBIL)均正常;(2)在治疗过程中,患者出现血清ALT或AST水平升高,为正常范围上限(ULN)3倍(120 IU/L)及以上,并伴有肝炎症状及体征,如恶心、发热、黄疸、呕吐及腹痛,或血清AST或ALT水平为ULN 5倍(150 IU/L)及以上;(3)血清ALP水平为ULN 2倍(80 IU/L)及以上,且伴血清GGT水平升高;(4)血清ALT、AST或ALP水平升高为ULN 3倍(120 IU/L)及以上,同时伴有血清TBIL为ULN 2倍(56 μmol/L)及以上,但没有肝炎症状或不符合吉尔伯特综合征诊断。
1.3方法
1.3.1临床资料收集 通过电子病历系统收集患者所有数据,包括人口统计学资料、常见临床症状(发热、体质量减轻、盗汗、食欲不振、乏力等)及实验室指标。实验方案要求本研究的所有参与者在接受抗结核治疗后的前2月每2周进行1次临床实验室血液检测,后4个月每月检测1次直到治疗结束。此外,还叮嘱患者注意肝毒性症状及体征,包括黄疸、恶心、呕吐、腹胀、腹痛等,临床医生负责鉴别相关症状并进行实验室血液检查,记录与肝损伤相关的实验室指标,以评估ATDH。
1.3.2候选基因多态性选择及基因分型 HLA-DQB2基因变异数据来自dbSNP数据库(http://www.ncbi.nlm.nih.gov/projects/SNP/),根据以下规则:(1)中国北京汉族人群的次要等位基因频率(MAF)为0.05或以上;(2)排除连锁不平衡≥97%的单核苷酸多态性位点(SNPs)。本研究最终选择了6个SNPs(rs2395253、rs11759423、rs1573646、rs6902723、rs35439528、rs6925976)。
每例患者采集3 mL EDTA抗凝全血,采用德国Qiagen公司提供的QIAamp DNA Blood Mini Kit核酸提取试剂盒,严格按照试剂盒操作指南进行DNA提取。使用定制的48-Plex SNPscanTMKit(上海天昊生物科技公司)试剂盒进行SNPs基因分型。为保证基因分型质量,随机抽取所有标本的10%进行重复基因分型。

2 结 果
2.1患者临床特征与实验室指标 本研究共纳入746例患者,均为汉族。本研究中ATDH的发生率为15.82%(118/746)。ATDH组和非ATDH组的性别、年龄、体质量指数(BMI)、乙型或丙型肝炎病毒感染情况、保肝药物的使用率、吸烟情况等比较,差异无统计学意义(P>0.05)。ATDH组中104例患者为首次接受抗结核治疗,均未使用过保肝药物。受试者的全身症状中发热和体质量减轻患者所占比例在两组间差异有统计学意义(P<0.05)。ATDH组患者ALT、AST、ALP、GGT、TBIL水平明显高于非ATDH组患者(P<0.05)。 见表1~2。
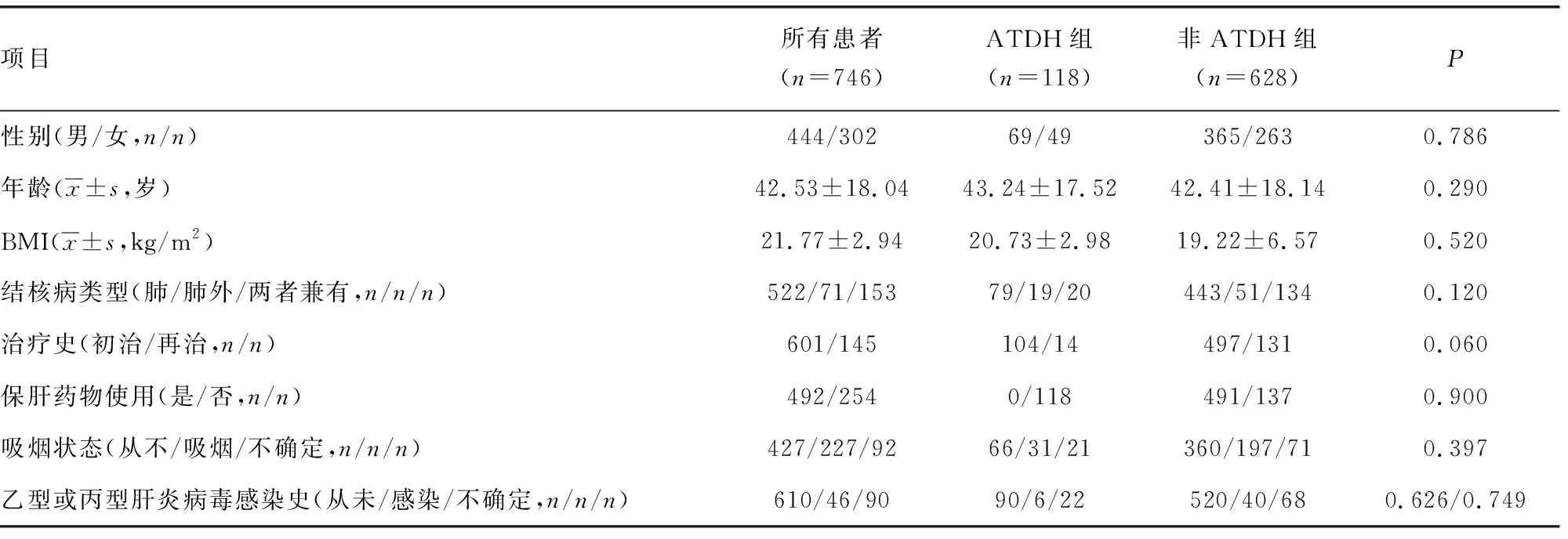
表1 研究对象的一般资料

表2 研究对象临床特征及实验室结果
2.2HLA-DQB2基因多态性与ATDH易感性分析
2.2.1基因分型结果 将SNPs位点分型不成功的部分研究对象剔除后,最终纳入分析的rs1573646、rs2395253、rs6902723、rs11759423、rs35439528、rs6925976位点的ATDH组例数分别为115、117、118、116、116、117例,非ATDH组的最终分析例数为618、627、628、628、628、628例。表3中详细列出各SNPs信息,HLA-DQB2基因型分布中非ATDH患者SNPs均未偏离HWE平衡(所有位点P>0.05)。
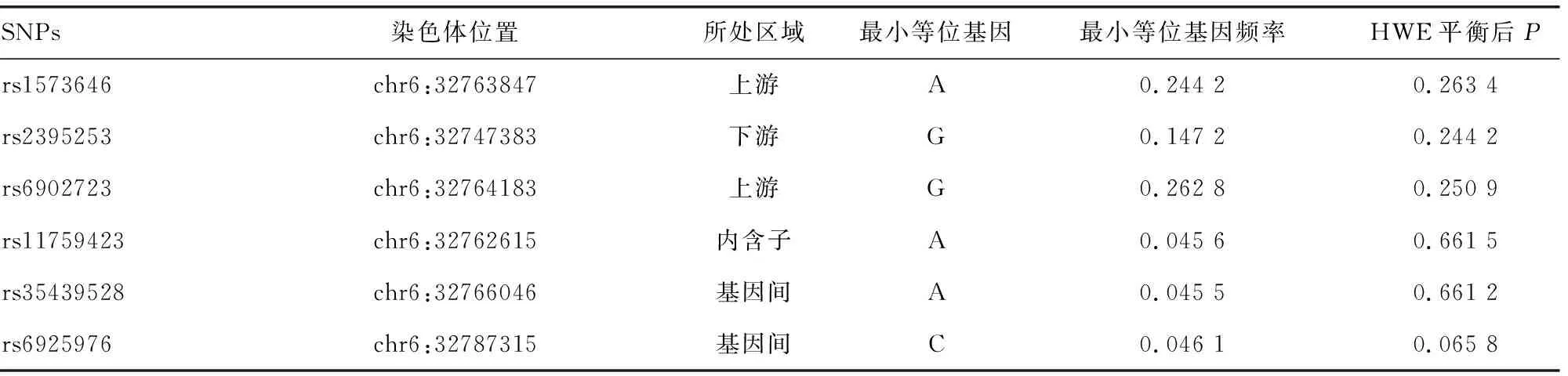
表3 HLA-DQB2基因的一般特征
2.2.2SNPs等位基因和基因型分析 在纳入分析的6个SNPs位点中,rs1573646的等位基因频率分布及基因型频率分布在两组间的差异均有统计学意义(P<0.05)。rs1573646 A等位基因携带者相对于C等位基因携带者,可能潜在性地增加了ATDH发生风险(OR=1.369,95%CI1.002~1.871,P<0.05)。两组间HLA-DQB2基因6个SNPs的等位基因和基因型分布见表4。
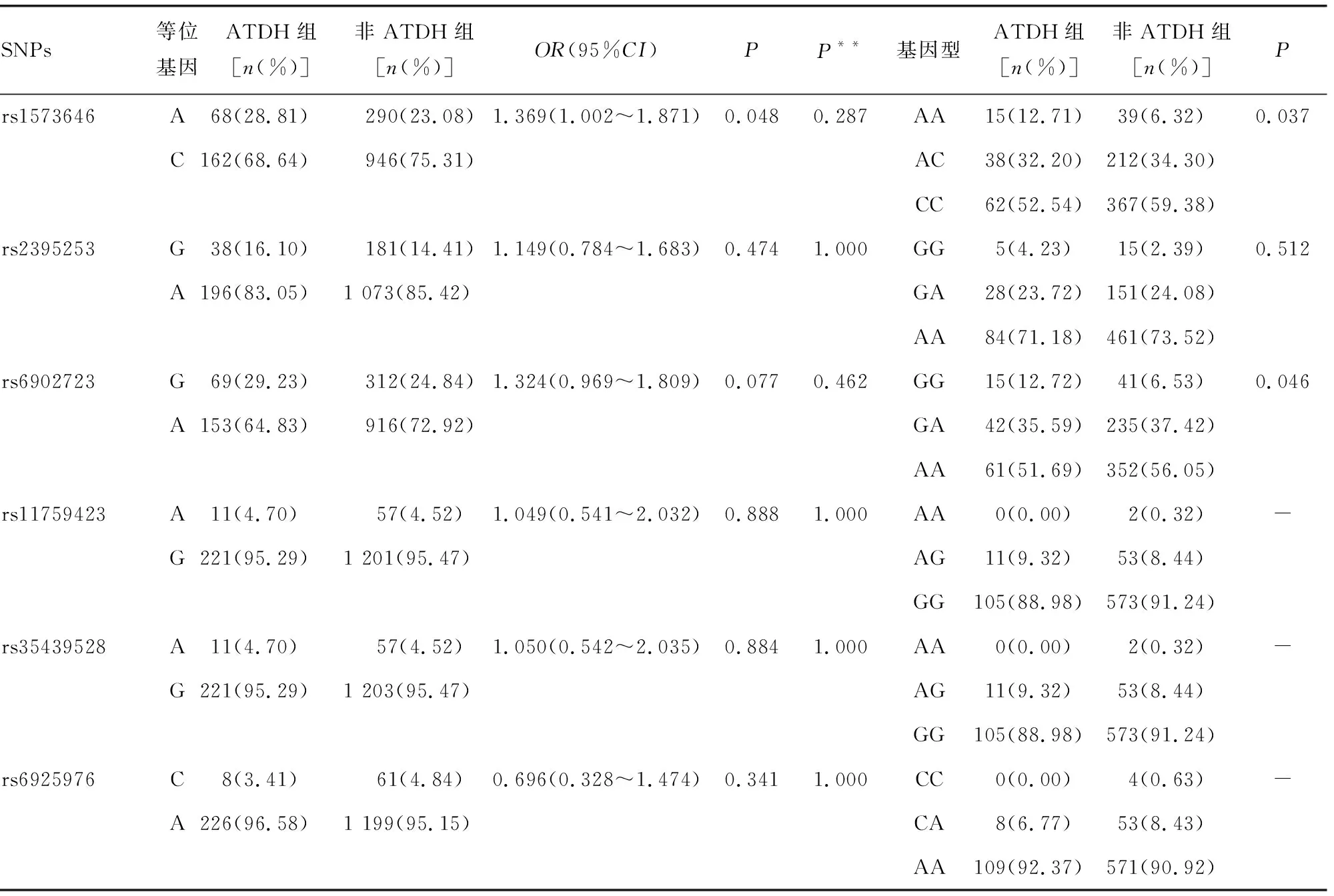
表4 HLA-DQB2 等位基因、基因型在两组间分布情况
为进一步探讨两组间HLA-DQB2基因多态性分布在遗传水平上的差异,本研究构建了加性、显性和隐性遗传模型进行分析,分析结果见表5。隐性模型显示,rs1573646 AA基因型相较于AC/CC基因型具有较高的ATDH发生风险(OR=2.227,95%CI1.183~4.190,P=0.013);rs6902723 GG基因型相较于GA/AA基因型具有较高的ATDH发生风险(OR=2.184,95%CI1.163~4.099,P=0.015)。经Bonferroni校正后,发现携带rs1573646和rs6902723的患者在隐性模型中与ATDH发生风险增加有关,剩余的HLA-DQB2基因的4个SNPs在加性、显性、隐性遗传模型,以及单倍体分析中均未发现ADTH发生风险差异有统计学意义(P<0.05)。
2.2.3单倍体构建 本研究进行了连锁不平衡分析和单倍体构建。将成对R2≥0.80视为高度连锁不平衡。6个SNPs中,除rs6925976外,其余SNPs间存在强连锁不平衡。本研究在rs1573646和rs6902723中构建了单倍型,并分析了两个单倍型(CA和AG)。两组中所有单倍体频率见图1,结果显示rs2395253与rs6902723单倍型分布在ATDH组与非ATDH组差异均无统计学意义(P>0.05)。
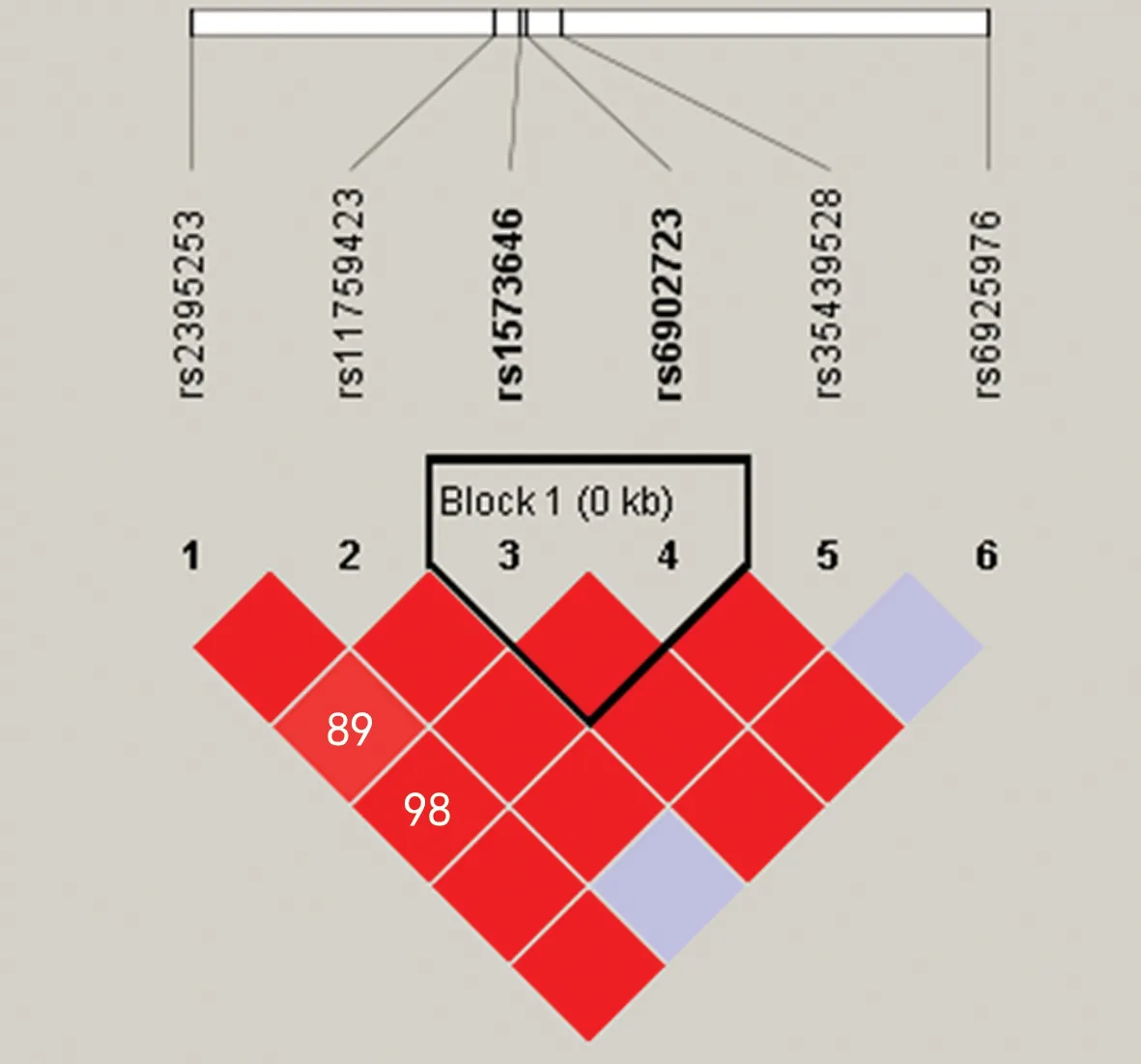
注:Block代表在这两个SNPs间构建了单倍型;结果显示它们是高度相关的。
3 讨 论
ATDH是导致结核病患者不良预后的主要原因。长期以来,宿主的遗传易感性一直被认为是药物不良反应出现个体化差异的原因。对HLA-DQB2基因多态性与抗结核药物引起肝损伤易感性的研究有助于ATDH易感基因的发现和验证。笔者研究了HLA-DQB2的基因多态性,探索其是否与汉族人群获得ATDH具有潜在关系。本研究发现HLA-DQB2位点rs1573646与ATDH易感性有潜在关系,其他位点无统计学意义(P>0.05)。
HLA-DQB2属于HLA Ⅱ类B链旁系同源物家族,位于人类6号染色体(6q21.32,32741391-32838770),是人类免疫系统的重要组成部分,通过呈递源自细胞外蛋白的肽类在免疫系统中发挥核心作用。结核病是一种与免疫系统密切相关的疾病,与其他药物致肝损伤相比,免疫系统可能在ATDH中发挥独特的作用。有研究表明,HLA-DR+CD4+T细胞可能通过拮抗辅助性T细胞介导的机体对结核分枝杆菌的特异性免疫而导致疾病相关炎症[11]。HLA单倍型关联表明,药物导致的肝损伤与适应性免疫反应的遗传易感性以及药物及其代谢物相关的抗原呈递和识别有关[12]。一项全基因组关联研究(GWAS)发现,由HLA参与的适应性免疫反应被激活可能是药物致肝损伤的发病原因,证明HLA多态性与药物致肝损伤的发生有相关性[13]。阿莫西林-克拉维酸诱导的肝损伤与HLA-DQA1*01∶01、HLA-DQB1*05∶01和HLA-DRB1*15∶01的等位基因变异密切相关。有研究者发现携带相关基因的患者与未携带者相比,服用阿莫西林-克拉维酸后发生肝毒性的风险可增高 10~80倍。HLA-B57*01基因多态性被证明与氟氯西林引起的肝损伤有关[14]。还有研究报道,在东南亚人群中,卡马西平引起的药物性肝损伤与携带HLA-B*15∶02的患者密切相关[15]。HLA-DRB1*16∶01、HLA-DQB1*05∶02基因携带者使用氟西丁治疗后发生药物致肝损伤风险增加[16]。
HLA-DQB2表达的蛋白质产物在HLAⅡ类抗原分子中出现[17],HLAⅡ类分子可将抗原肽呈递给CD4+T细胞。当药物本身或异常药物代谢物进入肝脏、激活肝脏树突状细胞后,形成药物修饰肽-HLA膜分子,引起损伤相关分子释放,使树突状细胞表面膜表型改变,在B7分子及趋化因子受体CCR7等因子参与下,成为成熟的抗原呈递分子,进入全身血液循环,激活更多CD4+T细胞进入肝脏[18]。最终进入肝脏中的具有活化效应的T细胞通过氧化应激、免疫反应等不同机制导致肝损伤,包括产生多种类型的CD4+T细胞,例如:促炎细胞因子[干扰素(IFN)-γ、白细胞介素(IL)-17等]及促过敏的细胞因子(IL-4、IL-5、IL-13等),同时激活CD8+T细胞对含有穿孔素和颗粒酶的颗粒进行胞吐作用或产生由FasL介导的CD4+和CD8+T细胞的杀伤作用,引起肝细胞损伤[19]。本研究中,HLA-DQB2基因SNPs位点rs1573646 A等位基因携带者在接受抗结核药物治疗后表现出ATDH发生风险的增加,可能原因为抗结核药物或其代谢产物在肝脏中与HLA-DQB2基因SNPs位点rs1573646 A等位基因的肽进行了优先关联,改变其抗原肽的HLA结合位点,导致呈递的抗原肽的所有成分发生改变,最终引起肝脏损伤[20]。
在ATDH的研究中,多项研究发现HLA-DQB1*02∶01、HLA-DQB1*05∶02、HLA-DQA1*01∶02、HLA-DRB1*03的基因多态性与发生ATDH的风险密切相关[7-8]。KIM等[21]发现携带HLA-CW*0401基因人群与抗结核药物诱导的超敏反应综合征(HSS)具有相关性。根据以上证据,推测HLA-DQB2基因多态性可能与ATDH的发生风险有关。本研究显示,SNPs rs1573646、rs6902723可能与ATDH发生风险增加有潜在关联。选定的余下4个HLA-DQB2基因SNPs位点(rs2395253、rs11759423、rs35439528、rs6925976)经过等位基因频率、基因型分布,以及3种遗传模型分析,发现两组间差异无统计学意义(P>0.05)。
本研究有以下不足:(1)纳入的样本量有限,本研究仅招募了118例患者,没有进一步将ATDH患者细分为肝细胞亚组、胆汁淤积亚组和混合亚组。(2)单基因多态性对ATDH的发生、发展影响有限,仍需进一步探讨更多HLA相关基因及环境等客观因素与ATDH发生的关系。ATDH是一种严重且复杂的药物不良反应,涉及多个器官及不同机制。由感染、炎症或其他氧化应激引起的复杂应激反应可能共同刺激免疫反应并引发由免疫介导的肝细胞死亡[5,22]。
综上所述,本研究发现SNPs rs1573646、rs6902723可能与ATDH的发生风险增加有潜在关系,余下4个HLA-DQB2基因SNPs位点(rs2395253、rs11759423、rs35439528、rs6925976)没有发现与ATDH的发生、发展在统计学分析中具有的关联。关于HLA-DQB2基因与ATDH的发生、发展研究仍需继续探讨。

