百蕊草药材中5种黄酮类化学成分的含量测定
郑玲玲,纪瑞锋,韩红亮,罗旖璐,罗嘉仪,管悦琴,姚其盛,郑卫兵,陈美兰,周修腾
(1中国中医科学院中药资源中心/道地药材国家重点实验室培育基地,北京 100700;2广东药科大学中药学院,广州 510006;3安徽九华华源药业有限公司,安徽滁州 239000)
0 引言
百蕊草为檀香科植物百蕊草Thesium chinensisTurcz.的干燥全草,原名百乳草,别名一颗松、细须草、青龙草、地石榴、松毛参等,系草本或灌木[1]。百蕊草始载于《图经本草》,味苦涩,性温,补气益肾,清热解毒,解暑,对多种致病菌有抑制作用,全草入药能抗菌消炎、清热解毒、补肾涩精,被誉为“植物抗生素”[2]。临床上已有百蕊草颗粒、百蕊草片、百蕊草胶囊等制剂,主要用于急性炎症如乳腺炎、肺炎、肺脓疡、扁桃体炎、上呼吸道感染等多种疾病,疗效显著,市场潜力较大。但是由于百蕊草资源储量较少,远远不能满足市场需要,因而急需深入结合植化分析及药效评价研究开展扩大药源方面研究,为药材质量的控制以及优良种质的选育提供技术指导,为百蕊草资源可持续利用提供科学依据。
百蕊草中含有黄酮、有机酸、生物碱、甾醇、酚类、挥发油等多种化学成分,黄酮类化合物是百蕊草抗菌消炎作用的主要成分之一,其在百蕊草中含量最高,且抑菌效果最好[3],因此黄酮类成分含量成为评价其质量的一项重要指标[2]。百蕊草报道的化学成分有23种,且包括黄酮类[4-5],黄酮醇类[5-7]、二氢黄酮醇类[8]及其他类成分[4,9],徐国兵等[10]一般以山奈酚或总黄酮含量对百蕊草进行质量评价。目前,百蕊草成分的提取一般使用酸水解的方法,是使结合型黄酮类成分水解成游离型黄酮类成分,以检测山奈酚及槲皮素等水解产物为评价指标。吴兆喜[3]对水解法后百蕊草山奈酚及槲皮素等黄酮醇苷类成分进行提取,确定百蕊草最佳提取工艺,并发现用60%甲醇提取的效果最佳。汤超[11]以水解后山奈酚含量为指标对百蕊草药材建立指纹图谱。徐国兵[10]采用高效液相色谱法测定水解后百蕊草山奈酚含量,建立百蕊草质量检测方法。
虽然百蕊草的黄酮类成分众多,但是研究测定的成分一般是水解后单一的山奈酚或槲皮素类成分,本研究结合文献调研及前期代谢组学研究的基础上,建立百蕊草素Ⅰ、山奈酚-3-O-芸香糖苷、紫云英苷、山奈酚-7-O-葡萄糖苷和芹菜素-7-O-β-D-吡喃葡萄糖苷的化学成分检测方法,以期为百蕊草质量标准的建立提供借鉴,全面评价百蕊草药材的质量。
1 材料与方法
1.1 仪器
超高效液相色谱仪(Waters;ACGUITY I-CLASS),Millipore超纯水系统(美国Thermo Scientific公司),SB-800 DTD超声清洗机(宁波新芝生物科技股份有限公司),BT-224S型万分之一电子分析天平(上海赞维衡器有限公司),XS105DU型1/10万分析天平(梅特勒-托利多国际贸易有限公司),ZA305AS十万分之一电子天平(上海赞维衡器有限公司)。
1.2 试剂
百蕊草素Ⅰ(批号:C09M9G55496,纯度≥98%)购买于上海源叶生物科技有限公司;山奈酚-3-O-芸香糖苷(批号:DST200619-075,纯度≥98%)、紫云英苷(批号:DSTDZ000101,纯度≥98%)、山奈酚-7-O-葡萄糖苷(批号:DST200719-077,纯度≥98%)、芹菜素-7-O-β-D-吡喃葡萄糖苷(批号:DST200923-063,纯度≥98%)购买于乐美天医药/德斯特生物;色谱甲醇、色谱乙腈购买于Thermo Fisher Scientific;超纯水自制。
1.3 百蕊草药材
野生两年生百蕊草由九华华源药业提供,采自安徽滁州;人工种植百蕊草由中国中医科学院中药资源中心和九华华源药业合作在安徽滁州种植基地种植并采集两年生百蕊草。试验于2021年1—4月在中国中医科学院中药资源中心重点开放实验室进行。
1.4 方法
1.4.1 正交试验
(1)采用正交试验法考察料液比、提取时间及溶剂比例对百蕊草成分提取的影响,实验设计三因素三水平,具体的参数见表1。

表1 因素水平表
(2)根据选择的因素水平,按照L9(34)正交试验表进行试验安排,共有9组试验,按照试验号对应的提取条件,分别称取百蕊草粉末0.5 g于25 mL锥形瓶中进行提取试验,采用超高效液相色谱法测定其化学成分的含量。
1.4.2 色谱条件 色谱柱:ACQUITYUPLC BEH-C18柱(2.1×50 mm,1.7 μm),柱温:30℃,流速:0.4 mL/min,波长:254 nm,流动相:乙腈-0.5%甲酸水进行梯度洗脱,具体见表2,进样量:1 µL。
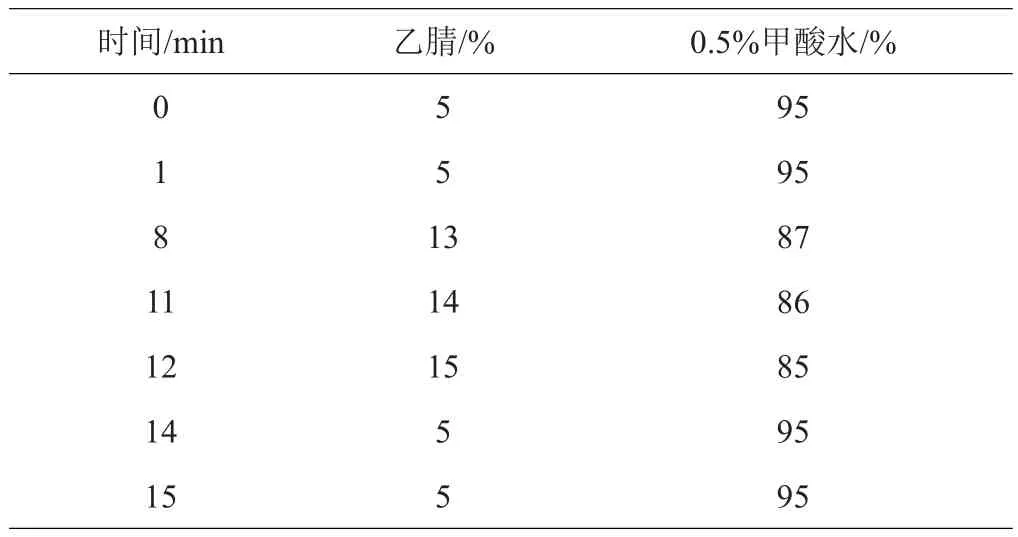
表2 流动相洗脱表
1.4.3 标准溶液配制
(1)取百蕊草素Ⅰ对照品10 mg,置于5 mL容量瓶中,加入纯甲醇至刻度线,制成2 mg/mL的母液,逐级稀释成1 mg/mL和500、200、100、20、10 µg/mL的标准溶液。
(2)取山奈酚-3-O-芸香糖苷对照品5 mg,置于5 mL容量瓶中,加入纯甲醇至刻度线,制成1 mg/mL的母液,逐级稀释成20、100、20、10、2、1 µg/mL的标准溶液。
(3)取紫云英苷对照品5 mg,置于5 mL容量瓶中,加入纯甲醇至刻度线,制成1 mg/mL的母液,逐级稀释成200、100、20、10、2、1 µg/mL的标准溶液
(4)取山奈酚-7-O-葡萄糖苷对照品5 mg,置于5 mL容量瓶中,加入纯甲醇至刻度线,制成1 mg/mL的母液,逐级稀释成200、100、20、10、2、1 µg/mL的标准溶液
(5)取芹菜素-7-O-β-D-吡喃葡萄糖苷对照品10 mg,置于5 mL容量瓶中,加入纯甲醇至刻度线,制成2 mg/mL的母液,逐级稀释成 1、500、200、50、20、10µg/mL的标准溶液。
1.4.4 方法学考察
(1)专属性考察。分别吸取1 mg/mL的百蕊草素Ⅰ、山奈酚-3-O-芸香糖苷、紫云英苷、山奈酚-7-O-葡萄糖苷、芹菜素-7-O-β-D-吡喃葡萄糖苷100 µL,加入500µL纯甲醇配制成混合对照品溶液,按1.4.2项下色谱条件进样分析。
(2)线性关系考察。精密量取标准溶液,按照1.4.2项下色谱条件进行测定,以峰面积为纵坐标(Y),浓度为横坐标(X)进行回归统计。
(3)精密度考察。精密量取供试品溶液,按1.4.2项下色谱条件进行测定,同法平行操作6次,随行标曲,测定峰面积,计算其含量。
(4)稳定性考察。取混合对照品溶液,分别在0、2、4、6、8、12、15、24 h进样,按1.4.2项下色谱条件进行测定。
(5)重复性考察。取百蕊草粉末0.5 g,精密称定,重复6份,按照2.1项下正交实验最优超声提取方法进行样品制备,按1.4.2项下色谱条件进行测定。
(6)加样回收率考察。采用加样回收法,取已知含量的样品粉末9份,每份0.5 g,精密称定;分别加入百蕊草素Ⅰ、山奈酚-3-O-芸香糖苷、紫云英苷、山奈酚-7-O-葡萄糖苷、芹菜素-7-O-β-D-吡喃葡萄糖苷对照品溶液高中低各400 μL,按照2.1项下正交实验最优超声提取方法进行样品制备,按1.4.2项下色谱条件进行测定,计算测得回收率。
1.4.5 野生与人工种植百蕊草含量的测定 分别称取安徽马厂野生与人工种植百蕊草的地上、地下粉末0.5 g,重复6次,按照优化的提取和UPLC测定方法对其化学成分进行测定。
1.5 数据处理
用Excel 2010软件对数据整理、AI与PS绘图软件和SPSS 26.0软件对数据进行分析,得出结论。
2 结果与分析
2.1 正交试验结果
从正交试验直观分析结果可以看出(表3),各因素对百蕊草总黄酮总含量提取率的影响程度不同,3个因素对提取率的影响由大到小依次为料液比>溶剂比例>提取时间。直观分析结果筛选出百蕊草黄酮类总含量的最优提取方案为A1B2C2,即称取百蕊草粉末,用10倍量的60%甲醇作提取溶剂,超声(40 KHz)提取45 min。
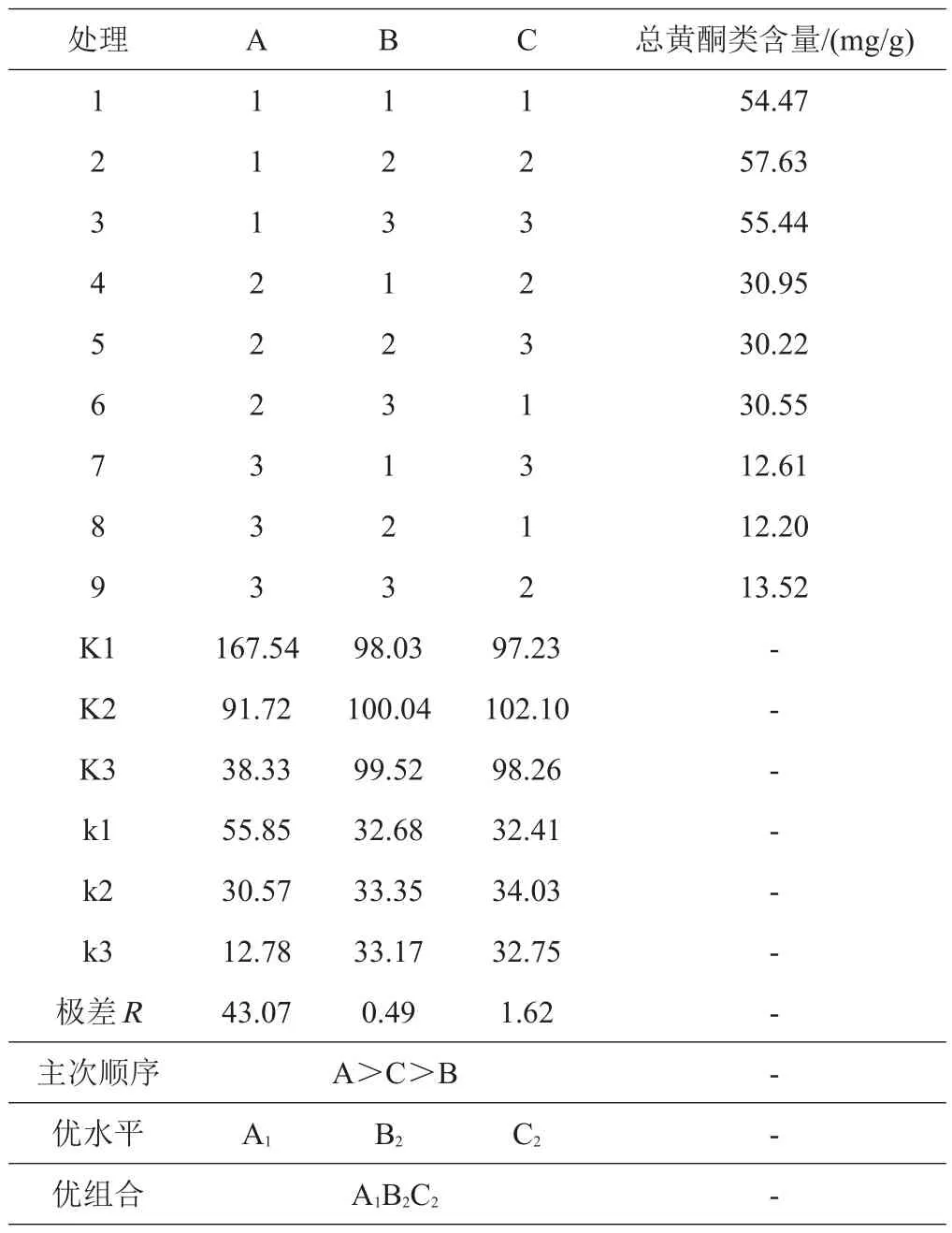
表3 正交试验结果
2.2 方法学考察
2.2.1 专属性 混合对照品溶液、百蕊草供试品溶液的UPLC色谱图如图1,结果显示百蕊草5种主要成分分析均不存在干扰,表明本实验UPLC方法专属性良好。

图1 色谱条件分析
2.2.2 线性关系 百蕊草5种成分的线性回归方程、线性范围和相关系数见表4,结果表明百蕊草5种成分所在考察范围内线性良好。

表4 线性方程、线性范围及相关系数
2.2.3 精密度 百蕊草5种化学成分精密度实验结果见表5,RSD值均小于1.25%,表明仪器精密度良好。

表5 精密度实验结果
2.2.4 稳定性 百蕊草5种成分标准品溶液峰面积见表6,24 h内RSD均小于1.8%,表明方法稳定性良好。
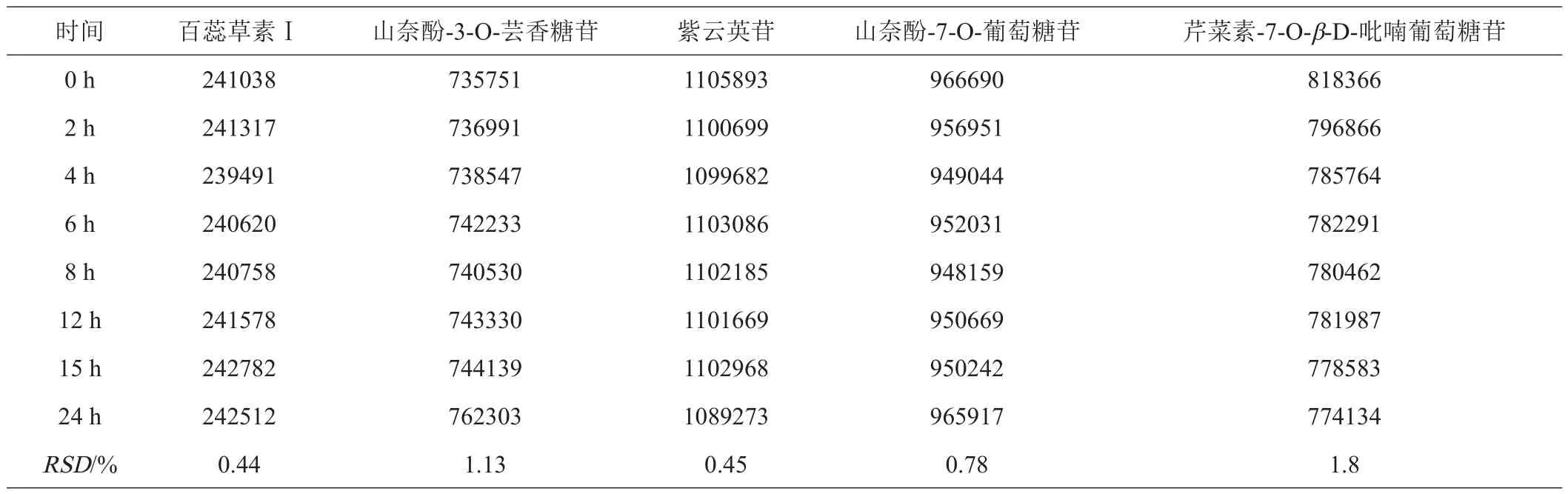
表6 稳定性实验结果
2.2.5 重复性 百蕊草5种成分的重复性实验结果见表7,RSD均小于3%,表明方法重复性良好。

表7 重复性实验结果
2.2.6 加样回收率 百蕊草5种化学成分的加样回收率结果见表8,RSD均小于3.24%,说明本法准确度良好。
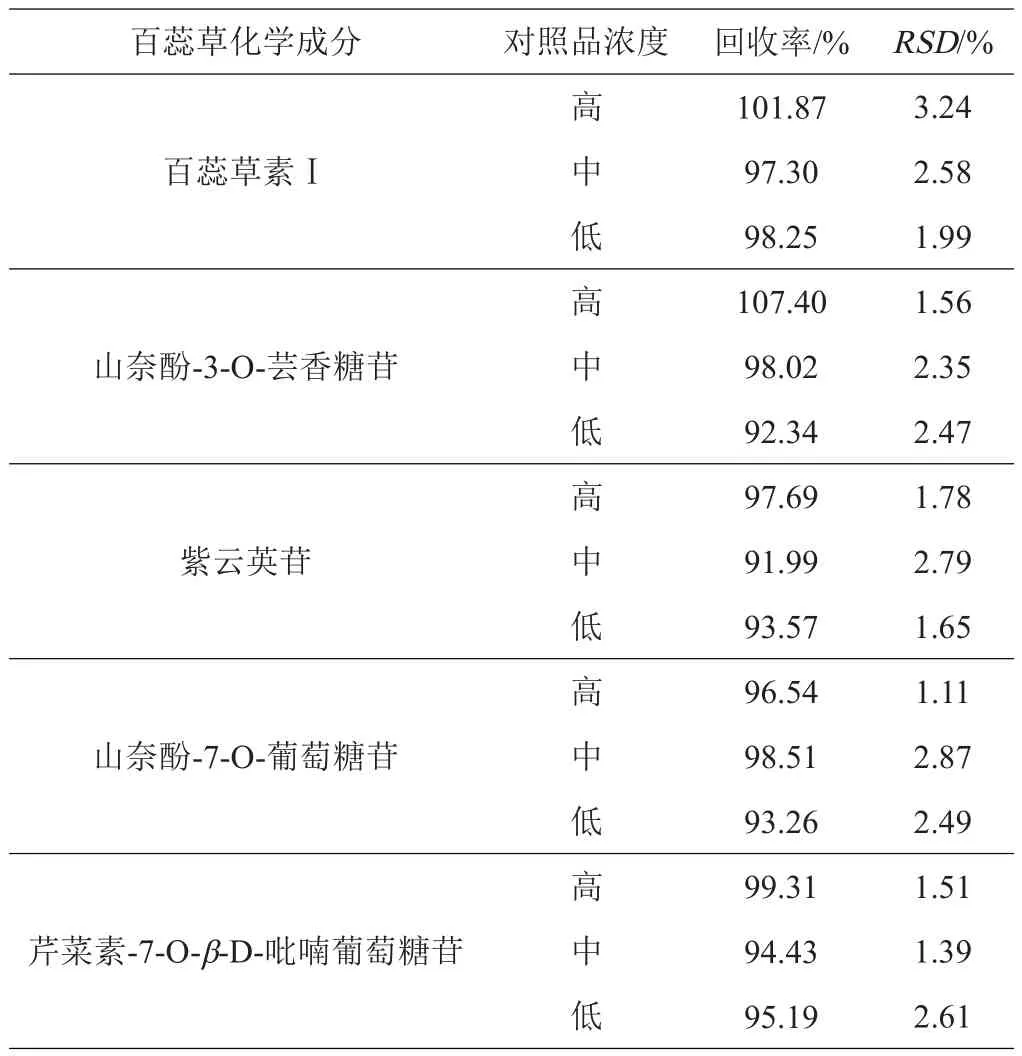
表8 回收率结果表
2.3 野生与人工种植百蕊草含量的测定
由表9可知,百蕊草不同部位的化学成分含量不同,人工种植百蕊草地上部分的百蕊草素Ⅰ、山奈酚-3-O-芸香糖苷、紫云英苷、山奈酚-7-O-葡萄糖苷及芹菜素-7-O-β-D-吡喃葡萄糖苷的含量均显著(P<0.05)高于地下部分,分别是地下部分含量的4~20.69倍;野生百蕊草药材地上部分百蕊草素Ⅰ、山奈酚-3-O-芸香糖苷、山奈酚-7-O-葡萄糖苷及芹菜素-7-O-β-D-吡喃葡萄糖苷的含量均显著高于(P<0.05)地下部分,分别是地下部分含量的2.64~6.14倍,紫云英苷含量有高于地下部分的趋势,但是二者之间并无显著性差异。
表9 人工种植与野生百蕊草药材化学成分含量表(±SD,n=6)mg/g

表9 人工种植与野生百蕊草药材化学成分含量表(±SD,n=6)mg/g
注:a,b表示人工种植地上与地下显著性差异;c,d表示野生百蕊草地上地下显著性差异;A,B表示人工与野生百蕊草地上显著性差异;C,D表示人工与野生地下显著性差异(P<0.05)。
处理 百蕊草素Ⅰ 山奈酚-3-O-芸香糖苷 紫云英苷 山奈酚-7-O-葡萄糖苷 芹菜素-7-O-β-D-吡喃葡萄糖苷人工野生地上地下地上地下1 2.9 8±0.4 4 a A 1.4 4±0.1 7 b C 8.2 8±0.3 1 c B 2.4 3±0.1 4 d D 0.2 6±0.0 1 a A 0.0 2±0.0 2 b A 0.2±0.0 9 c A 0.0 5±0.0 5 d A 0.2 8±0.0 1 a A 0.0 7±0.0 2 b C 0.2±0.0 4 c B 0.1 5±0.0 5 c D 0.8 4±0.0 2 a A 0.1±0.0 2 b C 0.2 9±0.0 6 c B 0.1 1±0.0 6 d D 1 7.3 8±0.6 5 a A 0.8 4±0.1 b C 3.5±0.0 2 c B 0.5 7±0.0 8 d D
野生百蕊草与人工种植百蕊草地上部分化学成分相比,人工种植百蕊草药材的百蕊草素Ⅰ、紫云英苷、山奈酚-7-O-葡萄糖苷、芹菜素-7-O-β-D-吡喃葡萄糖苷含量均显著(P<0.05)高于野生百蕊草药材,人工种植百蕊草药材地上部分山奈酚-3-O-芸香糖苷含量有高于野生百蕊草药材地上部分的趋势,但是没有显著性差异。
野生百蕊草药材与人工种植百蕊草药材地下部分化学成分相比,野生百蕊草药材的百蕊草素Ⅰ含量、紫云英苷含量、山奈酚-7-O-葡萄糖苷含量均显著(P<0.05)高于人工种植百蕊草药材,野生百蕊草药材中山奈酚-3-O-芸香糖苷有高于人工种植百蕊草药材的趋势,但是二者之间并无显著性差异,人工种植百蕊草药材的芹菜素-7-O-β-D-吡喃葡萄糖苷含量显著高于野生药材。
3 结论与讨论
百蕊草含有多种化学成分,其中黄酮类成分在百蕊草中含量最高,抑菌药理活性最好[1]。目前,大多数对于百蕊草活性成分的报道主要针对黄酮类成分的研究[11],市场上对百蕊草的质量评价标准均以其黄酮醇苷的含量作为标准[12]。黄酮类化合物提取的方法多为醇提法[13]、水提取法[14]、碱性水提取或其他有机溶剂萃取法[15-16],前期课题组预实验考察了水提取法、碱浸提法、有机溶剂提取法,最终确定有机溶剂提取效果最佳;通过考察振摇、回流、超声提取方式,发现超声与回流中各成分提取效果显著(P<0.05)优于振摇提取,而超声与回流提取之间各成分含量并无显著性差异,因此从总体效益和时间成本综合考虑,本研究选取超声提取方法;通过考察乙酸乙酯、甲醇和乙醇等有机溶剂的超声提取效果,最终发现乙酸乙酯部位未能检测出化学成分,且甲醇溶剂中各成分提取效果显著(P<0.05)优于乙醇,故确定甲醇为百蕊草化学成分的超声提取溶剂。通过正交实验设计,考察甲醇溶剂比例、超声时间和料液比,最终确定百蕊草化学成分的提取方法为60%的甲醇溶液超声提取45 min,料液比为1:10。
此外,本研究对百蕊草化学成分UPLC检测方法进行了摸索,分别对梯度洗脱方法、流动相配比、色谱柱等进行考察,采用0.5%甲酸水-甲醇溶液、0.1%甲酸水-乙腈溶液、0.5%甲酸水-乙腈溶液作为流动相,采用Waters ACQUITY UPLC BEH C18(2.1×100 mm,1.7 μm)、Waters ACQUITY UPLC T3 C18(2.1×100 mm,1.7 μm)、Waters ACQUIT YUPLC BEHC18(2.1×50mm,1.7 μm)和Waters ACQUITY UPLC T3 C18(2.1×50 mm,1.7 μm)作为色谱柱进行考察,结果显示,0.5%甲酸水-乙腈溶液作为流动相,Waters ACQUITY UPLC BEH C18(2.1×50 mm,1.7 μm)作为色谱柱,百蕊草各化学成分表现出良好的线性关系(r>0.9992),色谱峰得到很好的分离,且无基质干扰。仪器精密度、稳定性和重复性试验RSD均<3%;百蕊草各化学成分平均回收率为97%,表明建立的UPLC检测方法具有一定的准确性、稳定性和可靠性。
目前,相关文献报道[17-18]的百蕊草药材以及上市制剂“百蕊草颗粒、百蕊含片”等的质量标准中,多以山奈酚为测定指标。唐慧文等[19]认为百蕊草中主要活性成分为黄酮醇苷,通过对黄酮类成分的比较,确定以山奈酚为指标成分;曹明成等[20]以高效液相色谱法测定百蕊草中的黄酮醇苷水解后的共同黄酮醇苷元山奈酚的含量,并以百蕊草中黄酮醇苷水解后的共同苷元山奈酚含量作为百蕊草质量的评价指标;罗夫来等[21]以百蕊草药材中总黄酮、山奈酚、甘露醇、多糖等多种活性成分含量作为百蕊草药材的内在品质评价指标;徐国兵等[10]建立了百蕊草药材中总黄酮和山奈酚的含量测定方法,对百蕊草药材进行质量评价。但是,山奈酚主要是由黄酮苷水解后得到的苷元,因此,大多采用酸水解方法提取百蕊草中山奈酚,目的是使结合型黄酮类成分的酯键或糖苷键水解释放多种形态游离型黄酮类成分[22],但是酸水解的程度并不明确,其酸浓度、水解时间及加入量均是影响水解程度的关键因素,影响含量的准确性[23-24],此外,经酸水解之后制备的供试液中,山奈酚的含量已非药材天然含有的水平,不能真实反映药材及制剂中真实的含量[25]。因此,本研究结合前期百蕊草代谢组学研究的基础上,选定百蕊草素Ⅰ、山奈酚-3-O-芸香糖苷、紫云英苷、山奈酚-7-O-葡萄糖苷及芹菜素-7-O-β-D-吡喃葡萄糖苷作为百蕊草的化学成分,通过对2批百蕊草药材的研究发现,野生百蕊草和人工百蕊草中中百蕊草素Ⅰ与芹菜素-7-O-β-D-吡喃葡萄糖苷含量均较高,且人工种植百蕊草中化学成分的含量高于野生种植的百蕊草。后期课题组将结合代谢组学和植物化学的方法分离提纯百蕊草黄酮类成分并开展相应药效活性的研究,以期为百蕊草的质量评价指标成分鉴定提供借鉴。

