原发性肺癌消化道转移10例诊治分析
韩佳珺 蒋林华*
肺癌是我国最为常见的癌种之一,因其高发病率、高病死率的特点,越来越受到广大民众的重视[1]。随着影像技术的进步及新型冠状病毒的席卷全球,胸部CT 的普及率明显上升,更多早期肺部病变被发现。但文献报道[2],超过半数的肺癌患者,发现时已处于晚期。晚期肺癌患者,多伴有全身多处转移的情况。肺癌常见的转移部位包括骨、脑、肝脏、肾上腺等部位,这些部位往往能受到广大医患的关注。而消化道转移,这一较少的转移部位,往往会被忽视。本研究收集本院收治原发性肺癌伴消化道转移患者的病例资料,结合国内外文献进行回顾性分析,总结其临床表现、辅助检查、病理结果、胃肠道转移部位、胃肠道转移时的其他转移部位、肺肿瘤诊断与发现转移之间的时间间隔、治疗情况以及预后等,以加强临床医师对该转移部位的认识,从而提高早期诊断、早期治疗,以免误诊、漏诊。
1 资料与方法
1.1 临床资料 选取2010 年7 月至2022 年3 月本院收治的原发性肺癌伴消化道转移的患者共10 例。均为男性患者。年龄52~77(61.7±9.3)岁。观测的指标包括原发性肺癌的发病部位、病理类型及治疗方法,消化道转移的临床表现,诊断依据,转移部位,转移时是否存在其他转移,肺肿瘤诊断与发现消化道转移之间的时间间隔,治疗情况以及预后等资料进行回顾性分析。其中“时间间隔”定义为从确诊原发性肺癌到通过影像学方法检测到胃肠道转移的时间。当与原发性肺癌同时或在术前检查过程中检测到肠转移时,间隔定义为“同时”。“存活时间”定义为检测到胃肠道转移至身故或随访日期的时间间隔。
2 结果
10 例患者中,7 例出现消化道症状如穿孔、梗阻、黑便;3 例无明显消化道症状,于诊断肺癌时通过行PETCT 同期发现。非同时发现的时间间隔为(301.3±289.5)天。术后病理为腺癌5 例,大细胞癌2 例,腺癌合并大细胞癌2 例,腺鳞癌1 例。消化道病变部位为小肠4例,胃2 例,结肠2 例,小肠合并结肠2 例。10 例患者中有5 例患者同期伴有其他非消化道部位的转移。共8 例患者行消化道手术,其中急诊手术3 例。10 例患者均于不同时期接受过化疗、放疗、靶向、免疫等其一或多种方法。5 例已故患者,平均存活时间(59.2±50.3)天,均<6 个月。5 例患者目前仍在定期随访,其中4例仍定期治疗中。见表1。
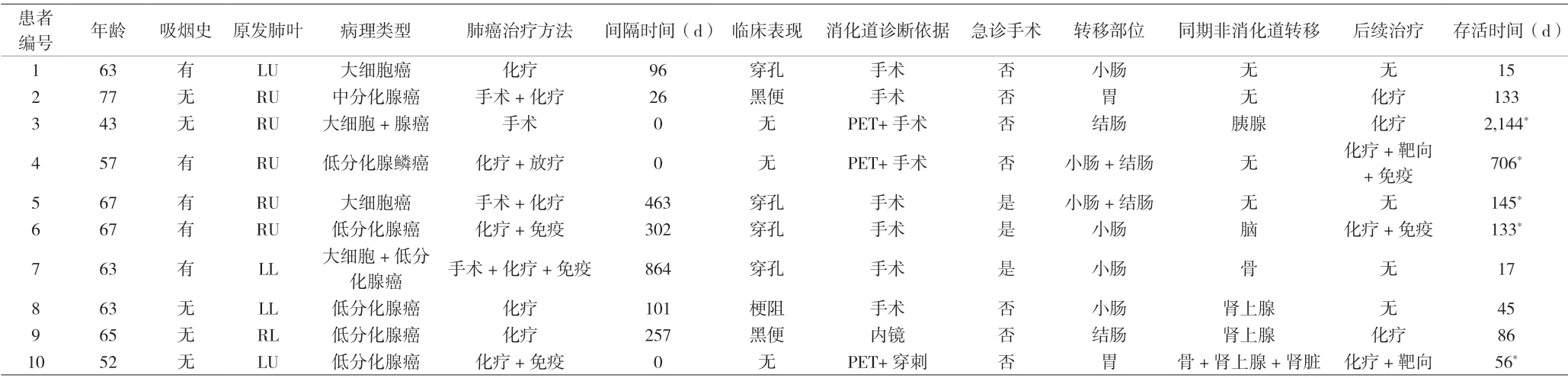
表1 10例患者临床数据
3 讨论
肺癌常见的转移部位包括骨、脑、肝脏、肾上腺等部位,消化道转移的临床病例较为罕见。且大部分患者已无法耐受频繁的腹部增强CT、PET-CT、胃肠镜等检查,从而造成诊断的遗漏或延误。因而,临床上需更加警惕此转移部位的发生。2018 年一项366 例患者的回顾性研究指出,小肠(59.6%)是胃肠道中最常受累的器官,结直肠(25.6%)紧随其后。本研究中小肠转移率40%,结肠转移率20%,胃转移率20%,小肠及结肠同时转移率20%[3]。最常见的转移部位也为小肠。可见,小肠、结肠及胃是原发性肺癌消化道转移的常见转移部位,其中小肠最为常见。
针对这些消化道转移病例,可能存在腹痛、腹胀、便血等症状。本研究10 名患者中,穿孔4 例,梗阻1例,黑便2 例,无症状3 例。与其他研究大致相符。因此对于原发性肺癌患者,术后出现腹痛、腹胀、黑便等病情时,需警惕消化道转移的可能。日常随访过程中,也需关注消化道转移的可能性。已知的检查方法包括内镜、腹部CT 及PET-CT 等。内镜普遍难度较大,病人耐受度差,且肠转移多累及黏膜下层,而黏膜层多保持完整,因此发现难度大。腹部CT 根据是否存在肠壁增厚,肠道穿孔,及周围淋巴结肿大的情况,来判别是否存在消化道转移可能,以及相应的部位及数量。早期检出率较低,且需进一步检查来验证。PET-CT 价格较高,但能提高无症状性胃肠道转移患者以及部分无法耐受有创性操作患者的胃肠道转移的诊断率。临床上需根据病人的个体化情况而选用最为合适的随访及评估方法。本研究中有三名无症状患者,均由PET-CT 检出,其中两名患者较早进行了原发及转移部位的手术,得到了不错的术后生存期。可见PET-CT 对于远处转移的发现及治疗,具有较为积极的意义。
随着肺腺癌发病率的大幅度上升,相应的消化道转移人数似乎也有所增加。2018 年浙大附二院的回顾性研究指出,鳞状细胞癌(28.5%),腺癌(27.6%)和大细胞癌(20.9%)是三种最常见的组织学类型。本研究10 例病例中,腺癌5 例,大细胞癌2 例,大细胞癌合并腺癌2 例,腺鳞癌1 例。除1 例患者为中分化癌外,其余患者均为低分化及未分化癌,恶性程度较高。本研究有4 例患者发生穿孔,2 例为大细胞癌,1 例为大细胞癌合并腺癌,1 例为低分化腺癌。似乎也预示着含有大细胞癌成分的原发性肺癌患者,发生肠穿孔的可能性更高。1 位未发生肠穿孔的大细胞癌患者,因PETCT 提示消化道病变而较早的进行消化道手术,似乎降低了日后肠穿孔的概率,同时也进一步验证了PET-CT的优势。当然这两点还需要更多的病例来进行验证。
考虑肺腺癌消化道转移时,CK7、TTF-1 阳性,而CK20、CDX-2 阴性。腺鳞癌患者的癌组织内可见腺癌及鳞癌两种成分,其中鳞癌成分可致P63、P40、CK5/6等免疫组化标记阳性。而大细胞癌的诊断,需结合分化程度及各项免疫标记物。因此通过相关的免疫组化的结果,对于鉴别消化道肿瘤是否为原发还是转移具有重要意义。本研究中,所有患者的肺及消化道的病理检验均于本院进行,所以两次病理结果的对比对于诊断肠道病变是否原发还是转移也有很大的临床意义。
原发性肺癌胃肠道转移患者整体预后不佳。大部分患者,可能已存在全身其他部位的转移。ANDREA 等的研究发现诊断原发性肺癌至发现胃肠道转移之间的中位时间为2 个月,中位总生存期为4 个月[4]。我国报告的几例小肠转移患者平均生存期仅为2~4 个月[5-6]。虽然原发性肺癌患者出现消化道转移后,整体治疗效果不佳,但尽早、积极的手术干预有利于改善患者症状,并可能改善生存期。本研究中,共有6 例患者在发现消化道转移时,同期存在如骨、肾上腺等部位的转移。3 例患者因存在急腹症,被迫行急诊手术。已故的5 例患者,随访存活期为15 d 至133 d,均未超过6 个月。其中3 例发现肠道转移时已存在其他部位的转移,1 例因后续治疗期间基础疾病而离世,1 例因消化道手术术后并发症而离世。健在的5 例患者中,已有两位生存期超过半年,1 例可能得益于手术的彻底,1 例可能得益于手术联合化疗、靶向以及免疫这一综合治疗模式。可见,原发性肺癌消化道转移整体中位生存期确实不高,但手术的彻底联合日新月异的术后治疗方案,可能得到不错的治疗效果。
综上所述,原发性肺癌伴消化道转移临床发生率较低,但对于恶性程度较高的晚期肺癌患者,尤其出现明显的消化道症状时,需警惕消化道转移的可能,以免漏诊、误诊。尽早干预可能可以改善患者的预后。

