快速溶剂萃取-飞行时间质谱法筛查辣椒中农药残留量
李 芳,李长征,沈致淳,李雪梅,王 颖,刘 栋,李蓉娟
(大东港海关综合技术服务中心,辽宁 丹东 118300)
“辣”是韩国饮食最具代表性的特点,韩国人以嗜好吃辣而出名,但辣椒并不是韩国土生土长的传统作物。韩国是我国辣椒出口的重要目标市场,目前中国生产的辣椒在韩国市场中的占有率呈逐年增长态势。
目前,各国政府和组织采取日趋严格的农药残留限量标准,农药的最大残留限质量分数已降低到10-9水平,同时,限量标准中涉及农药的种类也在不断增多。随着农药残留标准的日益严格,对农药残留的样品前处理和检测方法也发生了巨大的变化,样品前处理从传统的液液萃取转变为固相萃取、基质分散萃取和快速溶剂萃取、凝胶净化(gel permeation chromatography,GPC)、凝胶净化在线联机系统等新方法,检测方法也从传统的几种或1类农药残留的分析趋向于多农药残留的快速分析[1-5]。我国现有标准方法有液相色谱法、液相色谱-质谱/质谱法。气相色谱法、气相色谱-质谱法[6-9],这些方法可对已知目标化物进行检测,但对未知化合物的检测能力相对有限。
基于以上情况,本课题将采用先进设备,实现检测的全自动前处理[10],减少随机误差。采用飞行时间质谱SWATH(sequential windowed acquisition of all theoretical mass spectra)采集模式,用自动解卷积的方法,实现农药残留的快速筛查。该方法的自动化程度及准确度和灵敏度均较高。
1 实验部分
1.1 仪器与试剂
1.2 实验方法
1.2.1 样品前处理
称取10 g搅碎的辣椒样品于40 mL萃取池,加入硅藻土至填满萃取池,在100 ℃、10 MPa的条件下用乙腈萃取2次,收集提取液,待净化。
1.2.2 样品净化
由于提取溶剂为乙腈,因而需进行溶剂转换方可进行GPC凝胶净化。设定在线方法为EVA-GPC-EVA(预溶剂浓缩-凝胶净化-溶剂浓缩),预浓缩设定为蒸干,用5 mL乙酸乙酯+环己烷(1∶1,体积比)定容,供在线GPC上样净化,去除色素、脂肪等大分子杂质,收集时间为12~26 min。收集液经浓缩后,用乙腈定容至1 mL,直接上机检测。
1.2.3 色谱条件
色谱柱:SB-C18,2.1 mm×100 mm,2.7 μm;流动相A:体积分数0.1%的甲酸水;流动相B:乙腈;洗脱梯度见表1;流量:0. 4 mL/min;柱温:30 ℃;进样量:10 μL。
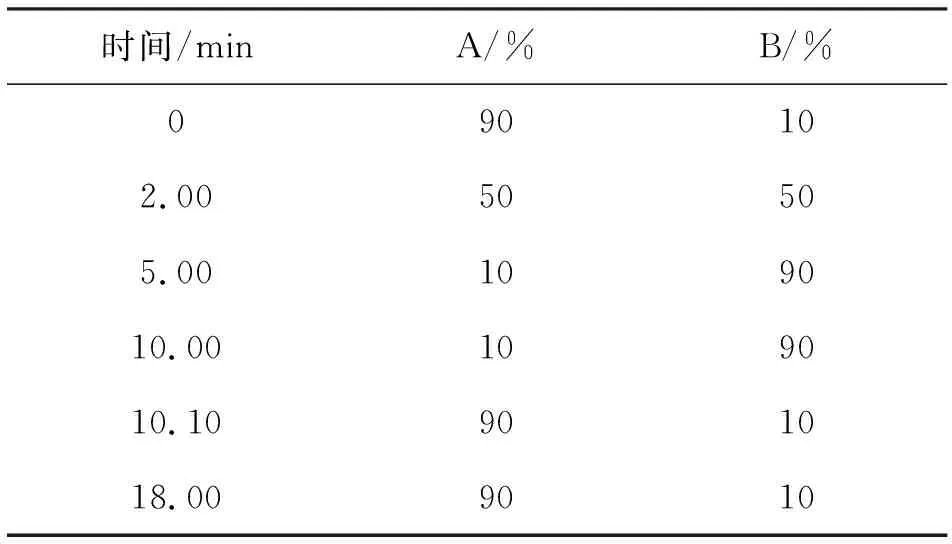
表1 流动相梯度洗脱
1.2.4 质谱条件
质谱分析采用ESI离子源,正离子模式扫描。IS电压为5 500 V(+),离子源温度为550 ℃,气帘气CUR:30 pis,碰撞气CAD:7,雾化气GAS1:55 psi,辅助气GAS2:55 psi,碰撞能量: (35±15)V (CE±CES)。
1.2.5 数据采集
四级杆-飞行时间质谱具有超快的采集速率、智能化的TOF MS-SWATH-MS/MS采集模式以及稳定耐用的离子源,非常适合复杂基质样品的分析,可通过1针进样即可采集到全面和高质量的一级与二级质谱数据,从而通过一级质量化合物、化合物同位素峰形、保留时间和高质量精度的二级谱这“四大关”进行目标化合物筛查,快速高效地提供最准确的定性筛查结果。本研究中要进行定量分析的27种农药的具体信息见表2。
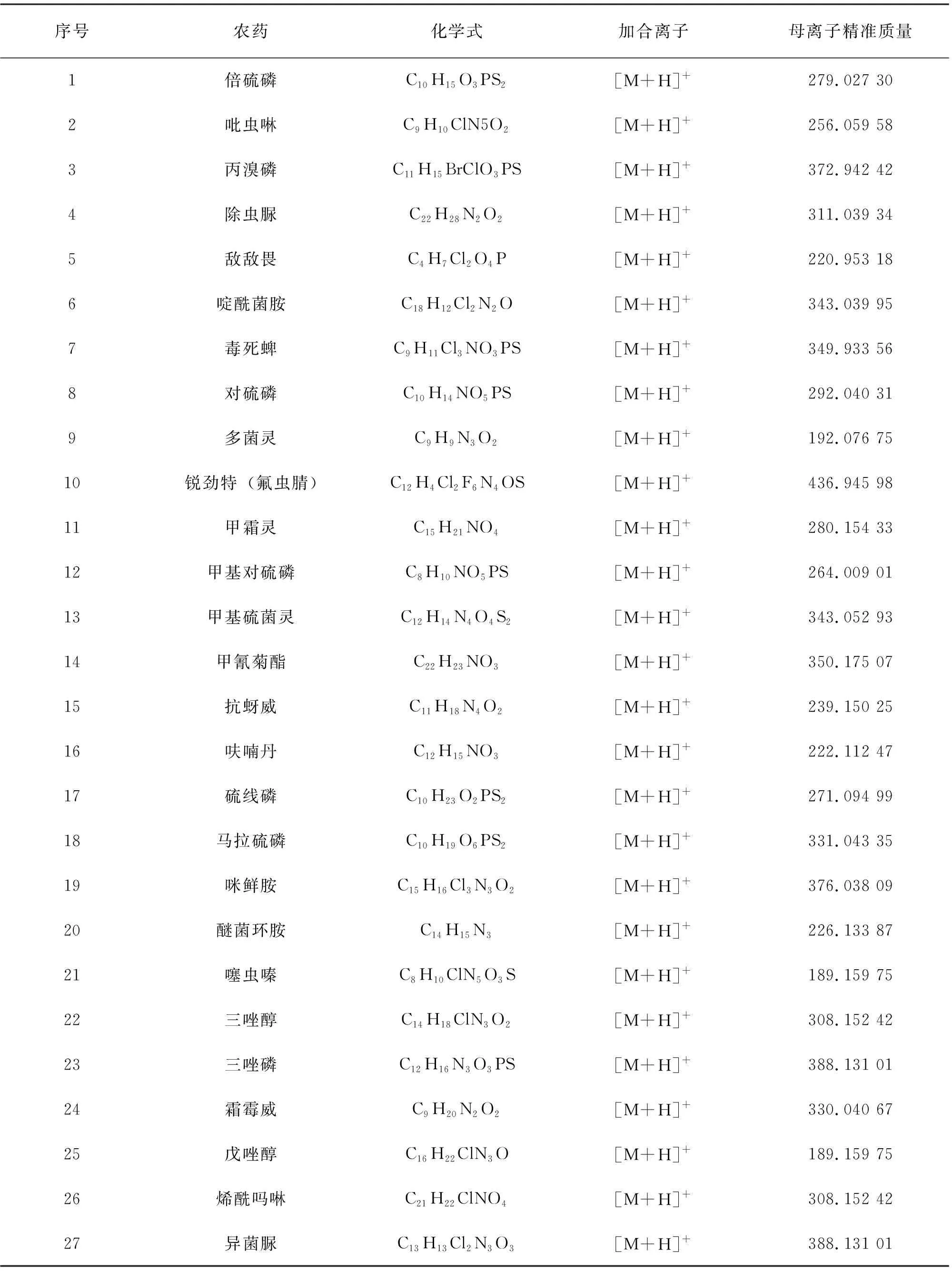
表2 27种农药化合物的色谱质谱信息
1.2.6 定性筛查
采用仪器自带分析软件对市售辣椒样品进行农药残留测定。在软件中调用数据库,并设置Mass Error(1×10-6)、Retention Time(min)、Isotope、Library Hit、Fonmula、Finder的相关权重,通过给出各检索参数的实测值和理论值的偏差,利用匹配结果来确定筛查结果。
1.2.7 定量分析
本实验利用基质液为溶剂配置混合标准溶液的 标准曲线,标准曲线质量浓度范围为0.000 5~0.100 0 μg/mL,由于各种农药在仪器上的响应有差别,所以每种农药的线性范围不一致,针对筛查结果为阳性的样品要选用合适的曲线浓度范围,确保计算结果准确。
2 结果与讨论
2.1 萃取条件的优化
实验选用快速溶剂萃取提取方法,尝试优化提取温度和提取压力,在100 ℃时,比较8、9、10、11 MPa压力下的提取效果。结果发现:压力低于10 MPa时,回收率相对较低;10 MPa和11 MPa时,提取效果几乎没有差异。所以选择10 MPa为提取压力。同时,在10 MPa时,比较90、100、110、120 ℃的提取效果。结果发现:当温度低于100 ℃时,回收率相对较低;当温度为110、120 ℃时,提取溶剂较浑浊,杂质较多,回收率与100 ℃相比几乎无差别。所以选择提取温度为100 ℃。
2.2 色谱条件优化
实验选择Agilent的C18(100 mm×2.1 mm,2.1 μm)色谱柱对27种目标化合物进行分离分析,并比较甲醇-水和乙腈-水2种流动相体系。结果发现:甲醇-水体系只针对个别农药分离效果较好,和乙腈-水体系差别不大;但是由于甲醇-水为流动相体系,柱压相对较高,所以本研究选用乙腈-水为流动相体系。在此基础上又对乙腈-水和乙腈-质量分数为0.1%的甲酸水进行了比较,发现质量分数为0.1%的甲酸水又会使部分农药响应更高,所以最终确定以乙腈-质量分数为0.1%的甲酸水为流动相。
2.3 质谱筛查模式的选择
与IDA采集模式相比,SWATH技术基于高分辨系统,又综合了IDA和MRM的优势,将母离子的质量范围分成多个质量窗口,每个窗口内的所有离子一起碰撞碎裂,从而得到整个质量范围内的所有离子的碎片信息。SWATH技术所测得的二级碎片不同于IDA只测被选中触发的离子,而是测所有相应的离子,从而保证了所有离子碎片的连续性,可以实现SWATH二级定量并且可以保留更加完整的样品信息,真正实现非靶向筛查,所以本研究选用SWATH采集方式。在对同一组数据进行定量分析时,选用二级离子和一级离子进行比较,发现二级离子响应较低,而且稳定性较弱;而一级离子则相对稳定,并且响应较高。这主要是由于二级打碎离子的能量并不像MRM为固定值,而是在1个范围内打碎,所以本研究选用一级母离子作为定量离子。
2.4 前处理回收率
本实验选用快速溶剂萃取方法提取农药,Freestyle全在线凝胶净化/定量浓缩联机系统净化提取液,因该方法具有高自动化、高稳定性的特点,因而可被广泛应用于农药残留检测中。结果显示辣椒中27种农药的回收率为65.8%~100.5%(回收率以检出限添加浓度计算),每种农药以基质液为溶剂配置标准曲线,得到线性方程及相关系数。重复6次实验的回收率及我国对于辣椒样品的最大残留限量值见表3。
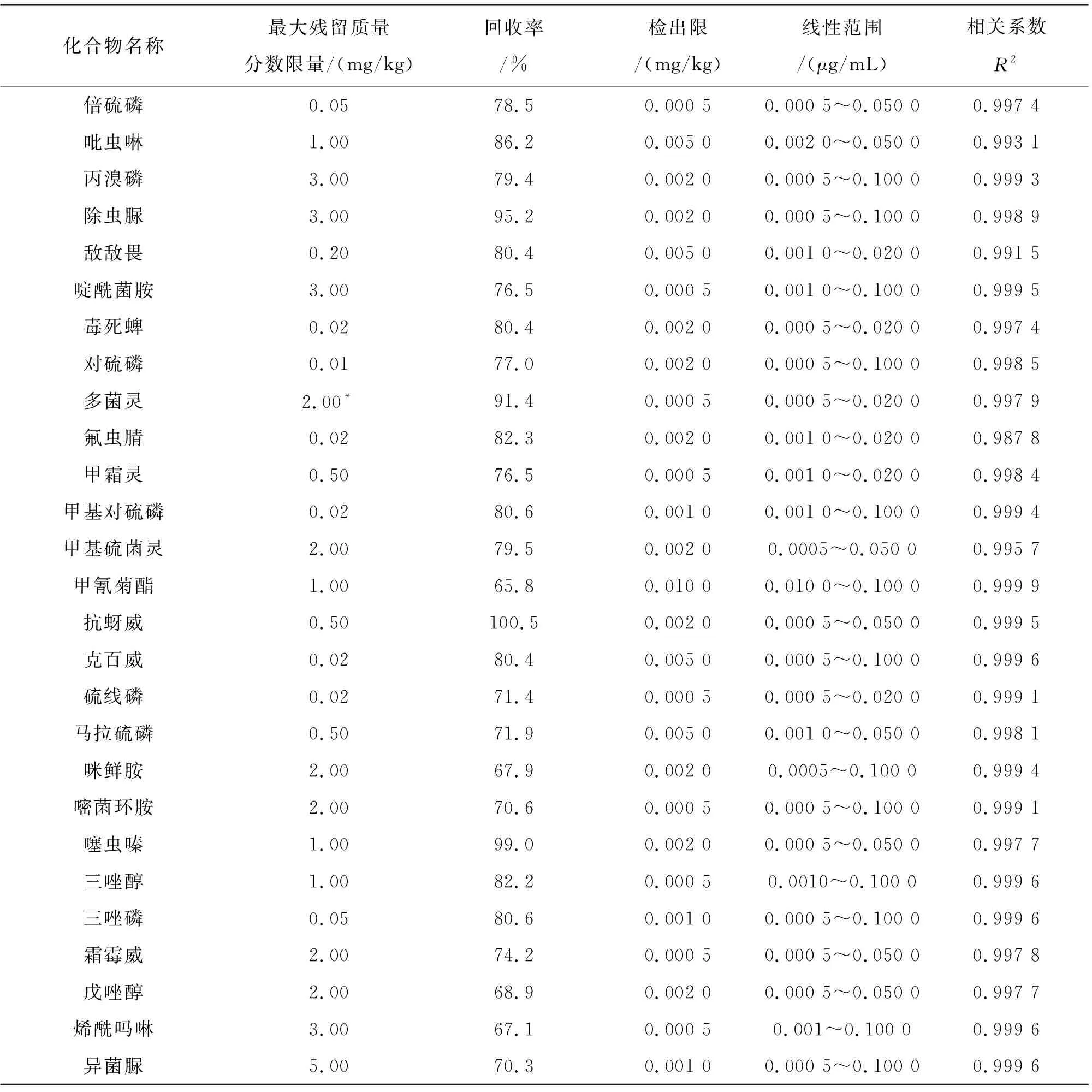
表3 27种农药在辣椒中的最大残留量、回收率、检出限、线性范围和相关系数
由表3结果可知,本方法的检出限均低于GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》中的限量标准,可满足国内市场检测的要求。
3 结论
本实验采用快速溶剂萃取法[11],实现提取的全面高效性;Freestyle全在线凝胶净化/定量浓缩联机系统进行净化,去除色素、脂肪等大分子杂质[12],应用HPLC-QTOF-MS的SWATH采集模式对辣椒样品中的农药进行非靶向筛查[13],同时完成27种常用农药的定量分析。该方法的线性关系良好、自动化程度高、准确度高,具有一定的实用性。从长远看,该方法可以延伸应用到更多种类样品的农药筛查,可以由农药检测向兽药检测、毒素检测、添加剂检测等多方面扩展。

