西式发酵火腿粗肽的制备及抗氧化活性和氨基酸组成分析
席丽琴 杨君娜 许随根 黄鑫 李家鹏 王守伟


摘 要:采用磷酸鹽缓冲液和盐酸溶液提取西式发酵火腿的粗肽,测定并比较2 种溶液提取的粗肽1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基清除能力、Fe2+螯合能力及总抗氧化能力,同时对氨基酸组成进行分析。结果表明:磷酸盐法提取得到的粗肽粉A的质量和肽含量显著高于盐酸法提取得到的粗肽粉B;在质量浓度1~5 mg/mL范围内,2 种粗肽粉的自由基清除能力均逐渐增强,当质量浓度5 mg/mL时,粗肽粉A和B的DPPH自由基清除率分别达到26.59%和30.99%,羟自由基清除率分别达到84.07%和27.49%;粗肽粉A的Fe2+螯合率为81.20%,显著高于粗肽粉B;粗肽粉A和B的总抗氧化能力在质量浓度5 mg/mL分别达到68.74%和46.11%;西式发酵火腿粗肽的氨基酸组成丰富,粗肽粉A和B的必需氨基酸占比分别为44.246%和41.746%,与抗氧化活性相关的碱性、酸性及疏水性氨基酸的总量分别达到87.560%和87.618%。综上所述,2 种西式发酵火腿粗肽均具有一定的抗氧化能力及营养价值,且磷酸盐法提取得到的粗肽具有更强的抗氧化活性和更优的氨基酸组成。
关键词:西式发酵火腿;粗肽;抗氧化活性;氨基酸组成
Preparation, Antioxidant Activity and Amino Acid Composition Analysis of Crude Peptides from
Western-Style Fermented Ham
XI Liqin, YANG Junna, XU Suigen, HUANG Xin, LI Jiapeng, WANG Shouwei*
(Beijing Key Laboratory of Meat Processing Technology, China Meat Research Centre, Beijing 100068, China)
Abstract: The present study was carried out to compare the 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity, hydroxyl radical scavenging capacity, Fe2+ chelating capacity and total antioxidant capacity of crude peptides extracted from western-style fermented ham with phosphate buffer solution and hydrochloric acid solution. Besides, their amino acid compositions were analyzed. The results showed that the mass and purity of phosphate buffer extractable peptides were significantly higher than those extracted with hydrochloric acid. The radical scavenging ability of both samples increased with increasing their concentration from 1 to 5 mg/mL. At a concentration of 5 mg/mL, phosphate buffer extractable and hydrochloric acid extractable peptides scavenged DPPH radical by 26.59% and 30.99%, and hydroxyl radical by 84.07% and 27.49% respectively. The Fe2 + chelating capacity of phosphate buffer extractable peptides was 81.20%, which was significantly higher than that of hydrochloric acid extractable peptides. Their total antioxidant capacity was 68.74% and 46.11% at 5 mg/mL, respectively. For the two samples, the essential amino acids accounted for 44.246% and 41.746% of total amino acids, respectively, and the total amount of basic, acidic and hydrophobic amino acids related to antioxidant activity was 87.560% and 87.618%, respectively. In conclusion, both crude peptides have antioxidant capacity and a certain nutritional value, and phosphate extractable peptides have stronger antioxidant activity and better amino acid composition.
Keywords: western-style fermented ham; crude peptide; antioxidant activity; amino acid composition
DOI:10.7506/rlyj1001-8123-20210830-209
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2022)01-0001-06
引文格式:
席丽琴, 杨君娜, 许随根, 等. 西式发酵火腿粗肽的制备及抗氧化活性和氨基酸组成分析[J]. 肉类研究, 2022, 36(1): 1-6. DOI:10.7506/rlyj1001-8123-20210830-209. http://www.rlyj.net.cn
XI Liqin, YANG Junna, XU Suigen, et al. Preparation, antioxidant activity and amino acid composition analysis of crude peptides from western-style fermented ham[J]. Meat Research, 2022, 36(1): 1-6. DOI:10.7506/rlyj1001-8123-20210830-209. http://www.rlyj.net.cn
活性氧自由基是需氧生物体内氧代谢的天然副产物,参与许多复杂的细胞过程,如有丝分裂信号转导、基因表达和细胞增殖调控等。机体氧化应激与炎症、动脉粥样硬化、缺血、癌症、衰老等密切相关[1-2]。抗氧化剂可以通过消耗或化学修饰清除活性氧自由基,保护细胞免受氧化应激,维持人体健康,并能预防和治疗某些疾病[3]。合成抗氧化剂包括丁基羟基甲苯、叔丁基对苯二酚、丁基羟基茴香醚和没食子酸丙酯等,由于具有较强的抗氧化活性,在食品中得到了广泛的应用。然而,合成抗氧化剂存在过量或违规使用等食品安全问题,且具有一定的毒性和致癌作用[4],高剂量或长期使用与包括癌症在内的副作用有关[5]。目前许多研究表明,天然抗氧化肽具有清除自由基或减少自由基生成、螯合金属离子、保护细胞免受由活性氧引起的氧化损伤和防止脂肪过氧化等作用[6]。与合成抗氧化剂相比,天然抗氧化肽分子质量相对较低、结构稳定、活性高、易于吸收、无有害的免疫反应,而肉制品是良好的抗氧化肽来源[7]。
发酵火腿作为发酵肉制品,加工工艺独特且加工时间长,蛋白质降解程度高,是天然生物活性肽的重要来源[8]。有大量研究表明,发酵火腿含有抗氧化肽,且提取方法的不同或不同种类的发酵火腿所含的抗氧化肽活性和氨基酸组成均有差异。胡亚亚[9]通过磷酸盐缓冲液法和盐酸法提取得到金华火腿粗肽液,结果表明,前者所提取粗肽液肽含量和体外抗氧化活性均高于后者,因此磷酸盐缓冲液法更适合金华火腿粗肽的提取;郑锦晓等[10]提取宣威火腿、金华火腿、如皋火腿粗肽进行抗氧化活性分析,结果显示,宣威火腿粗肽提取率较高,疏水性氨基酸含量较高,抗氧化能力更强;Mora等[11]利用尺寸排阻色谱法分离西班牙特鲁尔火腿、意大利帕尔玛火腿和比利时干腌火腿的肽提取物并对其潜在生物活性进行探究,结果表明,所研究的3 种火腿的肽片段均具有血管紧张素转化酶(angiotensin-converting enzyme,ACE)抑制活性、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性和Fe2+还原能力,为发酵火腿作为抗高血压和抗氧化肽的天然来源提供了很好的证据。此外,抗氧化活性与肽的氨基酸组成和序列相关[12-13]。王乐等[7]研究发现,清酱肉多肽液氨基酸组成丰富,与抗氧化活性相关的酸性、碱性及疏水性氨基酸总量达到87.75%。
传统的中式火腿投产受季节限制,且卫生条件受限,产品的质量和安全性难以保证,需要加热才能食用;而西式发酵火腿在封闭式现代化厂房中生产,采用控温控湿标准化技术,产品质量和安全性高,可直接食用。本研究采用不同溶液提取课题组自制西式发酵火腿粗肽,并探讨不同质量浓度粗肽液的自由基清除能力、Fe2+螯合能力和总抗氧化能力,同时分析所得2 种粗肽的氨基酸组成,为课题组自产发酵火腿作为天然抗氧化肽的来源及营养价值提供参考,并为在成品切片切块过程中产生的边角料提供回收利用价值,减少资源浪费和环境污染,为后期抗氧化肽的制备和开发商业化制剂提供参考。
1 材料与方法
1.1 材料与试剂
豬腿 北京二商大红门肉类食品有限公司;加工火腿用辅料 北京食品科学研究院香辛料部。
邻苯二甲醛、甲醇、乙醇、磷酸氢二钠、磷酸二氢钠、四硼酸钠、十二烷基硫酸钠、β-巯基乙醇、胰酪蛋白胨、盐酸、柠檬酸钠 国药集团化学试剂有限公司;DPPH自由基清除能力检测试剂盒、羟自由基清除能力检测试剂盒、2,2-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力检测试剂盒 苏州格锐思生物科技有限公司。
1.2 仪器与设备
ME104分析天平 瑞士Mettler-Toledo公司;D-500匀浆机 德国Wiggens公司;N-1100D-WD旋转蒸
发仪 日本Eyela器械株式会社;Sorvall LYNX-4000离心机 美国赛默飞世尔科技公司;Synergy H4酶标仪 美国BioTek仪器有限公司;L-8900氨基酸分析仪 日本Hitachi公司。
1.3 方法
1.3.1 西式发酵火腿加工工艺
原料猪腿修整成型,经过按摩机按摩后,上盐,经过盐渍(温度≤4 ℃,约15 d)、预腌制(温度≤4 ℃,相对湿度≤65%,约15 d)、腌制(温度≤6 ℃,相对湿度≤95%,约60 d)、风干(温度≤22 ℃,相对湿度≤85%,约10 d)、预熟化(温度≤16 ℃,相对湿度≤90%,约60 d)、熟化(温度≤14 ℃,相对湿度≤90%,约200 d)等加工程序成熟,成熟的火腿于4 ℃真空保存。实验用样为成熟火腿。
1.3.2 发酵火腿粗肽的提取及肽含量测定
磷酸盐提取法:参考王勇勤等[14]研究方法,略作修改。将发酵火腿去除脂肪和筋膜后,切碎,称取30.0 g,加入120 mL 0.2 mol/L磷酸盐缓冲液,均质机匀浆3 次,每次10 s;于4 ℃、12 000 r/min离心15 min;取上清液,加入3 倍体积分数40%乙醇,于4 ℃冰箱过夜;4 ℃、12 000 r/min离心15 min,取上清液旋蒸后冷冻干燥,即得粗肽粉A。
盐酸提取法:参考Castellano等[15]实验方法,略作修改。将发酵火腿去除脂肪和筋膜后,切碎,称取30.0 g,加入120 mL 0.01 mol/L盐酸,均质机匀浆3 次,每次10 s;于4 ℃、12 000 r/min离心15 min;取上清液,加入3 倍上清液体积的无水乙醇,于4 ℃冰箱过夜;4 ℃、12 000 r/min离心15 min,取上清液旋蒸后冷冻干燥,即得粗肽粉B。
肽含量测定:参考郑锦晓等[10]实验方法,取40 mg邻苯二甲醛溶于1 mL甲醇,依次加入25 mL 100 mmol/L四硼酸钠、2.5 mL质量浓度20 g/100 mL的十二烷基硫酸钠和100 μL β-巯基乙醇,用去离子水调至总体积为50 mL,为邻苯二甲醛混合液。为保证实验数据的准确性,试剂现用现配。取100 μL粗肽样品(质量浓度2 mg/mL)和2 mL邻苯二甲醛混合液混匀,室温下孵育2 min后用酶标仪在340 nm波长处测定吸光度。以胰酪蛋白胨作为标准蛋白配制4.00、2.00、1.00、0.50、0.25 mg/mL的溶液,测定其吸光度,绘制胰酪蛋白胨标准曲线后计算粗肽的肽含量。胰酪蛋白胨标准曲线为:y=0.506 4x+0.257 2(R2=0.997 2),x为多肽质量浓度(mg/mL),y为吸光度。肽含量按式(1)计算。
(1)
1.3.3 DPPH自由基清除率测定
将粗肽粉用去离子水配制成质量浓度分别为1、2、3、4、5 mg/mL的粗肽液,用DPPH自由基清除能力检测试剂盒在517 nm波长进行测定。测定管:150 μL样品+150 μL工作液;对照管:150 μL样品+150 μL体积分数80%甲醇;空白管:150 μL工作液+150 μL 80%甲醇。DPPH自由基清除率按式(2)计算。
(2)
1.3.4 羟自由基清除率测定
将粗肽粉用去离子水配制成质量浓度分别为1、2、3、4、5 mg/mL的粗肽液,用羟自由基清除能力检测试剂盒进行测定。取50 μL粗肽液加入硫酸亚铁、水杨酸、过氧化氢各50 μL,混合,实验组加入200 μL蒸馏水,对照组和空白组加入250 μL蒸馏水,反应时间20 min,于510 nm波长处测定吸光度,以不加过氧化氢为对照组,不加样品溶液为空白组,羟自由基清除率按式(3)计算。
(3)
1.3.5 Fe2+螯合能力测定
参考吴宝森等[16]实验方法,取粗肽粉用去离子水配制成质量浓度分别为1、2、3、4、5 mg/mL的粗肽液。样品组为取1 mL粗肽液,加入0.05 mL 2 mmol/L FeCl2,混匀后加入0.2 mL 5 mmol/L菲洛嗪,剧烈振荡混匀后,室温下静置10 min,于562 nm波长处测定吸光度。以去离子水代替粗肽液作为空白组。Fe2+螯合率按
式(4)计算。
(4)
式中:A样品为样品溶液562 nm波长处吸光度;A空白为空白组溶液562 nm波长处吸光度。
1.3.6 总抗氧化能力测定
ABTS法可测定样品中活性氧的总抗氧化能力(包括羟自由基、过氧化氢和超氧自由基)[17]。将粗肽粉用去离子水配制成质量浓度分别为1、2、3、4、5 mg/mL的粗肽液,用ABTS阳离子自由基清除能力检测试剂盒进行测定。测定管:10 μL样品+190 μL工作液;对照管:10 μL样品+190 μL无水乙醇;空白管:10 μL无水
乙醇+190 μL工作液;于734 nm波长处测定各体系吸光度。ABTS阳离子自由基清除率按式(5)計算。
(5)
1.3.7 发酵火腿粗肽的氨基酸组成分析
根据GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》中的方法,称0.2 g粗肽粉置于水解管中,加入10 mL 6 mol/L HCl溶液,将水解管于-20 ℃冷冻5 min,重复抽真空-充入氮气3 次后,在充氮气状态下封口。将已封口的水解管放在(110±1) ℃的电热鼓风恒温箱中,水解22 h后取出,冷却至室温、将水解液过滤至50 mL容量瓶中并定容,振荡混匀。准确吸取1 mL滤液于试管中,浓缩蒸干。干燥后残留物用1 mL水溶解,再减压干燥蒸干。最后加入1 mL pH 2.2、0.2 mol/L柠檬酸钠缓冲液溶解,振荡混匀,过0.22 μm滤膜后,转移至进样瓶,用氨基酸分析仪进行测定分析。
1.4 数据处理
实验数据采用Excel进行处理分析,并采用IBM SPSS Statistics 24.0软件进行单因素方差分析和Duncans法检验差异显著性,以P<0.05表示差异显著。所有实验均设置3 个平行,结果用平均值±标准差表示。
2 结果与分析
2.1 发酵火腿粗肽含量
由表1可知,粗肽粉A的质量显著大于粗肽粉B的质量(P<0.05),然而粗肽粉A中肽含量为30.39%,显著低于粗肽粉B(62.78%)(P<0.05)。胡亚亚等[18]提取金华火腿的肽含量最高为12.94%,显著低于本实验所提粗肽的肽含量。
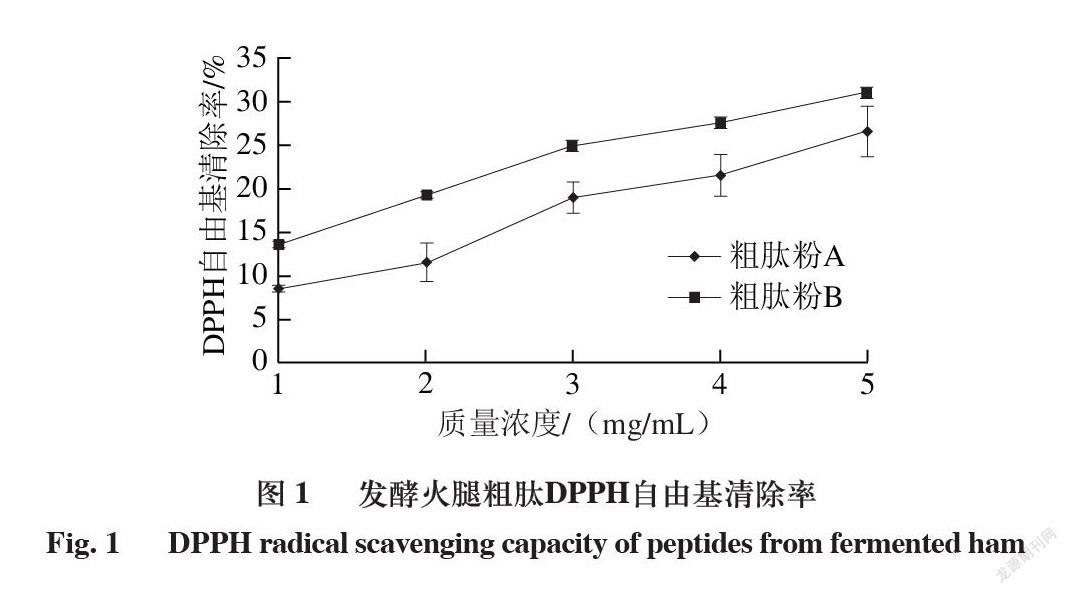
2.2 发酵火腿粗肽DPPH自由基清除能力
由图1可知,粗肽粉A和B均具有DPPH自由基清除能力。在质量浓度1 mg/mL时,粗肽粉A和B的DPPH自由基清除率分别为8.38%和13.62%,在质量浓度5 mg/mL时则分别达到26.59%和30.99%,表明在质量浓度1~5 mg/mL范围内,粗肽粉A和B的DPPH自由基清除能力均随着质量浓度的增大而增强,粗肽粉B的DPPH自由基清除率显著高于粗肽粉A(P<0.05),而胡亚亚等[18]在金华火腿中利用0.2 mol/L磷酸和0.01 mol/L盐酸得到的粗肽DPPH自由基清除率分别为44.2%和46.0%,没有显著差异,可能是火腿品种的不同造成。
DPPH自由基是一种脂溶性自由基[19],粗肽粉B的DPPH自由基清除率高说明盐酸提取的粗肽溶液可以作为电子供体,更容易与DPPH自由基结合,终止自由基链式反应,从而发挥抗氧化作用。Escudero等[20]用盐酸提取西班牙干腌火腿水溶性组分后经过凝胶过滤分馏得到不同组分,DPPH自由基清除率从39%到92%不等,高于本研究中盐酸提取粗肽的DPPH自由基清除率,可能是采用的火腿制作工艺不同,且提取后进行了纯化所致。
2.3 发酵火腿粗肽羟自由基清除能力
羟自由基在活性氧自由基中化学活性最强,是对生物体进攻性最强、危害性最大的活性自由基,通过脱氢、电子转移、加成等作用引起氧化损伤,使细胞坏死或突变,最终引起人体衰老、肿瘤、辐射损伤或细胞吞噬疾病等,因此清除羟自由基是生物体抵抗各种疾病最有效的防御措施之一[21-22],羟自由基清除能力是衡量物质抗氧化性的重要指标[7]。
由图2可知,粗肽粉A和B均具有羟自由基清除能力。在质量浓度1 mg/mL时,粗肽粉A和B的羟自由基清除率分别为18.65%和7.99%,在质量浓度5 mg/mL时分别达到84.07%和27.49%,表明在质量浓度1~5 mg/mL范围内,粗肽粉A和B的羟自由基清除能力均随着质量浓度的增大而增强,具有剂量依赖性。粗肽粉A的羟自由基清除率显著高于粗肽粉B(P<0.05)。吴宝森等[16]用磷酸盐溶液提取诺邓火腿的抗氧化肽,质量浓度1 mg/mL時,粗肽的羟自由基清除率只有9.57%,比本研究中粗肽粉A的清除率低9.08%;诺邓火腿粗肽经分离纯化后抗氧化活性最强的组分羟自由基清除率在质量浓度1 mg/mL时达到73.01%,表明粗肽在分离纯化后抗氧化活性有大幅提高。
2.4 发酵火腿粗肽Fe2+螯合能力
过渡态金属离子(Fe2+、Cu2+、Co2+等)能作为媒介催化不饱和脂质氧化过程中自由基的产生,如羟自由基和超氧阴离子自由基,进而影响食品安全,对人体健康造成威胁[23]。抗氧化剂可以与金属离子进行螯合,对其催化活性产生影响,进而抑制脂质氧化速率,因此金属离子螯合能力常作为评价物质抗氧化能力的方法之一[24-25]。
由图3可知,粗肽粉A的Fe2+螯合率在质量浓度1~5 mg/mL范围内从61.7%上升至81.2%,螯合能力随质量浓度的增加而增强,呈现一定剂量依赖性。而粗肽粉B的Fe2+螯合率为1.07%~2.56%,与粗肽粉A相比差异极显著(P<0.01),其螯合率几乎可以忽略不计。Fe2+能够与酸性氨基酸和中性氨基酸侧链中的氨基和羧基紧密结合,从而含量降低,抑制自由基的产生[26-27],结果表明,粗肽粉A的Fe2+螯合能力更强。吴宝森等[28]利用磷酸盐溶液提取的诺邓火腿多肽在质量浓度为5.0 mg/mL时,Fe2+螯合率达31.38%,显著低于粗肽粉A的Fe2+螯合率,表明不同种类的火腿提取得到的粗肽抗氧化能力存在一定的差异。
2.5 发酵火腿粗肽ABTS阳离子自由基清除能力
ABTS阳离子自由基清除法通常用于评价抗氧化物质的总抗氧化能力,该方法具有操作简便、反应迅速、灵敏度高等特点[29-30]。由图4可知:在质量浓度1 mg/mL时,粗肽粉A和B的ABTS阳离子自由基清除率分别为19.48%和19.67%,没有显著差异;在质量浓度5 mg/mL时,粗肽粉A和B的ABTS阳离子自由基清除率分别为68.74%和46.11%,前者极显著高于后者(P<0.01);且在质量浓度1~5 mg/mL范围内,二者的ABTS阳离子自由基清除率均随质量浓度的增加而增强,呈现一定剂量依赖性。结果表明,粗肽粉A的总抗氧化能力优于粗肽粉B。
2.6 发酵火腿粗肽氨基酸组成分析
由表2可知,粗肽粉A和B的必需氨基酸含量分别占总氨基酸含量的44.246%和41.746%,表明实验室产西式发酵火腿中提取的粗肽具有一定的营养价值,且粗肽粉A的必需氨基酸含量显著高于粗肽粉B(P<0.05),推测采用磷酸盐缓冲液提取对发酵火腿的营养破坏程度更低。
肽的抗氧化活性及其强弱与其氨基酸的构成密切相关[31]。肽序列中的氨基酸大小、组成、位置以及氨基酸的结构和疏水性均影响肽的抗氧化活性[32]。抗氧化活性高的多肽通常含有较高比例的疏水性氨基酸,疏水性氨基酸可通过清除自由基来增强抗氧化活性[33-34]。含有疏水性氨基酸的多肽通过与氧结合或者减少体系中氢的释放来阻断氧化进程,从而发挥抗氧化功能[8]。粗肽粉A和B的疏水性氨基酸含量占比分别为39.924%和38.793%,粗肽粉A的疏水性氨基酸含量占比略高,一定程度上解释了抗氧化活性实验结果中粗肽粉A的活性整体高于粗肽粉B的原因。
此外,粗肽粉A和B的酸性氨基酸含量占比分别为22.493%和19.477%,碱性氨基酸含量占比分别为25.14%和29.35%,结合疏水性氨基酸含量,粗肽粉A和B中这3 类具有抗氧化作用的氨基酸分别占总氨基酸含量的87.560%和87.618%,表明粗肽粉A和B均具有一定的抗氧化活性。而粗肽粉A的抗氧化活性整体高于粗肽粉B,可能与氨基酸的序列及构成有关。
3 结 论
利用磷酸盐提取液和盐酸提取液提取實验室自制西式发酵火腿的粗肽,通过测定DPPH自由基清除能力、羟自由基清除能力、Fe2+螯合能力和总抗氧化能力,对2 种粗肽的抗氧化能力进行评价,并进行氨基酸组成分析。结果表明:2 种粗肽均具有一定的抗氧化活性,除粗肽粉B的Fe2+螯合能力之外,2 种粗肽的抗氧化能力随着粗肽液质量浓度的增加而增强,且粗肽粉A的抗氧化活性整体高于粗肽粉B,磷酸盐溶液更适合提取西式发酵火腿多肽;同时,对2 种粗肽的氨基酸组成进行分析,结果显示,2 种粗肽必需氨基酸含量占比均超40%,表明2 种粗肽均具有一定的营养价值,此外,与抗氧化活性相关的酸性氨基酸、碱性氨基酸和疏水性氨基酸的总占比均超87%,表明2 种粗肽的抗氧化能力与氨基酸组成密切相关。后期有必要对西式发酵火腿粗肽进行进一步分离纯化、结构鉴定和相关性质研究,以期为成品切片过程中产生的边角料回收利用提供思路,并为开发抗氧化性相关制剂提供参考。
参考文献:
[1] RAHMAN M S, CHOI Y H, CHOI Y S, et al. A novel antioxidant peptide, purified from Bacillus amyloliquefaciens, showed strong antioxidant potential via Nrf-2 mediated heme oxygenase-1 expression[J]. Food Chemistry, 2018, 239: 502-510. DOI:10.1016/j.foodchem.2017.06.106.
[2] XING Lujuan, HU Yaya, HU Hongyan, et al. Purification and identification of antioxidative peptides from dry-cured Xuanwei ham[J]. Food Chemistry, 2016, 194: 951-958. DOI:10.1016/j.foodchem.2015.08.101.
[3] KIM J K, JANG H D. Nrf2-mediated HO-1 induction coupled with the ERK signaling pathway contributes to indirect antioxidant capacity of caffeic acid phenethyl ester in HepG2 cells[J]. International Journal of Molecular Sciences, 2014, 15(7): 12149-12165. DOI:10.3390/ijms150712149.
[4] 张艳侠, 赵慧男, 孙珊珊, 等. 通过式SPE-UPLC-MS/MS测定植物油中的9 种酚类抗氧化剂[J]. 食品科学, 2021, 42(10): 322-329. DOI:10.7506/spkx1002-6630-20200416-207.
[5] SAITO M, SAKAGAMI H, FUJISAWA S. Cytotoxicity and apoptosis induction by butylated hydroxyanisole (BHA) and butylated hydroxytoluene (BHT)[J]. Anticancer Research, 2003, 23(6C): 4693-4701.
[6] 吴宝森, 孙玥晖, 刘姝韵, 等. 火腿中抗氧化肽的研究进展[J]. 食品安全质量检测学报, 2016, 7(12): 4809-4814. DOI:10.19812/j.cnki.jfsq11-5956/ts.2016.12.025.
[7] 王乐, 李享, 刘文营, 等. 清酱肉多肽的抗氧化活性和氨基酸分析[J]. 肉类研究, 2019, 33(2): 19-24. DOI:10.7506/rlyj1001-8123-20181228-241.
[8] 李平, 杨婷, 周辉, 等. 干腌火腿中生物活性肽功能特性研究进展[J]. 食品科学, 2021, 42(11): 278-283. DOI:10.7506/spkx1002-6630-20200418-238.
[9] 胡亚亚. 金华火腿粗肽液的制备及抗氧化活性研究[D]. 南京: 南京农业大学, 2016: 26.
[10] 郑锦晓, 邢路娟, 周光宏, 等. 三种中国传统干腌火腿中粗多肽的抗氧化与抑菌活性的比较[J]. 食品工业科技, 2018, 39(16): 75-79; 86. DOI:10.13386/j.issn1002-0306.2018.16.014.
[11] MORA L, ESCUDERO E, TOLDR? F. Characterization of the peptide profile in Spanish Teruel, Italian Parma and Belgian dry-cured hams and its potential bioactivity[J]. Food Research International, 2016, 89: 638-646. DOI:10.1016/j.foodres.2016.09.016
[12] MORA L, BOLUMAR T, HERES A, et al. Effect of cooking and simulated gastrointestinal digestion on the activity of generated bioactive peptides in aged beef meat[J]. Food and Function, 2017, 8(12): 4347-4355. DOI:10.1039/c7fo01148b.
[13] GALLEGO M, MORA L, HAYES M, et al. Effect of cooking and in vitro digestion on the antioxidant activity of dry-cured ham by-products[J]. Food Research International, 2017, 97: 296-306. DOI:10.1016/j.foodres.2017.04.027.
[14] 王勇勤, 郭新, 馬雪莲, 等. 羊肉火腿加工过程中粗肽抗氧化活性[J]. 食品科学, 2019, 40(21): 65-71. DOI:10.7506/spkx1002-6630-20181103-036.
[15] CASTELLANO P, MORA L, ESCUDERO E, et al. Antilisterial peptides from Spanish dry-cured hams: purification and identification[J]. Food Microbiology, 2016, 59: 133-141. DOI:10.1016/j.fm.2016.05.018.
[16] 吴宝森, 王桂瑛, 谷大海. 诺邓火腿抗氧化肽的分离纯化与鉴定[J]. 食品与发酵工业, 2018, 44(7): 102-109. DOI:10.13995/j.cnki.11-1802/ts.015594.
[17] 叶昱辉. 近江牡蛎多肽的分离纯化及其抗氧化、抗光老化活性研究[D]. 广州: 华南理工大学, 2018: 34.
[18] 胡亚亚, 邢路娟, 周光宏, 等. 不同提取方法对金华火腿粗肽液抗氧化活性的影响[J]. 食品工业科技, 2015, 36(14): 115-118. DOI:10.13386/j.issn1002-0306.2015.14.014.
[19] 冯美琴, 余頔, 孙健. 发酵剂对发酵香肠蛋白质降解及多肽抗氧化能力的影响[J]. 食品科学, 2020, 41(20): 97-104. DOI:10.7506/spkx1002-6630-20200521-251.
[20] ESCUDERO E, ARISTOY M C, NISHIMURA H, et al. Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J]. Meat Science, 2012, 91(3): 306-311. DOI:10.1016/j.meatsci.2012.02.008.
[21] 忽晓平. 金华火腿多肽的提取及功能特性研究[D]. 郑州: 河南农业大学, 2017: 37-38.
[22] JE J Y, PARK P J, KIM S K. Antioxidant activity of a peptide isolated from Alaska pollack (Theragra chalcogramma) frame protein hydrolysate[J]. Food Research International, 2005, 38(1): 45-50. DOI:10.1016/j.foodres.2004.07.005.
[23] SAIGA A I, TANABE S, NISHIMURA T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Agricultural and Food Chemistry, 2003, 51(12): 3661-3667.
[24] WARAHO T, MCCLEMENTS D J, DECKER E A. Mechanisms of lipid oxidation in food dispersions[J]. Trends in Food Science and Technology, 2011, 22(1): 3-13. DOI:10.1016/j.tifs.2010.11.003.
[25] 朱敏方. 草鱼鱼肉抗氧化肽的制备、分离鉴定及其活性研究[D]. 南昌: 江西师范大学, 2020: 19.
[26] 周婷, 吴瑀婕, 卢方云, 等. 鸡膝软骨胶原蛋白肽的超声辅助酶提工艺优化及抗氧化性[J]. 肉类研究, 2021, 35(4): 7-15. DOI:10.7506/rlyj1001-8123-20210226-048.
[27] RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38(2): 175-182. DOI:10.1016/j.foodres.2004.10.002.
[28] 吳宝森, 谷大海, 王桂瑛, 等. 诺邓火腿粗肽抗氧化活性及亚硝酸钠清除活性[J]. 肉类研究, 2017, 31(8): 6-11. DOI:10.7506/rlyj1001-8123-201708002.
[29] 陈向阳, 汪润舒, 康清俊, 等. 野生祁白术精油化学成分及对自由基的清除作用[J]. 鲁东大学学报(自然科学版), 2021, 37(3): 228-234.
[30] 石菊芬. 藏系绵羊胎盘肽的制备及其抗氧化能力研究[D]. 兰州: 兰州理工大学, 2020: 9.
[31] SUN Weizheng, ZHAO Haifeng, ZHAO Qiangzhong, et al. Structural characteristics of peptides extracted from Cantonese sausage during drying and their antioxidant activities[J]. Innovative Food Science and Emerging Technologies, 2009, 10(4): 558-563. DOI:10.1016/j.ifset.2009.07.006.
[32] NWACHUKWU I D, ALUKO R E. Structural and functional properties of food protein-derived antioxidant peptides[J]. Journal of Food Biochemistry, 2019, 43(1): e12761.
[33] AO J, LI B. Amino acid composition and antioxidant activities of hydrolysates and peptide fractions from porcine collagen[J]. Food Science and Technology International, 2012, 18(5): 425-434. DOI:10.1177/1082013211428219.
[34] GALLEGO M, MAURI L, ARISTOY M C, et al. Antioxidant peptides profile in dry-cured ham as affected by gastrointestinal digestion[J]. Journal of Functional Foods, 2020, 69: 103956. DOI:10.1016/j.jff.2020.103956.

