BMP4 抑制剂DMH1 对BiSF 法诱导人iPSC 向神经元分化效率的提升作用
刘艳娜,任兆瑞,2,颜景斌,2
1.上海市儿童医院/上海交通大学附属儿童医院上海交通大学医学遗传研究所,上海 200040;2.上海市胚胎与生殖工程重点实验室/国家卫健委医学胚胎分子生物学重点实验室,上海 200040
近年来,随着全球人口的老龄化,神经退行性疾病的发病率逐渐升高。这类疾病的共同病理特征是大脑神经元数量的减少及功能的丧失,最终导致认知障碍、记忆功能丧失及运动感觉功能缺失等神经系统异常的临床表现[1]。世界卫生组织预测,到2040 年神经退行性疾病的死亡率将超过癌症,成为世界第二大致死性疾病,它已经严重影响人类的生活质量。但是,至今还没有针对这类疾病的有效治疗方案。因此,对神经退行性疾病的发病机制进行研究具有重要的意义。
过去的研究中,神经退行性疾病的研究主要集中在非神经系统的细胞系和模型小鼠中,但是这些细胞或动物模型并不能完全反映人类神经退行性疾病的病理学特征。直到2006 年,YAMANAKA 等[2]通过向体细胞中导入一些转录因子,获得了诱导多能干细胞(induced pluripotent stem cell,iPSC)。iPSC 作为研究人类疾病发病机制和评估治疗方法的模型显示出巨大潜力。
iPSC 的多能性使其可以向多种细胞分化。体外将人诱导多能干细胞(human induced pluripotent stem cell,hiPSC)定向诱导分化为神经细胞,解决了动物和人之间的种属差异以及人类样本稀缺性的问题,为体外研究神经退行性疾病的分子机制提供了一种很好的模型。CHANG 等[3]利用BiSF 方法成功将DS-iPSC 诱导为神经元细胞。BiSF 方法中最关键的2 种诱导因子分别是6-溴靛玉红-3'-肟(6-bromoindirubin-3'-oxime,BIO) 和SB431542,二者均有促进神经元的生长和功能恢复的作用[4-7]。众所周知,骨形态发生蛋白(bone morphogenetic protein,BMP)可以阻断神经的分化,促进表皮细胞的发育,所以抑制BMP 对神经诱导是非常关键的,而BIO 和SB431542 都没有抑制BMP 的作用。另外,SB431542 对iPSC 分化的作用还存在一定的争议[8,9]。因此,我们推测BiSF 方法并不能达到最佳的诱导效率。所以本研究在BiSF 方法的基础上添加了BMP4 抑制剂4-[6-(4-异丙氧基苯基)吡唑并[1,5-a]嘧啶-3-基]喹啉(4-[6-[4-(1-methylethoxy)phenyl]pyrazolo[1,5-a]pyrimidin-3-yl]quinoline,DMH1),通过对BiSF 诱导方法的改进,以期获得一种更为稳定的hiPSC 向神经元分化的诱导方法。
1 材料与方法
1.1 材料
1.1.1 细胞 本研究使用的hiPSC购自美国模式培养物集存库(American type culture collection,ATCC)(ACS-1011),是由正常男性新生儿的包皮成纤维细胞诱导而成。
1.1.2主 要 试 剂DMEM-F12、 Neurobasal、Essential 8 培养基、N-2 添加剂、B27、NEAAs、Matrix、Knockout血清替代物、Geltrex 及2-巯基乙醇购于美国Invitrogen 公司,干细胞专用消化液购于ATCC,SB431542、Y-27632、TritonX-100、牛血清白蛋白(bovine albumin,BSA)及BIO 均购于美国Sigma 公司,重组人碱性成纤维细胞生长因子2
(recombinant human fibroblast growth factor 2, rh-FGF2) 购于美国R&D 公司,DMH1 购于美国TargetMol公司,4%多聚甲醛购于上海朝瑞生物科技有限公司,细胞计数试剂盒8(cell counting kit-8,CCK-8)购于上海碧云天生物技术有限公司。
1.1.3 抗体 实验中用到的一抗:小鼠抗人SSEA1 购于英国Abcam 公司,小鼠抗人neuronal βⅢ微管蛋白(β Ⅲ-tubulin) 购于上海碧云天生物技术有限公司,小鼠抗人nestin 购于美国R&D 公司。二抗:Alexa Fluro 488 标记的山羊抗鼠免疫球蛋白G (immunoglobulin G,IgG) 购于英国Abcam 公司,Cy3 标记山羊抗小鼠IgG 及细胞染色液4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)均购于上海碧云天生物技术有限公司。
1.2 方法
1.2.1 hiPSC 培养 hiPSC 培养在预先铺有Geltrex的培养皿中,每日换液,当细胞融合到70%~80%时用干细胞专用消化液消化细胞,接种于铺有Geltrex的35 mm 培养皿中,置于37 ℃、5% CO2的孵箱中培养。
1.2.2 hiPSC 定向诱导分化为神经元 当hiPSC 融合到75%左右启动分化,共分为3 组:对照组、BiSF 组及BiSF+DMH1 组。将细胞消化后从Geltrex包被培养皿中分离,在未包被的培养皿中培养2 d,对照组hiPSC 后续不做任何处理,BiSF 组及BiSF+DMH1 组换新的DMEM-F12 培养基(包含20%Knockout 血清替代物、2 mmol 谷氨酸盐、1 mmol NEAAS 及0.1 mmol 2-巯基乙醇),在孵箱中培养2 d。分化第5 日,更换新的DMEM-F12 培养基(包含2% N-2 添加剂、1 mmol NEAAS 及2 mmol 谷氨酸盐),同时其中BiSF 组加入神经诱导因子0.5 μmol BIO、10 μmol SB431542及10 ng/mL rh-FGF2,BiSF+DMH1组除了加入上述试剂还要加入0.5 μmol DMH1。培养3 d 后将培养基换为神经元培养基(包含1%N-2添加剂及10 ng/mL rh-FGF2)。培养4 d 后,将细胞消化后转移到预铺Matrigel 的培养皿中,培养基中加入2%B27、10 ng/mL rh-FGF2及10 μmol Y-27632。培养5 d后进行后续的鉴定实验。
1.2.3 免疫荧光 将细胞种在Matrigel 预处理的玻片上,培养1 d 后,弃去培养基,用PBS 洗3 次,加入2 mL 4%多聚甲醛室温静置30 min,PBS 洗3 次,每次10 min。吸干PBS,加入0.2% TritonX-100 约1 mL,冰上静置15 min,PBS 洗3 次,每次10 min。吸干PBS,加入5% BSA,室温封闭1 h,PBS 洗3次,每次10 min。加入稀释后的一抗[SSEA1(稀释比例1∶200)、TRA-1-60 (稀释比例1∶200)、nestin(稀释比例1∶200)及βⅢ-tubulin(稀释比例1∶200)]。一抗4 ℃过夜,第2 日吸去一抗,PBS 洗3 次,每次10 min,加入稀释后的二抗,二抗Alexa Fluro 488 (稀释比例1∶500)、Cy3 标记(稀释比例1∶400),室温孵育1.5 h。PBS 洗3 次,加入DAPI 室温孵育10 min,PBS 洗3 次后镜下观察。
1.2.4 实时荧光定量PCR 采用Trizol 法抽提细胞的总RNA,用紫外吸收法测定RNA 的浓度,取1 000 ng 的RNA,以Oligo(dT)为引物,用反转录酶试剂盒(SuperScript ⅣFirst-Strand Synthesis System)合成cDNA,以稀释后的cDNA(稀释比例1∶5) 为模板,每个样本设3 个复孔,使用SYBR Green Premix ExTaq (TaKaRa) 进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)反应,并在ABI7500 实时定量PCR 仪上进行反应及数据的收集。选用管家基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参来衡量目的基因的表达量。引物序列详见表1。

表1 qRT-PCR检测相关基因的引物序列Tab 1 Genes and primer sequences used for qRT-PCR analysis
1.2.5 CCK-8 检测细胞增殖 将具有神经干细胞(neural stem cells,NSC)特性的细胞制成悬液后吸取100 μL 加入预铺有Matrigel 基质胶的96 孔板,细胞密度为1 000 个/孔,空白对照组只加入培养基,放入5%CO2、37 ℃培养箱内,第2 日向每孔中加入10 μL CCK-8,培养箱内孵育2 h,用酶标仪测定450 nm 处的吸光度。实验分为BiSF 组和BiSF+DMH1 组,每组5 个平行孔及1 个空白对照孔,共检测5 d,实验重复3 次。取5 个平行孔的平行吸光度值减去空白对照组的吸光度值,绘制诱导分化细胞的生长曲线。
1.3 统计学分析
采用SPSS 19.0 软件进行统计学分析并结合GraphPad Prism 5 软件进行绘图。定量资料采用x±s表示,2 组间比较采用t检验。以P<0.05 表示差异具有统计学意义。
2 结果
2.1 hiPSC形态及鉴定
正常hiPSC 通过无滋养层培养基进行培养,并且每日换液。从细胞形态上观察,hiPSC 的细胞形态与胚胎干细胞(embryonic stem cell,ES)相似,呈典型的克隆状生长。免疫荧光结果显示培养的hiPSC 能表达多能干细胞特异性基因SSEA1、TRA-1-60,分别显示为绿色荧光和红色荧光(图1A、B)。
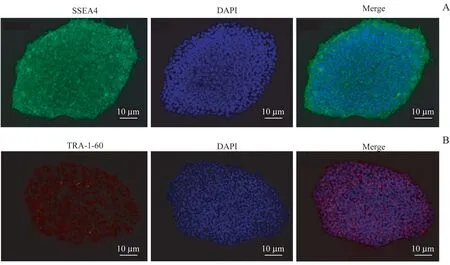
图1 hiPSC形态及多能性的鉴定Fig 1 hiPSC morphology and pluripotency identification
2.2 镜下观察不同诱导方法下细胞形态的变化
当hiPSC 融合到75%时,消化hiPSC,将细胞克隆团转移到未铺基质胶的培养皿中,共分为3 个组,分别为BiSF+DMH1 组、BiSF 组,及未处理的对照组。在诱导分化第9 日可以看到BiSF+DMH1 组的细胞团周围出现大量神经样梭形细胞(图2A),BiSF组细胞团周围出现少量突触细胞,并且细胞团灰暗不规则(图2B),而未作任何处理的hiPSC 并未贴壁(图2C)。这个结果提示,2 种诱导方法均可能将hiPSC诱导分化为神经样的细胞。

图2 诱导分化第9日镜下观察细胞形态Fig 2 Cell morphologies were observed under microscope on day 9 of differentiation
2.3 免疫荧光检测NSC相关蛋白的表达
诱导分化第10 日将细胞团消化成单细胞后,接种到Matrigel 预处理的玻片上,培养2 d 后免疫荧光检测nestin 的表达。结果显示,2 个诱导组的细胞均表达NSC 特异性蛋白nestin,说明2 种方法都能将hiPSC 诱导分化为表达NSC 特异性基因的细胞,但是荧光强度和细胞形态并没有很明显的差异(图3A)。
随后,我们比较了2 种方法诱导细胞增殖的情况。将诱导分化的细胞团消化成单个悬浮细胞后,接种到预铺有Matrigel 的96 孔板中,加入CCK-8 后检测D(450 nm)值,连续监测5 d。结果显示,培养后第2 日的BiSF+DMH1 组D(450 nm)值高于BiSF组(0.69±0.02vs0.30±0.01),之后几日的BiSF+DMH1 组D(450 nm)始终保持比较高的数值,在第5 日差异更加明显(2.49±0.15vs1.37±0.06)并且差异都具有统计学意义(P=0.000,P=0.002)(图3B)。这一结果表明,BiSF+DMH1 诱导组的NSC 样细胞增殖能力明显强于BiSF诱导组。
2.4 多能性基因及NSC相关基因的表达检测
为了进一步比较2 种方法将hiPSC 诱导为具有NSC 特性细胞的能力,我们又检测了干细胞相关基因的表达。qRT-PCR 结果显示,诱导分化第13 日,2种方法诱导的细胞基本都不表达iPS 细胞特异性的多能基因NANOG及OCT4(图4A、B),同时检测了NSC 相关基因nestin 及PAX6的表达情况,结果发现nestin 表达量在BiSF+DMH1 细胞组中明显高于BiSF组(4.71±0.76vs1.58±0.30),PAX6在BiSF+DMH1组的表达量也明显高于BiSF 组(3.48±0.74vs0.59±0.22)(图4C、4D),且差异均具有统计学意义(P=0.019,P=0.011)。这些结果进一步说明了BiSF+DMH1组的诱导效率比BiSF组更高。

图4 诱导第13日多能性基因及NSC相关基因表达水平比较Fig 4 mRNA expression levels of pluripotency-related genes and NSC-related genes on day 13 of differentiation
2.5 神经元特异性基因表达水平的比较
既然BiSF+DMH1 诱导分化的细胞具有NSC 特性,且细胞的增殖能力比BiSF 诱导组的强,那么用此种方法诱导分化的NSC 样细胞是否能更加高效地分化为具有神经元特性的细胞呢?随后,我们将2 组诱导方法获得的NSC 继续向神经元分化,并采用免疫荧光检测分化细胞的神经元特异性微管蛋白βⅢ-tubulin 的表达情况。结果发现,2 组中均能检测到βⅢ-tubulin 表达阳性的细胞,而BiSF+DMH1 组的红色荧光强度明显强于BiSF 诱导组(图5A)。通过Image J软件分析也发现BiSF+DMH1诱导组带有红色荧光的细胞数量明显多于BiSF 诱导组(65.82%±5.43%vs30.38%±7.56%),且这种差异具有统计学意义(P=0.003)(图5B)。
同时,我们采用qRT-PCR 技术检测2 组细胞中神经元特异性基因MAP2的表达情况,结果发现,BiSF+DMH1 组MAP2的相对表达水平明显高于BiSF组(3.84±0.59vs1.28±0.22),而对照组hiPSC 几乎不表达神经元特异性基因MAP2(P=0.006)(图5C)。上述结果说明,BiSF+DMH1 的诱导方法能够更有效地将hiPSC 诱导分化为具有神经元特性的细胞。

图5 神经元特异性标志物的检测Fig 5 Detection of neuron-specific markers
3 讨论
神经退行性病变的研究方法很多,最常用的就是建立小鼠疾病模型。但是人类与动物之间存在着种属差异,动物模型不能完全真实地反映人体中的情况。而对于神经退行性疾病而言,只有从脑组织中获取人体组织样本才具有重要意义,这就使样本的获取变得非常困难。因此,神经系统疾病研究的挑战之一就是找到一个有效的细胞研究系统,它应该具有以下特性:①安全性和可重复性。②不涉及科学伦理问题。③发育起源与神经谱系接近。④可以在体外稳定地扩增,并可以很好地反映疾病的特性。⑤可用于细胞介导疗法[10]。iPSC 的出现解决了这些问题,它可以来源于不同类型的体细胞,这些体细胞一般取自于健康人或患者,并通过重编程获得iPSC,这些iPSC携带体细胞中所有的遗传突变和基因的多态性。利用iPSC 的多能性,将其诱导分化为所需要的细胞,特别是神经细胞,成为研究神经系统病变发生机制的一种重要方法。
将iPSC 定向分化为神经细胞主要分为2 个过程:①将多能干细胞,定向诱导为NSC。②将NSC 诱导分化为终末神经细胞,包括神经元、神经胶质细胞等。常用的诱导方法是将iPSC 悬浮培养后形成拟胚体(embryoidbody,EB),逐步分阶段地加入诱导因子,最终达到定向分化的目的。因此,选择合适的诱导因子在整个分化过程中至关重要。CHANG 等[3]利用BiSF 的方法,在诱导过程中添加了BIO、SB431542 及FGF2,将DS-iPSC 定向诱导分化为神经元,并且在诱导分化的神经元中发现了阿尔茨海默病特有的病变,其出现β-淀粉样蛋白的聚集及tau 蛋白过度磷酸化。BIO 与FGF2 对细胞的分化都有促进作用。FGF2 是一种活化的成纤维细胞生长因子,可增强脊椎动物和ESC 中的神经分化的能力,有效地将hESC 转化为NSC[11]。BIO 可以激活Wnt 信号通路[12-13],在神经分化初始阶段的维持OCT4水平,其对神经外胚层的作用至关重要,促进hESC 的神经分化[14]。SB431542 是TGF-β-Smad2/3 通路的特异性抑制剂,可通过Smad2/3调节多能性基因Sox2、Oct4及Nanog的表达[15],促进ESC 或iPSC 向神经细胞分化[16-18]。但是,有研究指出SB431542 有助于维持ESC 的未分化状态[19],并且在小鼠iPSC 生成的过程中,可以代替诱导因子Oct4或者Sox2,加入SB431542 与其他诱导因子,同样可以成功诱导出iPSC[8-9]。可以看出,SB431542 对iPSC 分化的作用仍然存在一定争议。所以本文将BiSF 诱导方法进行改进,选择加入一种BMP 抑制剂来提高iPSC 向神经元分化的诱导效率。
BMP 能够抑制神经细胞的分化,已是大家所公认的[20-21]。将iPSC 在含有BMP4 上清液的培养基中进行培养,人们发现Smad1 被磷酸化,iPSC 的分化得到有效的抑制。此种方法培养3代后,不仅iPSC的表型可以有效维持,iPSC中的多能基因的表达也未受到影响。同时,这些iPSC 仍有向3 个胚层分化的能力[22]。DMH1 可以直接作用于BMP4,通过抑制BMP4,从而使Smad3 磷酸化降低,达到促进神经分化的作用[23]。前文提到SB431542 也能够抑制Smad3磷酸化,阻断TGFβ信号,但是对BMP介导的Smad3磷酸化没有作用,它对BMP 是没有直接作用的[24]。所以本研究在BiSF 基础上加入BMP4 的抑制剂DMH1,希望能够提高iPSC向神经细胞分化的效率。
我们在悬浮培养hiPSC 2 d 后启动诱导分化,分化第5 日除了加入BIO 和SB431542,又加入了BMP4抑制剂DMH1。结果发现与BiSF 组相比,加入DMH1后除了细胞形态有所不同(图2),NSC特异性基因nestin、PAX6的表达量明显增多(图4)。Nestin与PAX6都是参与NSC 分化调控的重要基因,二者均在中枢神经发育的一段时间内有表达,之后会被成熟神经细胞所特有的蛋白取代,而它们表达高峰期也恰为NSC 增殖的最旺盛时期[25-27]。因此,我们检测了这个时期细胞的增殖情况,结果发现BiSF+DMH1 组的细胞增殖能力明显高于BiSF+DMH1 组(图3B)。这说明2 种诱导方法均能将hiPSC 诱导分化为具有NSC 特性的细胞,但是BiSF+DMH1 诱导组能更加有效地将iPSC诱导分化为具有NSC特性的细胞。
NSC 具有分裂增殖的能力,在特定的条件下将分化为神经元、星形胶质细胞和少突胶质细胞等不同类型的神经细胞。所以,我们还观察了2组中的NSC样细胞分化为神经元的能力。结果发现,2 种方法诱导的细胞均检测到神经元特异性蛋白βⅢ-tubulin的表达,但是BiSF+DMH1 诱导组中βⅢ-tubulin 阳性的细胞的占比达到65.8%,明显高于BiSF组(图5A、B)。而且BiSF+DMH1 组细胞中MAP2表达水平亦高于BiSF 组(图5C)。这些结果说明BiSF+DMH1 方法诱导出的NSC 样细胞能够更高效地分化为具有神经元特性的细胞。
近年来,NSC 移植治疗神经退行性疾病方面的研究取得了较大突破。越来越多的研究报告,几种神经退行性疾病的动物模型在NSC 移植治疗后,症状都得到一定得改善[28-31]。我们通过对BiSF 方法的改进,显著地提高了将hiPSC 诱导分化为神经系统细胞的效率,将为神经退行性疾病的研究及治疗提供有力的工具。

