3DPCANet在阿尔茨海默症功能磁共振成像图像分类中的应用
贾洪飞,刘 茜,王 瑜,肖洪兵,邢素霞
(北京工商大学人工智能学院,北京 100048)
0 引言
阿尔茨海默症(Alzheimer’s Disease,AD)是一种最常见的脑部神经疾病,严重危害病人的生活和身体健康。截止到2019 年,国内AD 患者人数超过1 000 万,是目前全球患有AD 人数最多的国家[1]。AD 最先攻击处理学习和记忆的海马区[2],在病情初期,症状只是健忘、糊涂。随着病情的加重,病人的视觉空间下降,对待事物无法辨别也无法独自处理,记忆力严重下降,给患者和社会造成沉重负担,因此AD的早期诊断和及时治疗意义重大。近几年,随着计算机和神经影像技术的飞速发展,利用计算机与医学影像辅助医生进行前期AD 诊断与分析已成为主流趋势,目前的技术难点主要包括:医学影像中有效分类特征的提取,以及鲁棒性好、结构简单的分类模型的设计与构建。
功能磁共振成像(functional Magnetic Resonance Imaging,fMRI)[3-4]是一种无创的研究方法,通过测量大脑脑区中血氧水平依赖(Blood Oxygen Level Dependent,BOLD)信号,可以准确地知道被试者在某一时刻大脑氧活动量的大小,被广泛应用于AD 诊断研究中[5-8]。周文等[9]对fMRI 数据进行预处理和双样本T 检验,分析得到病灶区的位置,然后利用核主成分分析(Kernel Principal Component Analysis,KPCA)进行特征提取,结合Adaboost 算法对AD 进行分类。李长胜等[10]根据现有的自动解剖标记模板,把每个被试的大脑fMRI 图像分为116 个脑区,通过提取每个脑区的时间序列,构建全脑功能连接矩阵,然后使用KPCA 进行特征提取,最后用Adaboost 算法实现AD 分类。上述两种方法都使用KPCA 提取图像特征,虽然KPCA 能够提取图像的非线性特征,但无法提取图像的深层特征。本文对传统三维主成分分析网络(Three-Dimensional Principal Component Analysis Network,3DPCANet)进行了改进,在卷积层后添加最大池化层和激活函数层,增加网络深度,同时提取图像的深层特征和非线性特征,提高对AD 患者分类准确度。
卷积神经网络(Convolutional Neural Network,CNN)是一种包含卷积计算且具有深度结构的前馈神经网络,是深度学习算法之一,主要应用于图像特征的提取和分类。越来越多的研究人员将CNN 与医学影像相结合,辅助医生诊断疾病[11-14]。Jain 等[15]采用了一种基于迁移学习卷积神经网络的PFSECTL数学模型,在该模型中使用ImageNet 数据集预训练VGG-16,然后对AD、正常对照组(Normal Control,NC)和轻度认知障碍(Mild Cognitive Impairment,MCI)患者进行分类。Zhang 等[16]自定义了一种卷积神经网络,利用正电子发射型计算机断层显像(Positron Emission Computed Tomography,PET)和磁共振成像(Magnetic Resonance Imaging,MRI)双模态作为输入,得到的特征与简易精神状态量表(Mini-Mental State Examination,MMSE)和临床 痴呆量 表(Clinical Dementia Rating,CDR)获得的特征进行融合,将特征输入到CNN 中,实现对AD、NC 和MCI 分类。上述论文的研究内容,大多数都是对AD、NC 和MCI 进行分类,这种分类方式无法准确诊断出患者处在AD 的哪个发展阶段。因为在NC 与MCI 之间存在主观记忆衰退(Subjective Memory Decline,SMD)阶段,并且MCI 患者又分为早期轻度认知障碍(Early MCI,EMCI)和晚期轻度认知障碍(Late MCI,LMCI),由于相邻发展阶段的AD 患者大脑结构变化小,很难提取有效的分类特征,因此分类困难,而本文提出的模型可以对AD 患者进行更加细致的分类,能够更好地辅助医疗人员对患者疾病进行诊断。PCANet 是一种简单的CNN,由Chan 等[17]提出,该模型以传统的主成分分析(Principal Component Analysis,PCA)为基础,用非监督式特征提取的方法学习样本数据的深层次特征。李书通等[18]使用3DPCANet 完成MRI 图像特征提取,并通过提取的特征信息结合支持向量机(Support Vector Machines,SVM)分类器,实现对MRI 图像的自动分类诊断。3DPCANet 虽然能够提取图像的深度特征,但存在特征冗余现象,影响图像分类。针对这一问题,本文对传统3DPCANet 进行了改进:在每层卷积层后增加最大池化层,减少冗余特征;增加激活函数层,即线性整流函数(Rectified Linear Unit,ReLU),使模型能够学习非线性特征,并且总体加深模型深度,使其能够提取图像更深层次的特征。
虽然CNN 结合医学影像在AD 辅助诊断中表现了优异的性能,但CNN 大多数只能处理二维图像,对高维数据涉及较少,尤其是对于四维fMRI 数据。因此,本文将四维fMRI 数据预处理成三维数据,改进传统3DPCANet 模型,引入最大池化层和非线性激活函数,提取fMRI 数据特征,并利用SVM进行分类,实验结果验证了所提方法的有效性。
1 数据预处理
fMRI 数据是四维数据,目前,针对高维数据进行特征提取的CNN 较少,大多数适用于二维或三维图像。Ju 等[19]对fMRI 数据进行空间标准化、滤波,计算大脑(90 脑区)功能连接矩阵,将四维fMRI 数据转换为二维数据。Peraza 等[20]在研究路易体和阿尔茨海默病的区域功能同步性这一课题中,将fMRI 数据进行旋转、标准化和局部一致性(Regional Homogeneity,ReHo)[21]变换,将四维fMRI 数据转换为三维数据。本文将fMRI 数据转换为低频波动幅度(Amplitude of Low-Frequency Fluctuation,ALFF)[22]图像,然后进行后续操作。
1.1 数据信息统计分析与预处理
本文实验中使用的fMRI 数据来自阿尔茨海默氏症神经成像组 织(Alzheimer’s Disease Neuroimaging Initiative,ADNI)。实验数据共有202 名被试者的fMRI 图像数据,其中包含AD 患者34 例,EMCI 患者57 例,LMCI 患者35 例,NC 对照组50 名,SMD 患者26 例。实验数据中每个被试者的基本信息如表1 所示。
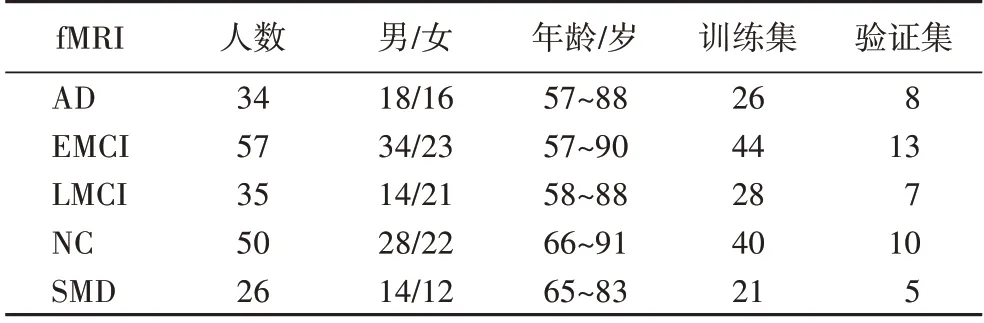
表1 被试者信息统计分析Tab.1 Statistical analysis of subject information
fMRI 数据预处理使用基于Matlab 的DPABI(Data Processing&Analysis for Brain Imaging)[23]软件包实现。fMRI图像处理流程如下:剔除前10 个时间点,时间层校正,头动校正,空间标准化,去线性飘移等处理。fMRI 预处理后样本数据如图1 所示。

图1 fMRI预处理后的样本图像Fig.1 Sample images after fMRI preprocessing
1.2 ALFF图像转换
本文将fMRI 数据转换成ALFF 图像,该图像是三维图像,方便使用CNN 进行特征提取。ALFF 图像值是计算低频段(0.01 Hz~0.08 Hz)下BOLD 信号功率谱的均方根,利用低频信号能量来表示大脑中不同脑区神经元的活动强弱,其中:频率在0.010 Hz~0.027 Hz 时,可以反映大脑皮层神经元的活动;频率在0.027 Hz~0.073 Hz 时,可以反映基底神经节的活动。这些区域都会受到AD 影响,所以本文选择ALFF进行图像转换。
ALFF 计算过程如下所示:
1)将每个体素去除线性漂移后的时间序列先经过0.01 Hz~0.08 Hz 带通滤波器;
2)将滤波结果进行快速傅里叶变化后得到功率谱;
3)将功率谱开方;
4)计算0.01 Hz~0.08 Hz 内的功率谱开方后的平均值,即为ALFF。
将ALFF 除以全脑所有体素的平均ALFF,可以得到均值低频波动振幅(mean ALFF,mALFF)。如果AD 患者大脑脑区结构发生改变,则认为各脑区中的神经元活动强弱与正常对照组相比也会发生改变。对预处理后的fMRI 数据进一步计算mALFF 值后的数据图像如图2 所示。

图2 mALFF样本图像Fig.2 mALFF sample images
2 实验方法
2.1 改进3DPCANet
图3 为本文方法全局流程图,PCANet 是利用PCA 学习通道卷积核,二进制哈希和分块直方图用于索引和池化的深度学习网络。李书通等[18]将PCANet 模型三维化,辅助诊断AD,本文对3DPCANet 进行改进,在模型卷积层后,引入最大池化层和激活函数层改进网络。假设有N幅大小为L×H×W的神经影像输入,改进的3DPCANet 卷积神经网络结构如图4 所示。
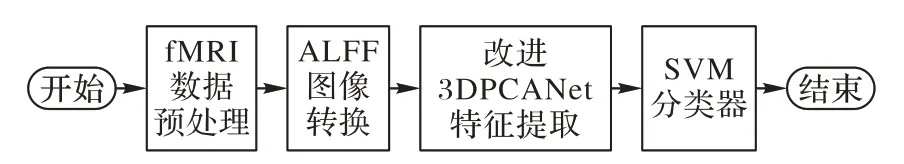
图3 本文方法全局流程Fig.3 Overall flowchart of the proposed method

图4 改进3DPCANet卷积神经网络结构Fig.4 Structure of improved 3DPCANet convolutional neural network
算法具体步骤如下。
1)第一步。
利用所有N幅原始训练图像和PCA 方法生成T1个滤波器,然后利用滤波器与原始训练图像分别进行卷积,则原始训练图像中的每一幅图像生成T1幅图像,即共生成N×T1幅图像。
模型输入大小为L×H×W的N幅mALFF 图像,在第j幅图像上的每个像素周围都截取k1×k2×k3大小的体素块,每幅图像截取体素块总数为B1,将取出来的体素块重新进行排序,变成一列,并进行标准化处理,使其均值为0,标准差为1,得 到其 中表 示第j幅训练图像中的第i块的列向量。按顺序将取出的块列向量排列成新的矩阵,如式(1)所示:

对所有N幅原始图像进行上述处理,处理好的N幅图像按顺序排列成新的矩阵X,得到如下矩阵。
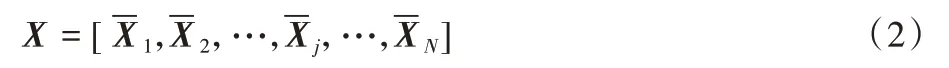
对得到的矩阵X,利用PCA 方法进行降维处理,PCA 在一组标准正交滤波器中最小化重构误差为:

其中:符号“*”表示卷积,利用滤波器对所有N幅原始图像进行卷积,生成T1×N幅图像。
然后再对式(5)生成的图像进行最大池化层和非线性激活函数ReLU 处理,使用式(6)表示:

其中:符号“×”表示最大池化操作,P1表示第一步最大池化层,表示进行最大池化层和激活函数处理后的图像,对所有N幅图像进行式(6)操作。
2)第二步。
与第一步处理方法相似,N幅原始图像经过第一步生成T1×N幅图像,以其中第l幅图像的每个体素为中心,取k4×k5×k6大小的图像块,每幅图像截取体素块总数为B2,将取出来的体素块重新进行排序,变成一列,并进行标准化处理,使其均值为 0,标准差为 1,得到,其中表示原始图像中第j幅图像与第l个滤波器新生成的第l幅图像中的第b块的列向量。
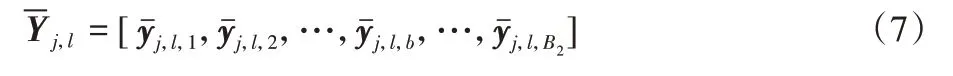
将所有N×T1幅图像进行上述处理,处理好的N×T1幅图像按顺序排列成新的矩阵Y,得到如下矩阵:

对所得矩阵Y,进行PCA 降维处理,该等式的解为YYT的特征向量。PCA 滤波器的表达式为:
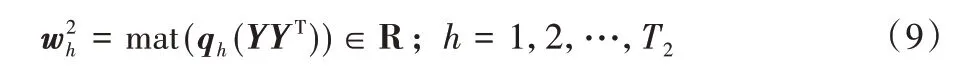
其中:qh(YYT)表示YYT的第h个特征向量为第二步生成的第h个滤波器。
将所得到的PCA 滤波器,第一步中式(7)生成的图像进行卷积,如式(10)表示:

其中:符号“*”表示卷积,利用第一步生成的N×T1中的每一幅图像,通过式(10)生成T2幅图像。
再对卷积后图像进行最大池化层和激活函数ReLU 处理,如式(11)所示:

其中:符号“×”表示最大池化操作,P2表示第二步中最大池化层,为最大池化层处理生成的图像,并利用式(11)对所有N×T1×T2幅图像进行最大池化层和激活函数操作。
3)第三步。
第一步生成的N×T1图像,对其中每一幅图像经过第二步生成的T2幅图像进行二进制哈希,如式(12)所示,合并成一幅图像,每幅图像中每个像素都是整数值,范围在[0,-1],即共生成N×T1幅图像。

其中:H(·)的功能是将图像中大于0 的元素变成1,小于等于0 的元素变成0。将T2幅图像中相同位置处的每一个二进制数值组成二进制编码向量,并将二进制位向量转变为十进制数值。这样将T2幅图像转换为十进制的一幅整数值图像。
对哈希处理后的所有N×T1幅图像进行取块处理,每幅图像截取体素块总数为B3,每个块像素大小为k7×k8×k9,并统计每个块的直方图,并将同一幅图像中取出块的直方图进行串联,式(13)表示原始N幅图像中的第j幅图像产生的第l幅图像,经过取块、直方图统计和串联处理后的一维特征向量fj,l。

Bhist(Oj,l)是 对Oj,l进行取 块、直方图 统计和 串联的 功能,将所有原始N幅图像中的第j幅图像产生的T1幅图像中的每一幅图像通过式(13)处理,并进行串联,得到一维特征向量Fj,如式(14)所示:

利用式(13)和式(14)对N幅原始图像中的每一幅图像对应产生的T1幅图像分别进行取块、直方图统计和串联操作,N幅原始图像中的每一幅图像均可得到一个一维的特征向量,用所得到的特征向量代表该原始图像,即最后生成N个特征向量,使用SVM 分类器进行分类。
2.2 评价指标
实验中对数据集进行二分类,分为正类(positive)和负类(negative),实验中使用的分类评价指标有准确率(ACCuracy,ACC)、敏感度(SENsitivity,SEN)和特异 性(SPEcificity,SPE),计算式如式(15):

其中:TP表示真正类被试者数量,TN表示真负类被试者数量,FP表示假正类被试者数量,FN假负类被试者数量,实验中正类标签为1,负类标签为0。为了对所提模型进行综合评估,还使用了F1 值和受试者工作特征(Receiver Operating Characteristic,ROC)曲线下与坐标轴围成的面积(Area Under Curve,AUC)作为评测指标,其中F1 值是由精确度(Precision)和敏感度计算得到,如式(16)所示:
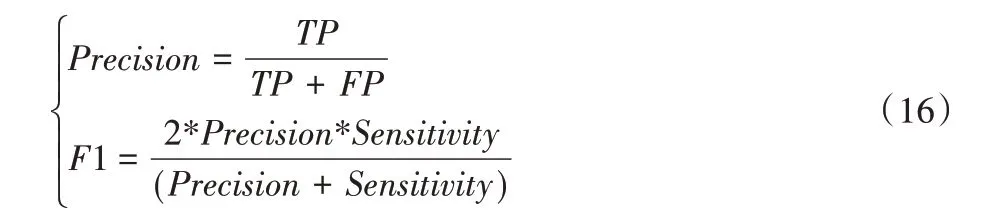
2.3 实验设计
为了探讨ALFF 图像对AD 分类有效性以及本文改进3DPCANet 方法的鲁棒性,本文设计了一系列实验,并且使用5 折交叉验证,减少实验结果的偶然性。为了验证ALFF 图像转换的有效性,将本文方法与文献[18]方法进行对比;为了验证改进PCANet 的有效性,将本文方法与文献[24]方法进行了对比,实验结果如表2 所示。此外,本文对不同阶段的AD 患者也进行了分类实验,实验结果如表3 所示。
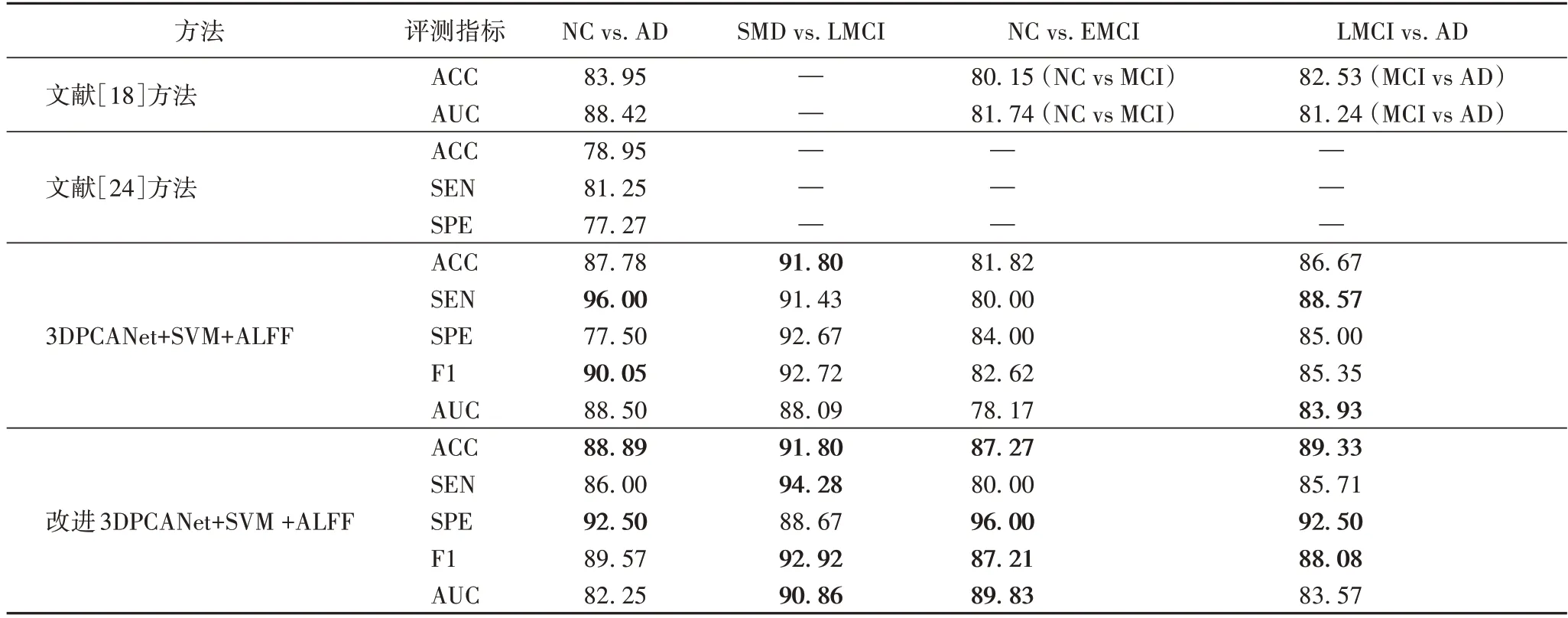
表2 不同方法实验结果对比 单位:%Tab.2 Comparison of experimental results of different methods unit:%
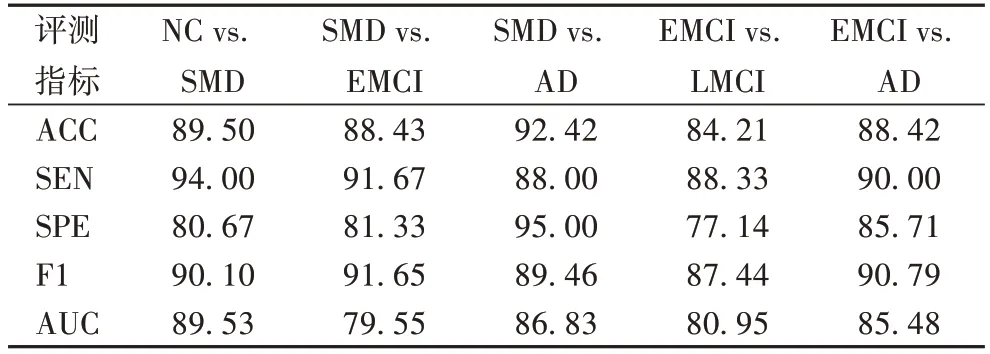
表3 AD不同阶段患者分类 单位:%Tab.3 Classification of patients with different stages of AD unit:%
3 实验结果分析
从表2 的实验结果可以得出如下结论:
第一,本文所提的3DPCANet+SVM+ALFF 方法与文献[18]方法相比,NC vs.AD 准确率提高了3.83 个百分点。此外,MCI vs.NC、MCI vs.AD 的准确率和AUC 面积均有所提升,主要是因为ALFF 图像能够有效反映被试者各个脑区神经元活动强弱,是一种很好的特征表达方法。与文献[18]方法相比,本文使用较少的数据集,取得了更好的分类结果,可以证明ALFF 在AD 分类中的积极作用。
第二,对3DPCANet 模型进行改进后,AD 的分类性能显著提高,例如NC vs.EMCI,LMCI vs.AD 分类,准确率、F1 值、特异性等评测指标均有所提升,其中前者特异性提升12 个百分点,AUC 提升11.66 个百分点。
第三,文献[24]仅对AD 与NC 患者进行了分类,而本文对AD 其他阶段包括SMD、EMCI 和LMCI 也进行了分类,能够辅助医疗人员更加准确地诊断患者所处AD 的不同发展阶段,更具有实际意义。
第四,SMD 与LMCI,LMCI 与AD 的分类性能也有所改善,证明了本文算法对病变差异微弱的SMD 和MCI 患者分类也具有有效性,主要原因在于,由于在卷积层后加入最大池化层,可以有效减少特征图中冗余信息,防止过拟合,增加激活函数,使模型能够提取出非线性特征,以便易于区分不同发展阶段患者的病变差异,从而具有更好的分类性能。
由表3 中的数据可以看出,因为SMD 是AD 疾病的初始阶段,与AD 患者脑部结构具有很大差异,因此SMD 与AD,以及EMCI 与AD 的分类效果更好,准确率分别为92.42%和88.42%。NC vs.SMD、SMD vs.EMCI 都是相邻AD 发展阶段之间的分类,之间大脑结构差异小,不易区别,实验结果准确率分别 为89.50% 和88.43%,F1 值分别 为90.10% 和91.65%。EMCI 和LMCI 同属于MCI 阶段,医疗人员很难区分这一阶段患者,本文在EMCI 与LMCI 分类实验中也取得了良好的分类结果,F1 值为87.44%,AUC 为80.95%,准确率为84.21%。实验结果证明,改进后的3DPCANet 模型更适用于AD 分类。
4 结语
本文提出了一种基于深度学习的阿尔茨海默症辅助诊断方法,使用预处理的fMRI 数据,利用mALFF 获得平均低频波动幅度图像,作为深度学习网络的输入。此外,对传统3DPCANet卷积层后增加最大池化层和激活函数层进行改进,使特征图中的冗余信息减少,防止过拟合,增加网络深度,最后使用线性SVM 分类器进行分类。在不同阶段AD vs.NC 对照组数据集中的实验结果显示,与传统的3DPCANet 模型相比,分类结果均有所提升,其中SMD vs.LMCI 准确率最高,达到91.80%,LMCI vs.AD 分类结果达到89.33%。可见,本文提出的方法能够有效分类阿尔茨海默症不同阶段患者,为阿尔茨海默症的辅助诊断与治疗提供理论依据和指导性建议。3DPCANet 模型特征提取任务与分类任务独立,无法联合优化,在未来的工作中,会对3DPCANet 模型进一步探索,将特征任务和分类任务融合在同一个模型中。

