低磷胁迫下3种不同种源葛藤的生长生理响应
张淑炜, 赵丽丽, 陈超, 谭景晨, 张莉, 席溢
(贵州大学动物科学学院,贵阳 550025)
磷是植物生长发育必需的营养元素,以多种方式参与植物体内各种生理生化过程,是影响植物生长和高产的主要因素之一[1-2]。土壤普遍缺磷已成为制约我国农业发展的重要限制因素。施用磷肥作为增加植物产量的常用措施,虽能缓解土壤有效磷缺失,但极易与土壤中铁、铝、钙、镁离子等形成不溶性化合物,难以被植物吸收利用。此外,磷酸盐矿物资源属于不可再生资源。据估计,磷矿资源储量将在百年内耗尽[3]。磷肥过量使用不仅会造成磷源匮乏、成本增加,还易导致水体富营养化、缺氧等环境污染问题[4]。不同类型植物对低磷胁迫的调节能力不同。核桃[5]、辣椒[6]、柑橘[7]幼苗在低磷胁迫下,侧根、须根、根长和根冠比增加,主根变粗、伸长减缓,根系与土壤的接触面积扩大,以提高植物对磷的吸收利用率。马尾松在低磷胁迫下表现出叶绿素和可溶性蛋白含量以及根系活力降低,丙二醛、可溶性糖和和游离脯氨酸含量增加,植物保护酶活性提高,以此相互转化维持植物体内物质代谢,保护酶系统大量清除自由基形成动态平衡的生理应答机制[8]。而黄花、苜蓿在低磷胁迫下,生物量、株高、根表面积、总根长、根体积等表观形态指标显著降低[9]。因此,研究植物在低磷胁迫下的应激反应对农业和畜牧业的可持续发展具有重要意义。
葛藤(Pueraria lobate)为豆科(Leguminosae)葛属(Pueraria)多年生缠绕型藤本植物,适应性强、耐寒、抗旱、耐瘠薄等。葛藤根系发达,扎根深,能改良土壤结构,有效防止径流和侵蚀、保水保土、防风固沙,是喀斯特石漠化地区生态恢复的先锋植物[10]。目前,对葛藤的研究主要集中在饲用[11]、药用[12]、生态价值[13]等方面,而关于葛藤对低磷胁迫的响应和生理适应机制少见报道。本研究以3个不同来源葛藤材料为研究对象,通过水培法探究葛藤幼苗期在低磷水平下的生理生化变化,以期助推葛藤种质资源的利用和耐低磷品种选育,为进一步指导葛藤生产实践提供理论依据。
1 材料与方法
1.1 试验材料
以来源于澳大利亚(Austrilia,A)和我国江苏(Jiangsu,J)和湖南(Hunan,H)3个种源的葛藤种子为试验材料。其中,澳大利亚葛藤种子由江苏冈仁波齐种业有限公司提供,江苏葛藤种子由江苏种业科技有限公司提供,湖南葛藤种子购自湖南种子市场。
1.2 试验方法
选取大小均匀、饱满的葛藤种子用质量分数3%NaClO浸泡20 min,灭菌蒸馏水冲洗种子3~4次直至冲洗干净,再浸泡种子6 h后均匀地撒在铺有两层滤纸的培养皿中,放在光照14 h/黑暗10 h、温度25℃/22℃的光照培养箱中催芽,每天浇1次蒸馏水使滤纸保持湿润。培养约7 d,当长出2叶1心时,挑选大小一致的幼苗移入长49.5 cm、宽20 cm、高15 cm的塑料盆中进行水培。移苗时使用1/2营养液(表1),5 d后换为全营养液,全营养液培育14 d后进行低磷处理。
葛藤幼苗通过恒温培养进行胁迫,设置常磷0.5 mmol·L−1KH2PO4(P0.5)、低 磷 0.05 mmol·L−1KH2PO4(P0.05)和 极 低 磷 0.005 mmol·L−1KH2PO4(P0.005)3个处理水平,以3个种源葛藤为试验材料共计9种处理,即P0.5A(常磷+澳大利亚葛藤)、P0.05A(低磷+澳大利亚葛藤)、P0.005A(极低磷+澳大利亚葛藤)、P0.5H(常磷+湖南葛藤)、P0.05H(低磷+湖南葛藤)、P0.005H(极低磷+湖南葛藤)、P0.5J(常磷+江苏葛藤)、P0.05J(低磷+江苏葛藤)、P0.005J(极低磷+江苏葛藤)。每个处理设3次重复,每盆30株为1次重复,共27盆。葛藤幼苗以打孔海绵条固定,每3 d更换营养液,每次1 L。更换营养液时随机挪动每盆葛藤位置,以降低光照等因素的影响。同时在低磷营养液中分别加相应的氯化钾以补足缺失的钾元素,其余营养液成分均相同(表1),最后用HCl或NaOH调节营养液pH至6.0~6.2。

表1 营养液成分及浓度Table1 Concentration of nutrient solution components
1.3 指标测定与方法
胁迫处理20 d后,测量葛藤的农艺性状和生理指标。
1.3.1 农艺性状的测定 采用直尺和游标卡尺测量株高和茎粗,设3次重复,每个重复测量10株;使用叶片扫描仪测定叶面积、叶周长等叶片指标;根系扫描仪测定根长、根表面积、根直径等根系指标;将葛藤幼苗分为地上部和地下部,称其鲜重,之后105℃杀青30 min,75℃烘干至恒重称其干重;根、叶表型指标均设3次重复,每个重复4株。根据公式(1)计算根冠比。

1.3.2 生理指标的测定 丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸法测定,可溶性糖(soluble sugar,SS)含量采用蒽酮比色法测定,可溶性蛋白(soluble protein,SP)含量采用考马斯亮蓝G-250法测定[14];过氧化氢酶(catalase,CAT)活性采用紫外吸收法测定,过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定,超氧化物歧化酶(superoxide dismutase,SOD)活性采用NBT光还原法测定,脯氨酸(proline,Pro)含量采用酸性茚三酮法测定[15]。
采用耐低磷系数综合评价低磷处理对3个种源葛藤生长特性的影响。正相关指标的耐低磷系数根据公式(2)计算[16];负相关指标的耐低磷系数根据公式(3)计算。

1.4 数据处理
采用Microsoft Excel 2013进行数据整理,应用SPSS 22.0软件进行数据分析,Sigmaplot 14.0绘图。
2 结果与分析
2.1 低磷胁迫对葛藤幼苗生长特性的影响
2.1.1 低磷胁迫对生物量的影响 低磷胁迫下,不同地区葛藤的各项指标变化明显不同(表2)。与常磷条件相比,澳大利亚和江苏葛藤在0.005 mmol·L−1磷条件下的株高、茎粗、地上部鲜重、地下部鲜重、地上部干重、地下部干重均呈下降趋势,降幅分别为 14.61%、3.22%、3.62%、8.44%、12.98%、6.00%、5.04%、10.15%、29.80%、38.34%、34.83%、37.33%;其中,江苏葛藤地上部和地下部鲜重以及地上部干重在不同处理间差异显著。极低磷条件下,澳大利亚和江苏葛藤幼苗根冠比较常磷呈上升趋势,增幅分别为9.90%、3.19%,说明0.005 mmol·L−1磷条件有利于澳大利亚和江苏葛藤幼苗根冠比的增加;而在0.005 mmol·L−1磷条件下,湖南葛藤的株高、地上部鲜重和地上部干重均呈上升趋势,增幅分别为31.76%、30.37%、6.35%,茎粗、地下部鲜重、地下部干重和根冠比呈下降趋势,降幅分别为1.65%、28.93%、27.50%、38.86%(表2)。由此表明,湖南葛藤在0.005 mmol·L−1磷胁迫下可能是通过降低地下生物量和增加地上生物量的方式适应环境。在0.05 mmol·L−1磷条件下,3个种源葛藤的地上生物量和地下部鲜重均有上升趋势,三者的地上部鲜重差异显著(P<0.05),湖南和江苏葛藤的地上部干重差异显著(P<0.05)。

表2 低磷胁迫下葛藤幼苗的生物量Table 2 Biomass of Pueraria lobata seedlings under different low phosphorus stresses
2.1.2 根系形态 低磷胁迫下,不同地区葛藤之间根系形态指标变化趋势基本一致(表3)。与常磷相比,0.05 mmol·L−1磷条件下3个种源葛藤根系的总根长、根表面积、根直径、根体积、根尖数、根毛数均呈上升趋势;其中,澳大利亚葛藤的总根长、根直径、根尖数于常磷处理差异显著(P<0.05),总根长、根尖数增幅分别为77.01%、49.43%。0.005 mmol·L−1磷条件下,3个种源葛藤总根长、根表面积、根直径、根体积、根尖数、根毛数较常磷处理均小幅下降;澳大利亚葛藤的根尖数、根毛数和湖南葛藤的总根长、根尖数以及江苏葛藤的根体积、根尖数与常磷处理差异显著(P<0.05)。

表3 低磷胁迫下葛藤幼苗的根系形态Table 3 Root morphological of Pueraria lobata seedlings under different low phosphorus stresses
2.1.3 叶片形态 低磷胁迫下,3个种源葛藤的叶片形态指标都随磷浓度降低而呈现先增大后减小的趋势。与常磷相比,湖南葛藤在0.05和0.005 mmol·L−1磷条件下都有良好的促进作用。湖南葛藤在0.05 mmol·L−1磷条件下增幅最大,其叶面积、叶周长、叶长和叶宽较常磷处理分别提高了46.57%、24.53%、20.65%、21.32%。在极低磷条件下,各指标虽在低磷的基础上呈减小趋势,但较常磷各指标仍分别增加了21.19%、11.84%、8.36%、32.03%,说明低磷环境对湖南葛藤叶片形态指标有促进作用。与常磷相比,江苏葛藤和澳大利亚葛藤在0.05 mmol·L−1磷条件下的叶面积、叶周长、叶长、叶宽明显增加;澳大利亚葛藤叶片各指标较常磷差异显著(P<0.05),而江苏葛藤各叶片指标差异不显著;在0.005 mmol·L−1磷条件下,江苏葛藤和澳大利亚葛藤变化趋势一致,均较常磷处理有所降低,但差异不显著,说明极低磷环境对江苏葛藤和澳大利亚葛藤叶片发育有抑制作用。
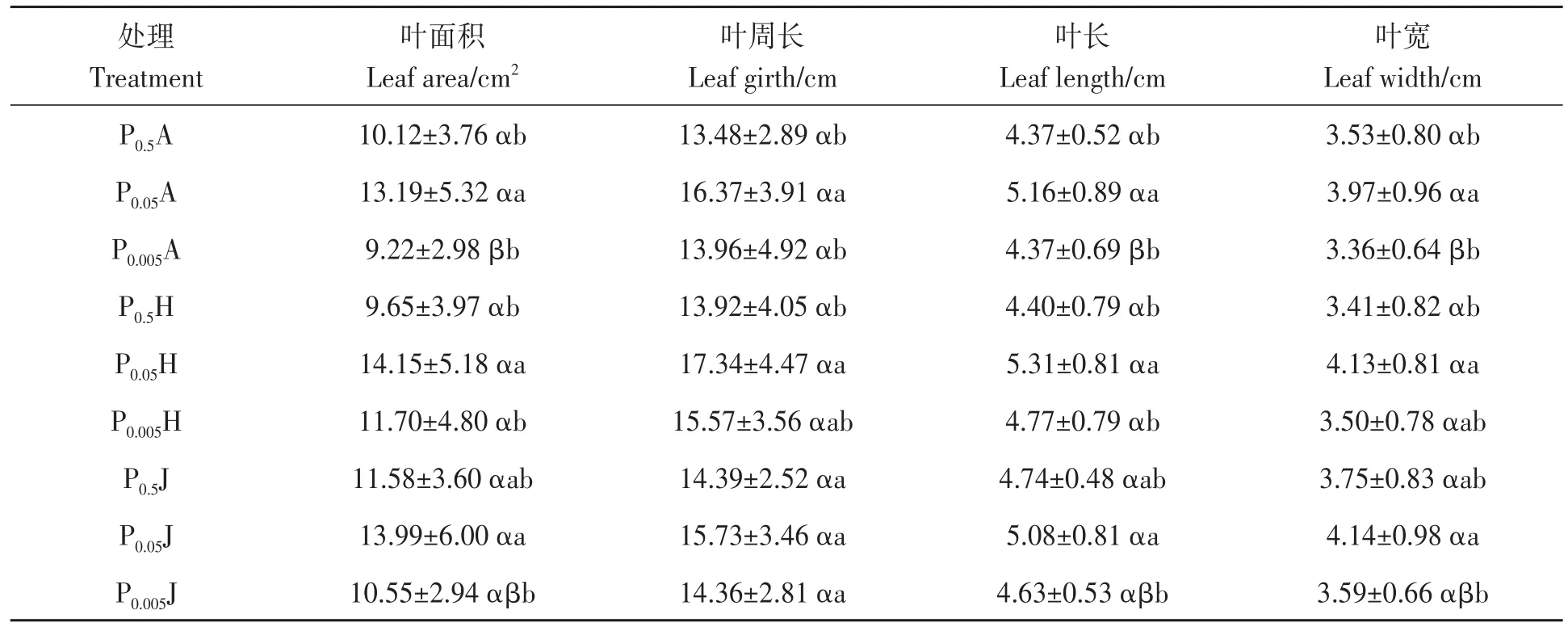
表4 低磷胁迫下葛藤幼苗的叶片形态指标Table 4 Leaf morphological indexes of Pueraria lobata seedlings under different low phosphorus stresses
2.2 低磷胁迫对葛藤幼苗渗透调节物质的影响
3个种源葛藤根、叶中脯氨酸含量随磷水平降低呈逐渐增加趋势,在极低磷处理时3个种源葛藤脯氨酸含量达到最大(图1)。与常磷处理相比,澳大利亚、湖南、江苏葛藤根部和叶片脯氨酸含量在 0.005 mmol·L−1磷处理下分别显著增加145.42%、84.79%、36.70% 和 49.41%、64.66%、92.89%(P<0.05)。3个种源葛藤根、叶可溶性糖含量变化表现一致,均随磷水平降低呈逐渐增加趋势,在0.005 mmol·L−1磷处理达最大。与常磷相比,澳大利亚、湖南、江苏葛藤在 0.05 mmol·L−1磷条件下根部和叶片中可溶性糖含量分别显著增加67.85%、38.95%、14.01% 和 46.66%、55.46%、54.72%(P<0.05)。3个种源葛藤在低磷胁迫下根和叶中可溶性蛋白含量变化趋势一致,均为常磷处理>0.05 mmol·L−1磷处理>0.005 mmol·L−1磷处理(图1)。澳大利亚和湖南葛藤均在常磷处理时根、叶中可溶性蛋白含量最大,显著高于其余处理(P<0.05)。与常磷相比,澳大利亚和湖南葛藤在0.005 mmol·L−1磷处理下根和叶片的可溶性蛋白分别显著降低37.34%、61.58%和32.33%、46.40%。江苏葛藤可溶性蛋白含量随磷水平降低也呈逐渐降低趋势,但根部可溶性蛋白含量在各处理间差异不显著(P>0.05);与常磷相比,江苏葛藤在0.005 mmol·L−1磷条件下叶片中可溶性蛋白含量显著降低26.94%(P<0.05)。

图1 不同处理下葛藤幼苗的渗透调节物质含量Fig.1 Contents of osmotic adjustment substances of Pueraria lobata seedlings under different treatments
2.3 低磷胁迫对葛藤幼苗抗氧化酶系统的影响
2.3.1 低磷胁迫对葛藤丙二醛含量的影响 3个种源葛藤根、叶中丙二醛含量随磷水平降低先降低后增加(图2)。与常磷处理相比,澳大利亚、湖南、江苏葛藤在0.005 mmol·L−1磷处理下根部丙二醛含量分别显著增加24.37%、33.23%、45.61%(P<0.05),而叶片中丙二醛含量分别显著增加36.38%、58.03%、55.95%(P<0.05)。

图2 不同处理下葛藤幼苗的丙二醛含量Fig.2 Contents of MDA of Pueraria lobata seedlings under different treatments
2.3.2 低磷胁迫对葛藤抗氧化酶活性含量的影响 图3表明,3个种源葛藤抗氧化酶活性随磷水平降低均呈逐渐增加趋势。与常磷相比,澳大利亚、湖南和江苏葛藤在0.005 mmol·L−1磷条件下根系SOD活性分别显著增加47.54%、50.60%、21.76%(P<0.05),叶片中SOD活性分别显著增加52.57%、32.54%、97.79%;澳大利亚、湖南和江苏葛藤在 0.005 mmol·L−1磷条件下根系和叶片中POD活性分别显著增加129.29%、39.12%、33.14%和53.61%、38.62%、70.56%;澳大利亚、湖南和江苏葛藤在0.005 mmol·L−1磷条件下根系和叶片中CAT活性分别显著增加118.43%、78.46%、22.01%和131.76%、92.00%、20.13%。
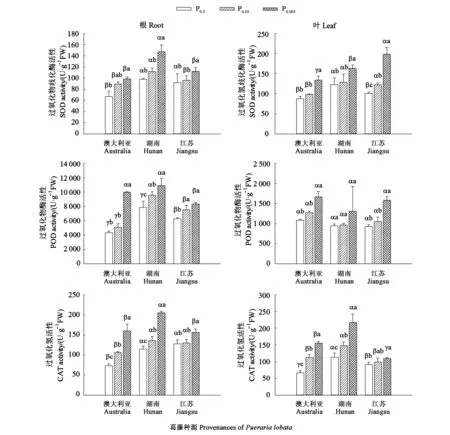
图3 低磷胁迫下葛藤幼苗的抗氧化酶活性Fig.3 Activities of antioxidant enzyme in Pueraria lobata seedlings under different low phosphorus stresses
2.4 综合分析
根据耐低磷系数公式计算求各指标的耐低磷系数。若耐低磷系数>1,说明葛藤在该指标上耐低磷性好;若耐低磷系数<1,说明葛藤在该指标上不具有耐低磷性或者耐低磷性较差。由表5可知,在低磷和极低磷条件下,3个种源葛藤24个指标的耐低磷系数均发生了变化。

表5 不同地区葛藤各单项指标的耐低磷系数Table 5 Low phosphorus tolerance coefficient of every single index of Pueraria lobate
与常磷相比,3 个种源葛藤在 0.05 mmol·L−1磷处理下的根冠比及SP、MDA含量降低;地上部鲜重、地下部鲜重、地上部干重、总根长、根表面积、根直径、根体积、根尖数、根毛数、叶面积、叶周长、叶长、叶宽和SS、Pro含量及SOD、POD、CAT活性增加;澳大利亚和江苏葛藤株高降低、茎粗增加,湖南葛藤株高增加、茎粗降低。由此表明,3个种源葛藤均具有较强的耐低磷性,0.05 mmol·L−1磷条件下葛藤在形态上表现为:矮小粗壮、叶面积增大、根系变长、根系机能活性减弱。
与常磷相比,3个种源葛藤在0.005 mmol·L−1磷处理下的茎粗、地下部鲜重、地下部干重、总根长、根表面积、根直径、根体积、根尖数、根毛数和SP含量降低;SS、Pro含量及SOD、POD和CAT活性增加;澳大利亚和江苏葛藤株高、地上部鲜重、地上部干重、叶面积和叶宽降低,根冠比增加,湖南葛藤反之;澳大利亚和湖南葛藤叶周长和叶长增加,江苏葛藤反之。3个种源葛藤在0.005 mmol·L−1磷处理下根系变短、根毛和根尖数减少、根冠比增加,澳大利亚和江苏葛藤植株矮粗,湖南葛藤植株细长,生物量及其分配特征变化均表现为地上部生物量增加、地下部生物量降低。不同种源葛藤对环境胁迫的响应表现出差异性。综合所有指标的耐低磷系数得出,3个种源葛藤的耐低磷性表现为:澳大利亚葛藤>湖南葛藤>江苏葛藤,即澳大利亚葛藤耐低磷性较强,江苏葛藤为低磷敏感型。
3 讨论
3.1 葛藤幼苗生长特性对低磷胁迫的响应
植物在缺磷环境下会出现不同表型以适应环境变化,反映了植物体内不同的生物学适应机制。根系是植物从环境中摄取养分的重要器官,在养分缺乏时根系的变化起着十分重要的作用[17]。研究表明,玉米、水稻、大豆等植物在低磷胁迫下不仅会改变根系形态,还会使同化物向根部的运输量增加,导致根冠比增加,以此促进根系对磷素的吸收,提升利用效率[18-21]。除根系外,植物的株高、叶面积、叶周长等形态指标也能直观反映植物在逆境中的受伤害程度。本研究结果表明,随着磷浓度的降低,澳大利亚葛藤的株高、根冠比和根直径呈先下降后上升趋势,地上部干重、总根长、总根表面积、总根尖数、根毛数、叶面积、叶周长、叶长、叶宽呈先上升后下降趋势,地下部干重和总根体积呈下降趋势;湖南葛藤的根冠比和根直径呈先下降后上升的趋势,地上下部干重、总根长、总根表面积、根体积、根毛数、叶面积、叶长、叶宽和叶周长呈先上升后下降的趋势,根尖数呈下降趋势,株高呈上升趋势;江苏葛藤的地上部干重、根直径、根尖数、叶长、叶宽、叶面积和叶周长呈先上升后下降趋势,根冠比和株高呈先下降后上升趋势,地下部干重、总根长、根表面积、总根体积和根毛数呈下降趋势。3个不同种源的葛藤种质在低磷条件下的生长特性表现出明显差异。一般来说,植物对磷的吸收主要依靠于根系长度和表面积,并通过侧根探索更大的磷接触面积[22]。磷在植物光合作用中作为底物参与调节叶绿素合成,低磷条件下,叶绿素的合成受阻,叶片扩展速率降低,植物光合碳同化能力降低,导致植株生长矮小,地上生物量降低,同时地上部光合产物优先分配到根系,使根系生长加快,增加根系生物量[23]。在 0.05 mmol·L−1磷水平下,澳大利亚葛藤表现出了较江苏和湖南葛藤更长的根长、更大的根表面积及更多的根尖数和根毛数,这与Wang等[24]对马铃薯的研究结果一致,说明澳大利亚葛藤在低磷胁迫下具有较强的自我调节能力,把地上部光合产物更多地转移到根系,使其耐低磷能力更强。湖南葛藤在低磷胁迫下表现为植株细长,根冠比减小,地上部受影响较小,地上生物量仍较大,这说明湖南葛藤在低磷胁迫下可能并非仅通过增加根系指标来适应环境,这与王岚[25]的研究结果一致,可能是地上部光合产物向根部转移的量变化较小,与根部激素调控相关。江苏葛藤在低磷胁迫下生物量降低,根系仅靠根尖获取磷,这可能是其耐低磷能力相对较弱的原因。本研究采用水培法进行试验,并不能完全模拟植物根系在复杂土壤环境中的变化,故未来在指导生产实际前应通过大田试验或者从分子水平进一步验证。
3.2 葛藤幼苗渗透调节物质对低磷胁迫的响应
在逆境下,植物体内会发生一系列的生理生化反应,形成适应机制[26]。受到胁迫后,植物体内会通过累积大量的Pro和SP维持渗透平衡,以更好地适应逆境[27]。SS是植物碳水化合物代谢、暂时贮藏的方式之一,逆境下SS含量显著升高[28]。本研究结果表明,随着磷浓度的降低,3个不同种源葛藤根和叶片中SS、Pro含量均呈上升趋势,SP含量呈下降趋势,与龚丝雨等[29]对烟草和李俊等[30]对油茶的研究结果一致。
3.3 葛藤幼苗抗氧化酶系统对低磷胁迫的响应
逆境下植物体内会累积过多的活性氧自由基(reactive oxide species,ROS),破坏正常代谢中ROS产生与清除之间的平衡,最终使细胞膜系统受损。MDA是植物脂质过氧化反应的产物,其含量反映了植物受胁迫伤害的程度[31]。本研究表明,0.05 mmol·L−1磷水平下,3个不同种源葛藤根和叶片中MDA含量呈小幅度下降趋势,说明葛藤具有一定的耐低磷性,在该浓度磷胁迫下,植株受损害程度较轻;0.005 mmol·L−1磷水平下,3种葛藤体内MDA含量均大幅度上升,说明该浓度磷胁迫导致葛藤体内自由基累积,加剧了细胞膜脂过氧化作用。其中,江苏葛藤根和叶片中MDA含量显著高于湖南和澳大利亚葛藤,说明0.005 mmol·L−1磷水平下江苏葛藤的受损害程度更高。同时,植物在逆境胁迫下为了抵御自由基对自身造成的伤害会增强抗氧化防御系统[32],即SOD将O2−转化为O2和H2O2,而POD和CAT可清除、催化H2O2分解为无毒物质[33-34]。本研究表明,3个种源葛藤根和叶中SOD、POD、CAT活性在低磷胁迫下均呈现不同程度的上升,与乔光等[8]对马尾松和余小芬等[35]对水稻的研究结果一致,说明葛藤在低磷胁迫下通过自动调节提高保护酶活性,从而提高细胞防御能力,保障体内的正常生理代谢。
本研究通过分析3个种源葛藤种质进行低磷胁迫20 d后的形态变化和生理响应得出,葛藤在低磷条件下具有极强的适应性和较好的产量潜力。3个种质中,澳大利亚葛藤的耐低磷性较强,江苏葛藤属于低磷敏感型。

