miR-454-3p对鼻咽癌CNE-2细胞上皮-间质转化的调控机制
王林春 欧阳博慧 吴春龙 吴凯乐 谢晴晴 唐建
鼻咽癌是一种源于鼻咽上皮细胞的原发性恶性肿瘤,侵袭和转移是其主要生物学特性[1]。上皮-间质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞获得间充质表型和增强侵袭能力的关键步骤。微小核糖核酸(microRNA,miRNA)是包括鼻咽癌在内的多种肿瘤进展过程的关键因子[2],参与调控EMT过程。大量研究表明,miR-454-3p在多种恶性肿瘤中发挥抑癌作用,例如:miR-454-3p可通过靶向活化T细胞核因子c2(NFATc2)抑制神经胶质瘤细胞增殖并增加细胞凋亡[3],通过靶向钙结合蛋白1(CALB1)抑制非小细胞肺癌细胞增殖[4],通过靶向B细胞易位基因 1(BTG1)增强肾癌细胞对 X线的敏感性[5]等,表明miR-454-3p可通过调控靶基因参与多种恶性肿瘤的发展进程,但目前关于miR-454-3p在鼻咽癌中的调控机制尚不清楚。因此,本研究选取鼻咽癌细胞系CNE-2为研究对象,探究miR-454-3p调控CNE-2细胞EMT的机制,为鼻咽癌细胞侵袭和转移的机制研究提供更多的实验室依据,现报道如下。
1 对象和方法
1.1 对象 收集2017年1月至2018年12月于柳州市中医医院就诊的95例鼻咽癌患者,男71例,女24 例,年龄 27~70(46.12±9.53)岁,临床分期Ⅰ、Ⅱ期41例,Ⅲ、Ⅳ期54例。纳入标准:所有鼻咽癌患者均未接受放化疗治疗,无肝肾功能不全、神经疾病以及其他肿瘤等合并症,无家族病或特殊病史。排除标准:合并糖尿病、其他肿瘤或严重凝血功能障碍或心、肺功能不全者;患者病史资料不全,年龄>80岁,不积极配合本研究或中途退出者。收集30例本院同期健康体检者,男 21 例,女 9 例,年龄 29~63(45.77±8.94)岁。两组对象性别、年龄比较差异均无统计学意义(均P>0.05)。本研究经本院医学伦理委员会批准。
1.2 材料 鼻咽癌细胞系CNE-2购自中国科学院上海细胞库。DMEM培养基、FBS和Opti-MEM培养基购自美国Gibco公司;LipofectamineTM2000购自美国Invitrogen公司;逆转录酶盒试剂及SYBR Green定量PCR试剂盒购自北京TaKaRa公司;pmirGLO载体、E-盒结合锌指蛋白2(zinc finger E-box binding homeobox 2,ZEB2)野生型序列(WT)及ZEB2突变型序列(MUT)、miR-454-3p mimic和对照序列(Mimic-NC)、过表达 ZEB2质粒(ZEB2 plasmid)及对照载体(vector)由上海生工生物公司合成;Trizol试剂购自索莱宝公司产品;Transwell小室购自美国Corning公司;anti-E-cadherin antibody、anti-N-cadherin antibody、anti-ZEB2 antibody、β-actin购自英国Abcam公司;anti-Vimentin antibody、辣根过氧化物酶(HRP)标记羊抗鼠二抗、HRP标记羊抗兔二抗购自美国Santa Cruz公司。CO2细胞培养箱购自美国Binder公司;倒置荧光相差显微镜购自日本Olympus公司(型号:CKX53);实时荧光定量 PCR系统购自美国Agilen公司(型号:AriaMx);垂直电泳仪(PowerPac Basic)和蛋白转印模块(Mini Trans-Blot Cell)购自美国Bio-Rad公司;酶标仪购自美国MD公司(型号:FilterMax F3);双荧光素酶报告基因发光检测仪购自美国Promega公司(型号:GloMax 20/20);低温离心机购自德国Eppendorf公司(型号:5418R);凝胶成像系统购自上海天能科技有限公司(型号:Tanon 5200)。
1.3 miR-454-3p、ZEB2 mRNA的表达检测 采用RT-qPCR检测。收集鼻咽癌患者及健康体检者清晨空腹静脉血各3 ml,检测miR-454-3p水平;收集临床病理学确诊的鼻咽癌患者活检组织标本,检测miR-454-3p、ZEB2 mRNA的表达;收集经细胞裂解液处理的细胞样品,检测miR-454-3p、ZEB2 mRNA的表达。实验步骤:将上述检测样本使用Trizol法进行RNA提取,取1 μg总RNA进行逆转录获得cDNA单链,以此作为模板进行qPCR检测,miR-454-3p的内参为U6,ZEB2的内参为β-actin,扩增参数为:95℃30 s;95 ℃ 5 s,62 ℃ 34 s,共 40 个循环,每个样品设置3个平行反应孔,实验重复3次,采用2-ΔΔCt法计算相对表达量。引物序列见表1。

表1 引物序列
1.4 细胞分组及转染 取对数增殖期的CNE-2细胞,以每孔2×106个细胞接种于6孔板中,培养至细胞融合度达70%~90%。随机分为Control组、miR-454-3p mimic组、Mimic-NC 组、miR-454-3p mimic+ZEB2 plasmid组和miR-454-3p mimic+vector组。按照LipofectamineTM2000转染试剂说明书要求,将miR-454-3p mimic和Mimic-NC转染至CNE-2细胞中,miR-454-3p mimic+ZEB2 plasmid组和miR-454-3p mimic+vector组则需额外转染ZEB2过表达质粒及对照载体,转染48 h后收集各组样品。Control组不进行任何处理。
1.5 细胞侵袭能力的测定 采用Transwell侵袭实验。将Matrigel胶铺于Transwel小室上室,置37℃培养箱24 h使Matrigel聚合成凝胶。将各组细胞消化制备单细胞悬液,将2.0×105细胞加入Transwell上室,下室加入500 μl含10%FBS的培养基,于37℃、5% CO2细胞培养箱培养过夜,次日取出,用棉签轻轻擦去上室表面的细胞,多聚甲醛固定,0.1%结晶紫染色,PBS清洗,显微镜下计数后取平均数,检测细胞的侵袭能力,实验重复3次。
1.6 细胞迁移能力的测定 采用细胞划痕实验。细胞接种于6孔板并进行相应转染处理,待细胞融合度达约90%后,用灭菌的200 μl枪头垂直于板底均匀地划痕,用无菌PBS洗去脱落细胞,于显微镜下观察划痕处有无细胞并拍照记录,随后放回细胞培养箱继续培养24 h再次取样拍照,用Image J软件计算0 h及24 h划痕面积,实验重复3次。细胞迁移率=(T0h面积-T24h面积)/T0h面积×100%。
1.7 ZEB2、E-cadherin、N-cadherin、Vimentin 蛋白表达水平的测定 采用Western blot法。细胞经相应转染处理后48 h收集样品,RIPA法进行总蛋白提取,BCA法定量后,取50 μg总蛋白,进行SDS-PAGE垂直电泳,将胶上的蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭2 h,一抗孵育,4℃过夜,洗去一抗,孵育对应种属HRP标记的二抗,室温1 h,洗去二抗,用化学发光显色液显色。以β-actin为内参,采用Image J软件分析并计算 ZEB2、E-cadherin、N-cadherin、Vimentin蛋白相对表达水平,实验重复3次。
1.8 双荧光素酶报告基因实验 CNE-2细胞用含10%FBS的DMEM培养基培养于37℃、5% CO2培养箱中。将ZEB2 3'UTR-WT及ZEB2 3'UTR-MUT构建到pmirGLO载体中,获得WT-ZEB2和MUT-ZEB2,不含任何外源片段的空载体作为阴性对照。pmirGLO载体的萤火虫荧光素酶luc2作为主要报告基因,海肾荧光素酶hRluc-neo为对照报告基因,按照LipofectamineTM2000说明书进行转染,将miR-454-3p mimic分别与WT-ZEB2和MUT-ZEB2转染到细胞中,同时以Mimic-NC作为对照。设置3复孔,转染后培养12 h,用双荧光素酶报告基因检测系统检测萤火虫荧光素酶活性,以海肾荧光素酶hRluc-neo的活性作为校正报告基因,实验重复3次。
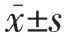
2 结果
2.1 miR-454-3p的表达与鼻咽癌恶性进展的关系 鼻咽癌患者血清miR-454-3p水平为0.57±0.09,低于健康体检者的1.02±0.17,差异有统计学意义(P<0.05)。在鼻咽癌分期中,Ⅲ、Ⅳ期患者鼻咽癌组织miR-454-3p的相对表达水平为0.48±0.09,低于Ⅰ、Ⅱ期患者的 0.98±0.18,差异有统计学意义(P<0.05);Ⅲ、Ⅳ期患者鼻咽癌组织ZEB2 mRNA相对表达水平为2.12±0.53,高于Ⅰ、Ⅱ期患者的 1.06±0.19,差异有统计学意义(P<0.05)。miR-454-3p与 ZEB2 mRNA的表达呈负相关(r=-0.734,P<0.01),见图 1。

图1 鼻咽癌组织中miR-454-3p和ZEB2 mRNA关系的散点图
2.2 miR-454-3p对CNE-2细胞ZEB2的调控 双荧光素酶报告基因实验结果显示,与Mimic-NC组比较,过表达miR-454-3p可降低ZEB2 3'UTR-WT的荧光素酶活性,差异有统计学意义(P<0.05),而不影响ZEB2 3'UTR-MUT的荧光素酶活性,差异无统计学意义(P>0.05),见图 2。CNE-2细胞转染 miR-454-3p mimic后,与Mimic-NC组比较,miR-454-3p mimic组miR-454-3p表达水平明显升高,ZEB2 mRNA及蛋白表达水平明显降低,差异均有统计学意义(均P<0.05),但与Control组比较差异均无统计学意义(均P>0.05)。CNE-2细胞转染ZEB2过表达质粒后,相较于miR-454-3p mimic+vector组,miR-454-3p mimic+ZEB2 plasmid组中ZEB2 mRNA及蛋白表达水平明显升高,差异均有统计学意义(均P<0.05),但miR-454-3p表达水平的差异无统计学意义(P>0.05);miR-454-3p mimic组与miR-454-3p mimic+vector组 miR-454-3p和ZEB2的表达水平比较差异均无统计学意义(均P>0.05)。见表 2、图 3。

图2 双荧光素酶报告基因实验检测结果

表2 各组细胞miR-454-3p与ZEB2mRNA及蛋白的表达水平比较

图3 Western blot检测ZEB2蛋白表达电泳图
2.3 miR-454-3p抑制EMT降低CNE-2细胞的侵袭和迁移能力 与Mimic-NC组比较,miR-454-3p mimic组N-cadherin和Vimentin蛋白表达水平降低,E-cadherin蛋白表达水平升高,侵袭细胞数及迁移率降低,差异均有统计学意义(均P<0.05)。Mimic-NC组与Control组比较差异均无统计学意义(均P>0.05)。与miR-454-3p mimic+vector组比较,miR-454-3p mimic+ZEB2 plasmid组中N-cadherin和Vimentin蛋白表达水平及侵袭细胞数、迁移率明显升高,E-cadherin蛋白表达水平明显降低,差异均有统计学意义(均P<0.05);miR-454-3p mimic组与miR-454-3p mimic+vector组结果比较差异无统计学意义(P>0.05)。见表3、4,图4、5(见插页)、6。
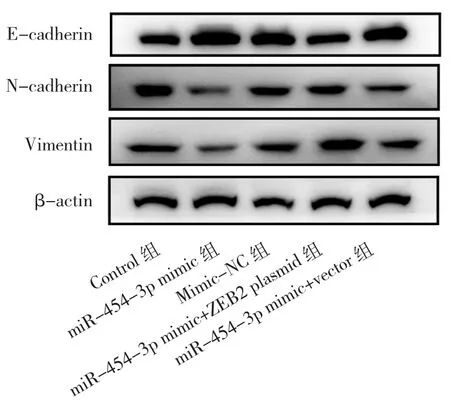
图4 Western blot检测 E-cadherin、N-cadherin、Vimentin 蛋白表达电泳图

图5 Transwell侵袭实验检测 CNE-2 细胞侵袭能力结果图(a:Control组;b:miR-454-3p mimic组;c:Mimic-NC 组;d:miR-454-3p mimic+ZEB2 plasmid 组;e:miR-454-3p mimic+vector组;×100)

图6 细胞划痕实验检测 CNE-2 细胞迁移能力结果图(a、f:Control组;b、g:miR-454-3p mimic组;c、h:Mimic-NC 组;d、i:miR-454-3p mimic+ZEB2 plasmid 组;e、j:miR-454-3p mimic+vector组;×40)

表3 各组细胞E-cadherin、N-cadherin和Vimentin蛋白的相对表达水平比较
3 讨论
鼻咽癌是头颈部肿瘤的主要类型之一,具有明显的地理分布特征,常见于中国南部(特别是两广地区)及东南亚地区[6],严重危害人类健康。尽管调强放疗和同步放化疗的患者健康状况得以改善,使鼻咽癌的5年局部控制率已达80%~90%,但仍有15%~30%的患者发生骨、淋巴结、肝和肺的远处转移,这些转移事件是导致鼻咽癌患者死亡的主要原因[7-8]。因此,迫切需要研究潜在鼻咽癌患者转移的分子机制,并开发新的标志物以预测原发性鼻咽癌患者的转移风险。

表4 各组细胞侵袭细胞数及迁移率的比较
越来越多的研究显示,miRNA参与多种生物学过程,包括细胞增殖、分化、迁移、凋亡、细胞周期调控以及侵袭、发育和代谢等[9]。miRNA被认为是包括鼻咽癌在内许多肿瘤的关键分子,可作为潜在的预后生物标志物[10];在功能上,充当肿瘤抑制基因或致癌基因的miRNA的失控会影响癌症发生、发展;此外,miRNA的表达与化学抗性或放射抗性表型有关,表明miRNA在介导致癌过程中的重要性[11]。miR-454-3p是miR-454家族的一个亚基,可调控肿瘤启动、侵袭和转移机制。在神经胶质瘤、非小细胞肺癌、肾癌、膀胱癌、食管癌等恶性肿瘤中,miR-454-3p起抑癌作用,可抑制癌细胞增殖、迁移、侵袭,并促进癌细胞凋亡[12-13]。本研究发现,鼻咽癌患者血清miR-454-3p水平低于健康体检者,且Ⅲ、Ⅳ期患者组织miR-454-3p mRNA的表达水平也低于Ⅰ、Ⅱ期患者,表明miR-454-3p在鼻咽癌恶性进展中也可能发挥抑癌作用。
miRNA主要通过靶向靶基因的3'UTR,抑制其表达来发挥其功能。本研究中双荧光素酶实验结果显示,miR-454-3p可靶向ZEB2 3'UTR,降低荧光素酶活性。同时还发现,Ⅲ、Ⅳ期患者组织中ZEB2 mRNA相对表达水平高于Ⅰ、Ⅱ期患者,说明了ZEB2在鼻咽癌进展中起促癌作用,与既往研究一致;且鼻咽癌组织中miR-454-3p与ZEB2 mRNA的表达呈负相关,表明miR-454-3p在鼻咽癌中的抑癌机制与ZEB2有关。ZEB家族包含ZEB1和ZEB2,可通过结合靶标E-box区充当转录抑制因子和激活因子,从而抑制一些上皮连接和极性基因(如E-cadherin),激活定义EMT表型的间充质基因(如N-cadherin),驱动EMT[14]。这也进一步提示miR-454-3p可能通过靶向ZEB2进而介导鼻咽癌EMT过程。
肿瘤转移是一个从原发部位转移到远处器官的渐进过程,包括局部浸润、内渗、弥散、外渗和定植。越来越多的证据表明,EMT是癌细胞获得转移能力的关键[15]。EMT导致细胞活动性增强,使肿瘤向远处转移部位扩散,其分子特征是上皮型标志物E-cadherin下调,间叶细胞标志物 N-cadherin、Vimentin上调[16]。EMT是由一组转录因子(EMT-TFs)介导的,其中包括ZEB家族、Snail、Twist和Slug。这些TFs通过激活或抑制维持上皮或间质特征的下游靶点来协调调控EMT,而这些EMT-TFs本身受多种信号控制,如miRNA等,EMT-TFs异常可促进肿瘤进展[17]。为进一步探究miR-454-3p对EMT的调控,笔者通过在CNE-2细胞中瞬时转染miR-454-3p mimic,结果显示过表达miR-454-3p 可显著降低 ZEB2、N-cadherin、Vimentin表达,升高E-cadherin表达,同时降低细胞侵袭及转移能力,表明miR-454-3p可抑制鼻咽癌细胞EMT。此外,为验证miR-454-3p对ZEB2的调控机制,本研究也在CNE-2细胞中转染了ZEB2过表达质粒,结果显示过表达ZEB2可逆转miR-454-3p mimic对EMT的抑制作用,促进鼻咽癌细胞侵袭、转移,与鼻咽癌组织样本结果一致,证实了ZEB2对EMT的促进作用,同时过表达ZEB2不影响miR-454-3p的表达,也进一步说明ZEB2位于miR-454-3p的下游,miR-454-3p可通过靶向ZEB2进而抑制鼻咽癌细胞EMT。
综上所述,miR-454-3p是多种恶性肿瘤的关键调控因子。本研究表明,miR-454-3p可抑制鼻咽癌细胞增殖、侵袭和转移,其机制可能是靶向抑制ZEB2的表达,进而抑制鼻咽癌EMT。提示miR-454-3p可能是鼻咽癌转移风险的潜在预测指标,其在鼻咽癌转移机制中的潜在分子机制值得进一步深入探究。

