11C-PIB PET在监测阿尔茨海默病患者淀粉样蛋白沉积中应用价值研究
郭 佳, 戴盈欣, 石庆学, 吴锐先, 陈宇峰, 张国旭, 王治国
北部战区总医院 核医学科,辽宁 沈阳 110016
阿尔兹海默病(Alzheimer′s disease,AD)是常见的脑神经退行性疾病之一,起病隐袭,β-淀粉样蛋白(amyloid β-protein,Aβ)沉积形成的老年斑是AD的特征性病理改变,发生在AD病变的早期阶段[1]。早在1991年,Braak等[2]使用死后脑组织描述了淀粉样沉积(淀粉样斑块)和神经纤维缠结在AD多个阶段的病理分布区域演变。PIB与淀粉样蛋白具有足够高的亲和力,可以在PET中检测到。PIB能够穿过血脑屏障,并从正常脑组织中清除。11C-PIB作为Aβ特异性分子探针,在监测脑内纤维状Aβ变化方面具有无创、实时、可定量等优势,为脑内Aβ沉积检测提供可能[3]。Klunk等[4]研究报道,与健康对照组比较,AD患者额叶和颞顶叶相关皮质和纹状体区域11C-PIB滞留更多。2010年的AD诊断标准提出,AD是一个连续进展的疾病谱,分为临床前期AD、AD型轻度认知障碍(mild cognitive impairment,MCI)及AD型痴呆[5]。目前,由于缺乏评价AD的特异性生物学标志物,临床上还不能真正做到对AD的早期诊断,无法将AD的病程控制在预防阶段。本研究旨在探讨11C-PIB PET在监测AD患者淀粉样蛋白沉积中的应用价值。现报道如下。
1 对象与方法
1.1 研究对象 回顾性分析北部战区总医院2018—2021年收治的9例疑似未确诊AD者的临床资料。纳入标准:首次看诊时简易智力状态检查(mini-mental state examination,MMSE)评分为20~28分;存在主观认知障碍;按照临床治疗常规接受或未接受相应治疗;在我院进行至少2次11C-PIB PET及临床随访;随访中MMSE评分较前显著降低。排除标准:经系统检查后排除脑血管性病变,无大面积梗塞灶;患有其他脑部器质性病变。9例疑似未确诊AD者中,男性7例,女性2例;年龄57~82岁,平均年龄(67.3±10.2)岁;受教育时长9~16年,平均(12.6±4.1)年。本研究经医院伦理委员会批准。
1.2 仪器设备11C由GE MINItrace回旋加速器生产,并由Tracerlab FXc合成器合成为11C-PIB,正电子扫描显像由GE Discovery PET/CT完成。
1.3 PET扫描方法 受试者平卧于检查床,将脑部置于头托并加以固定。静脉注射11C-PIB(666~740 MBq)后立即行动态PET扫描。采用3D模式连续釆集60 min,经迭代重建(FORE-Iterative)法得到12帧图像,即(5×120)s、(4×300)s、(3×600)s。PET扫描参数:3D模式,能量窗上限650 Mev、下限300 Mev,轴向视野15.2 cm,层间隔4.25 mm,层厚5 mm,扫描范围从颅顶至颅底,矩阵128×128。CT扫描参数:峰值电压140 Kev,电流120 mA,螺旋扫描,速度0.8 s/周,床速15 mm/周,螺距6∶1,釆用标准方法重建得到CT图像,矩阵512×512。
1.4 图像处理 由2名核医学医师分别独立完成PET图像阅片工作,分析PIB在脑内分布特点。PIB视觉分析釆用第11帧(40~50 min)图像,此时,PIB在不同脑区摄取情况对比明显。视觉分析的内容包括是否有脑萎缩,大脑皮层放射性的整体分布是否均匀,各脑叶(额叶、顶叶、颞叶、枕叶)皮层、部分皮层下结构(丘脑、脑干)及小脑半球的放射性分布是否均匀、对称等。结果以2名医师取得的一致意见为准。
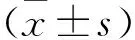
2 结果
首次测评MMSE评分为(26.2±2.7)分,随访测评MMSE评分为(18.4±3.2)分,差异有统计学意义(P<0.05)。额叶、楔前叶、后扣带回的随访测评PIB最大标准摄取值高于首次测评,枕叶、丘脑的随访测评PIB最大标准摄取值低于首次测评,差异有统计学意义(P<0.05)。见表1。MMSE评分与额叶、楔前叶、后扣带回的PIB摄取呈负相关(r=-0.413、-0.541、-0.575,P<0.05),与枕叶、丘脑的PIB摄取呈正相关(r=0.372、0.394,P<0.05)。首次11C-PIB PET显示,大脑皮层(尤其是颞叶皮层)、丘脑、小脑可见弥漫性PIB摄取,而皮层下结构未见明显的PIB滞留;随访11C-PIB PET显示,双侧额叶、顶叶、楔前叶、颞叶外侧皮层、纹状体、后扣带回的PIB放射性摄取增高,大部分区域呈对称性,皮层下结构也可见部分PIB摄取,小脑皮层未见明显PIB摄取。见图1~2。

表1 9例受检者不同位置PIB最大标准摄取值比较

图1 11C-PIB PET首次和随访图像(a~b.首次11C-PIB PET显示,大脑皮层及小脑轻度弥漫性PIB摄取;c~d.随访11C-PIB PET显示,PIB沉积更加弥漫,且灰白质界限不清,呈现“平原征”)

图2 11C-PIB PET首次和随访图像(a~f.首次11C-PIB PET显示,枕叶、小脑11C-PIB放射性摄取弥漫性增高;g~l.随访11C-PIB PET显示,楔前叶11C-PIB摄取增高,枕叶、小脑11C-PIB摄取相对减低)
3 讨论
AD是中枢神经系统退行性疾病,起病隐袭,且呈进行性发展,在疾病的不同阶段,患者的临床表现也不相同,目前,临床上缺乏客观的AD特异性生物学标志物,主要依靠患者的临床症状、神经心理学检査量表及常规影像学进行综合诊断,最终确诊需要从组织活检或尸检病理中获得。
AD有两大病理学特征,一是位于细胞外由淀粉样蛋白组成的老年斑,二是位于细胞内由过度磷酸化的Tau蛋白组成的神经纤维缠结[6]。Aβ纤维在脑内沉积后具有神经毒性,可引发系列而复杂的反应,其中主要包括突触的变化、Tau蛋白磷酸化、递质丢失、神经胶质增生和炎症反应等[7]。这些反应可以导致斑块形成、神经纤维缠结,从而造成神经元的变性和功能障碍,甚至死亡,最终导致AD发生[8]。有研究报道,AD组患者脑脊液中Aβ42表达水平和Aβ42/Aβ4G比例均显著低于对照组,且此表现发生在临床痴呆症状出现之前,因此,可以作为正常老年人认知功能减退的预测因子[9]。但是,脑脊液检查只能分析大脑总体水平上Aβ的变化[10],对不同时期AD的Aβ水平变化的监测目前尚无定论。自淀粉样蛋白特异性示踪剂11C-PIB由美国匹兹堡大学研发、命名并首次应用于人类以来,其在全世界范围内得到了广泛的认可及应用[11-12]。PET具有无创、在体、实时及定量检测脑内淀粉样斑块的优势,为AD的发病机制研究、适应证人群筛选及临床效果评估提供有力帮助[13-14]。在对11C-PIB PET图像的分析中,视觉分析方法简单且常用,适用于临床日常工作,凭借对图像中部位放射性摄取程度判读阴性或阳性。
本研究中,9例受检者疑似AD,但11C-PIB PET认为当时状态符合MCI诊断,尚未进入AD阶段。在随访过程中,疾病缓慢进展,11C-PIB PET结果及MMSE评分均发生了显著变化,且PIB最大标准摄取值与MMSE评分具有显著相关性,与既往研究[15]结果一致。
综上所述,11C-PIB PET能够早期警示AD患者的认知状态,并对疾病进展情况进行判断,可以作为临床诊断、早期采取干预措施的影像学参考。

