外膜蛋白ompC过表达提高大肠杆菌对庆大霉素敏感性研究
马月龙,赖泽迎,冯荆城,林少青,陈雅娟
(细胞逆境响应与代谢调控福建省高校重点实验室/福建师范大学生命科学学院,福建 福州 350108)
庆大霉素1966年在我国被王岳教授首次分离,并实现工业生产,它是畜牧养殖业重要的氨基糖苷类抗生素之一,伴随着其长期大量的使用,耐药性问题日益突出造成庆大霉素的有效利用率显著降低[1-2],从细胞水平寻找耐药菌对抗生素的敏感位点使其重新发挥作用迫在眉睫。本研究发现外膜蛋白ompC过表达能够极显著提高庆大霉素对大肠杆菌的杀伤效果,这可以有效阻止抗生素耐药性在农业养殖业中的蔓延,具有二次利用现有庆大霉素快速将致病菌进行杀灭的重大价值。目前关于大肠杆菌对氨基糖苷类抗生素耐药性机制的认识主要包括三个方面:一是大肠杆菌对氨基糖苷类药物细胞内积累量的降低[3];二是氨基糖苷类抗生素钝化酶对氨基糖苷类抗生素产生了修饰行为[4-5];三是突变或甲基化修饰改变了氨基糖苷类抗生素在细菌核糖体30S亚基中16S rRNA上的结合作用位点。其中后两种机制可造成更高水平的耐药性[6-7], 针对大肠杆菌对庆大霉素耐药性问题,在体外水平上,目前主要采用联合防治策略,通过庆大霉素与其他抗菌药物的联合使用,特别是与β-内酰胺类抗生素协同使用使其成为在养殖业抗击病原菌严重感染中的利器[8]。在体内水平上,赵艳娜等[9]创新性提出,可通过快速冷冻提高药物在菌体胞内的积累达到清除致病菌的目的。另有吕波燕等[10]研究表明低离子休克能够增强耐药菌对庆大霉素的摄取,从而造成对病原菌的杀灭。多项研究有力表明离子通道蛋白可作为有力的潜在药敏靶点[11-12]。同时,醇类、吲哚及抗菌肽等代谢物被报道能辅助庆大霉素杀灭致病性大肠杆菌[13-14],然而目前尚未有研究表明外膜蛋白在庆大霉素对致病性大肠杆菌的杀菌效果上具有潜在的作用。
本研究借鉴前人经验聚焦于大肠杆菌外膜蛋白家族,以期在众多外膜蛋白中发现新的有助于菌体摄取庆大霉素的敏感结合位点,发掘外膜孔蛋白上在应对庆大霉素耐药性的潜在价值。大肠杆菌膜上主要的孔蛋白ompC非常丰富,并且都具有阳离子选择性[15],有极大的可能性利于菌体对抗生素的额外摄取。故本试验提出假设,过表达孔蛋白ompC是否有助于抗生素通过细菌膜进入胞内起到杀菌的目的。本研究通过使用pCA24N表达载体构建大肠杆菌外膜蛋白过表株W3110-p4A24N(ompC),并与野生型进行庆大霉素杀伤效果比较,测试大肠杆菌ompC过表达对庆大霉素杀菌效果的影响。利用免疫印迹法探究ompC蛋白表达量与庆大霉素杀菌效果的关系,并进一步测定过表达菌株的MIC,以评估大肠杆菌膜孔隙蛋白在抗生素体内的杀伤作用,以期望发现新的药敏靶点。
1 材料与方法
1.1 试验材料
本试验采用的菌株见表1。

表1 菌株的名称及其来源
1.2 抗生素类型
所用抗生素和使用浓度见表2。

表2 抗生素名称和使用浓度
1.3 主要仪器
超低温冰箱(-80℃)、洁净工作台、恒温震荡培养箱(37℃)、紫外可见分光光度计、扫描仪、蛋白质电泳系统、电泳仪、制冰机、加热制冷型金属浴连接仪、蛋白质凝胶转印系统、水平摇床、垂直脱色摇床等。
1.4 试验方法
1.4.1过表达载体W3110-pCA24N(ompC)测序验证 从-80℃超低温冰箱的ASKA文库中选取W3110-pCA24N(ompC),划在氯霉素抗性固体LB固体培养基平板上,挑取单克隆,再用新鲜氯霉素抗性液体LB培养基恒温培养箱培养12~16 h,用EasyPure Plasmid MiniPrep Kit提取质粒(依照产品说明书操作),取0.2 mL到EP管中,用已合成的上下游引物p-sfiⅠ和p-NotI送去公司对提取的质粒进行基因序列的验证,引物序列见表3。

表3 引物序列
1.4.2免疫印迹法检测ompC过表达情况 将W3110-pCA24N、W3110-pCA24N(ompC)按1∶100的接菌比例转接至含氯霉素抗性的液体LB中,在摇床中培养至OD600≈0.5~0.6时加不同浓度的IPTG(一种诱导蛋白表达的试剂,全名为异丙基-β-D-硫代半乳糖苷)(0.1、0.5、1 mmol·L-1),继续放置在摇床中诱导至OD600≈0.8,之后取菌液1 mL,12 000 r·min-1转速离心机离心2 min,弃上清加入30 μL的10% SDS溶液和30 μL的6× loading buffer,混合均匀,置于100℃的金属浴上煮沸15 min。用10%的SDS-PAGE凝胶电泳将样品进行分离,电泳液为1×SDS电泳缓冲液。凝胶电泳结束后,使用PVDF膜进行转膜。转膜结束后封闭液封闭1 h。封闭结束后,加入一抗,置于水平摇床上反应30 min后,置于4℃冰箱过夜静置12 h。过夜后的膜置于垂直脱色摇床上,用1× TBST缓冲液洗涤3次,每次间隔8~10 min。洗涤后置于水平摇床上,加入二抗反应1.5 h,再换置于摇床上,用1×TBST缓冲液洗涤3次,每次间隔8~10 min。最后进行BCIP/NBT试剂显色。
1.4.3ompC过表达菌株抗生素敏感性检测 将菌株W3110-pCA24N、W3110-pCA24N(ompC)预先活化。将活化好的菌液1∶100转接至含氯霉素液体LB中,置于摇床中培养至OD600≈0.5~0.6时加入终浓度分别为0.1、0.5、1 mmol·L-1的IPTG,继续放置于摇床中诱导至OD600≈0.8。取菌液100 μL于EP管中,12 000 r·min-1离心2 min,去上清,用等体积的0.01 mol·L-1PBS缓冲液重悬作为对照样品备用。取1 mL诱导至OD600≈0.8的菌液于玻璃摇菌管中,离心去上清,加入10% SDS溶解液和6×loadiong buffer缓冲液进行制样后进行免疫印迹检测蛋白表达情况,同时取1 mL离心去上清,采用庆大霉素对过表达诱导程度不同的大肠杆菌进行处理,置于摇床中培养,45 min后取100 μL于EP管中,离心后去上清,用等体积的0.01 mol·L-1PBS缓冲液重悬作为试验样品,将以上样品用缓冲液梯度稀释后点板,平板在37℃过夜培养12 h,观察细菌存活情况,根据菌落计数,计算存活率。取3次平行试验的结果进行显著性分析。
1.4.4ompC过表达菌株最小抑菌浓度(MIC)测试 最小抑菌浓度MIC是抑制细菌生长所加的最小的药物浓度,同时这也是判断药物是否有效的标准。国际抗菌素协会规定用二倍稀释法来确定MIC[16]。
将活化好的W3110-pCA24N、W3110-pCA24N(ompC)按1∶100转接至含氯霉素液体LB中,置于摇床中培养至OD600≈0.5~0.6时加入浓度为1 mmol·L-1的IPTG,继续放置于摇床中诱导至OD600≈0.8。2倍稀释法将抗生素稀释成相应浓度(0、0.5、1、2、4、8、16、32、64 μg·mL-1),在无菌96孔板上按照浓度梯度顺序每孔加入200 μL抗生素稀释液,将诱导后的菌液稀释5倍后,每个孔中加入2 μL稀释后的菌液即每孔菌量约为105~106CFU·mL-1,全部上样完成后,37℃静置培养24 h。取出96孔板,用枪头轻轻吹打混匀菌液,在肉眼条件下对光观察,清澄透光的孔对应的最低抗生素浓度为该菌体外培养最低抑菌浓度(MIC)。

图1 W3110-pCA24N(ompC)测序结果Fig.1 Sequencing results of W3110-pCA24N (ompC)
2 结果与分析
2.1 过表达载体W3110-pCA24N(ompC)测序验证
将测序结果在NCBI中进行Blast序列比对,由图1可知,测序结果与该基因原始序列一致且相似度将近100%。
2.2 免疫印迹法检测结果分析
由图2可知,0.1、0.5和1 mmol·L-1IPTG诱导的3个W3110-pCA24N(ompC)分别用A、B、C表示,均成功跑出条带,提示W3110-pCA24N(ompC)过表达诱导成功(ompC蛋白大小约38 kDa),并且该蛋白的表达量随着IPTG浓度的升高而升高。
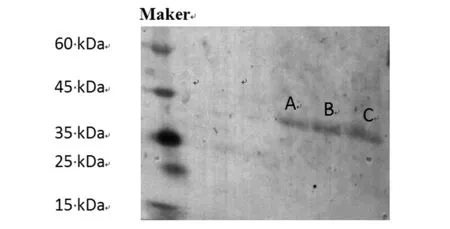
图2 不同诱导浓度下W3110-pCA24N(ompC)免疫印迹检测结果Fig.2 Immunoblotting detecting results of W3110-pCA24N(ompC) at different induced concentrations
2.3 ompC过表达提高大肠杆菌对庆大霉素的敏感性
由图3可知,经过比对分析,庆大霉素对W3110-pCA24N(ompC)组的杀菌效果明显强于W3110-pCA24N组,表明过表达ompC能显著增强大肠杆菌对庆大霉素的敏感性;W3110-pCA24N(ompC)经不同浓度IPTG诱导后大肠杆菌对庆大霉素的敏感性随着IPTG浓度的升高而增强。
2.4 测定过表达菌株最小抑菌浓度
由图4可知,过表达ompC后的菌株 W3110-pCA24N(ompC)的最小抑菌浓度8 ug·mL-1明显低于W3110-pCA24N(野生型)的16 ug·mL-1,表明外膜蛋白ompC的过表达增强了大肠杆菌对庆大霉素的敏感性。

图3 不同浓度诱导野生型和W3110-pCA24N(ompC)过表达株对庆大霉素的敏感性Fig.3 Sensitivity of the wild-type strain and the over-expressing strain of W3110-pCA24N (ompC) to gentamicin induced by different concentrations

图4 W3110-pCA24N和W3110-pCA24N(ompC)过表达株最小抑菌浓度测定结果Fig.4 Determined results of the minimum inhibitory concentration of W3110-pCA24N and the over-expressing strain of W3110-pCA24N (ompC)
3 结论与讨论
抗生素在防治人和动物疾病、促进畜牧养殖业持续健康发展中起着举足轻重的作用,但随着其在农业生产和临床治疗中的广泛使用甚至滥用,细菌耐药性问题日益突出。促使抗菌药物对耐药菌重新发挥杀菌作用,提高现存抗生素的有效利用率是阻止细菌耐药现象蔓延的关键一步。因此在分子水平上寻找新的药物敏感位点是必要的。细菌与外界环境的交流主要通过外膜蛋白来进行,同时这也是抗菌药物进入细菌当中发挥作用的重要通道。如果外膜蛋白的表达量下降,抗菌药物就无法进入细胞内,宏观上表现出细菌对该抗菌药物的耐受性增强[17]。近年来,研究大肠杆菌耐药机制的方向主要是改变外膜通透性、形成相应水解酶、泵系统外排、改变作用靶位、减小外膜渗透压以及形成生物被膜等多种方面[18],已有相关研究表明大肠杆菌可以通过被改变外膜通透性、调节控制外膜蛋白的结构来影响其敏感性[19-20]。
大肠杆菌的外膜蛋白ompC作为其中数量较多的外膜蛋白之一,本研究发现ompC过表达后能够极其显著降低大肠杆菌对庆大霉素的存活率,进一步研究发现,与对照相比,最小抑菌浓度(MIC)明显降低,因此认为外膜蛋白ompC过表达显著提高了大肠杆菌对庆大霉素敏感性,庆大霉素更多地被摄入大肠杆菌胞内,这使得大肠杆菌对庆大霉素的耐药性降低,增强了庆大霉素的杀菌效果。这一发现对于治疗致病性菌造成的持续性感染疾病有着重要的实践及理论意义,且该敏感位点是否适用于对其他致病菌的杀灭是值得更深一步探究的地方。

