柚皮素通过调控TGF-β1/smad通路抑制肝纤维化
岳杉杉,彭安康,马泽江,祁 荣
(1.石河子大学医学院,新疆 石河子 832000;2.北京大学医学部基础医学院药理学系,北京 100191)
肝纤维化是肝脏在受到多种因素损伤之后的一种病理过程[1]。纤维化早期阶段具有一定的可逆性,但如果不加以药物控制和治疗,纤维化程度将进一步加重,发展为肝硬化、肝衰竭,甚至肝癌。目前临床上尚缺乏特异性治疗肝脏纤维化的药物。
柚皮素(naringenin,NGN)是一种富含于柑橘类水果中的黄酮类化合物,其中在葡萄柚中含量最为丰富。目前已有研究表明NGN具有多种生物活性,如:能够明显减少巨噬细胞激活后炎性细胞因子如肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白介素-6(interleukin-6,IL-6)等的分泌,起到抗炎作用[2];可以激活核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2),使得血红素氧合酶1(heme oxygenase-1,HO-1)的表达上调,起到抗氧化作用[3-4];可以明显促进肝细胞代谢,起到抑制ApoE-/-小鼠高脂血症所致的脂肪肝的作用[5]。近期有研究发现,NGN对四氯化碳(carbon tetrachloride,CCL4)诱导的肝纤维化具有保护作用[6-7]。但CCL4诱导的肝纤维化为化学性损伤所导致,而化学损伤导致的肝脏纤维化并不是临床病人中常见的发病原因。与此同时,社会的进步和发展促使人们的生活方式和饮食结构发生了改变,代谢性肝纤维化的发病率与日俱增。蛋氨酸-胆碱缺乏饲料(methionine-and choline-deficient diet,MCD diet)是研究者公认的可用于研究小鼠代谢性肝纤维化的模型,MCD饲料诱导的肝纤维化可以很好的模拟代谢性肝纤维化病人的病理特征,即小鼠肝脏可见肝细胞脂肪样变、炎性细胞浸润和肝窦周围纤维化。我们课题组前期的研究发现NGN可剂量依赖性地抑制MCD饮食诱导的小鼠肝脏脂质沉积和肝脏核因子-κB(nuclear factor kappa-B,NF-κB)、NLRP3炎症小体的表达量[8-9]。但是NGN对MCD饲料诱导的肝纤维化的作用尚不清楚,也无相关研究报道。本研究在体外转化生长因子-β1(transforming growth factor-β,TGF-β1)激活的LX2细胞纤维化模型及MCD饮食诱导的小鼠肝纤维化体内模型上,研究NGN对肝脏纤维化的抑制作用及机制,研究结果将为临床治疗肝纤维化提供新的候选药物。
1 材料与方法
1.1 药品与试剂及仪器NGN(东京化成工业株式会社,批号:445AD-m7,纯度>98%)。ProteinExtTMMammalian Total Protein Extraction Kit(北京全式金生物技术有限公司,批号:001021),甘氨酸(上海阿拉丁有限公司,批号:L1928057),Tris base(美国Amresco公司,批号:913056784),TransZol Up(北京全式金生物技术有限公司,批号:P0327),RevertAid First Strand cDNA Synthesis Kit(美国Thermo公司,批号:K622),TransStart Top Green qPCR Supermix(北京全式金生物技术有限公司,批号:AQ131),高糖DMEM培养基(北京全式金生物技术有限公司,批号:P10413),胎牛血清(北京全式金生物技术有限公司,批号:FS201),转化生长因子-β1(美国peprotech公司,批号:0918AF354),BCA蛋白定量试剂盒(美国赛默飞公司,批号:UE284356),ECL试剂盒(南京诺唯赞生物科技技术有限公司,批号:7E4321KO),辣根过氧化物酶标记山羊抗兔IgG(上海碧云天生物技术有限公司,批号:19060315),辣根过氧化物酶标记山羊抗小鼠IgG(上海碧云天生物技术有限公司,批号:196790315),鼠抗GAPDH多克隆抗体(中国康城技术有限公司,批号:KG5G4),兔抗人血管平滑肌肌动蛋白(α smooth muscle actin,α-SMA)多克隆抗体(美国CST公司,批号:14395-1-AP),兔抗人TGF-β1多克隆抗体(美国CST公司,批号:218981-1-AP),兔抗人p-smad2 /p-smad3多克隆抗体(美国CST公司,批号:5675063),45%高脂蛋氨酸,胆碱缺乏饲料(南通特罗菲饲料科技有限公司购买,批号:TP20190825)。
1.2 仪器普通PCR仪(美国MJ Research公司,型号:960),实时荧光定量PCR仪(美国Agilent公司,型号:Agilent M×3005P),台式离心机(德国 Eppendorf公司,型号:Legend micro 21R),酶标仪(美国BioTek公司,型号:ELX808),细胞培养箱(美国Thermo公司,型号:Heracell),荧光显微镜(日本Olympus 公司,型号:Th4-200)。
1.3 方法
1.3.1MTT法检测细胞存活率[10]人肝星状细胞LX2用含10%胎牛血清和1%双抗(链霉素-青霉素)的DMEM培养,放置于37 ℃,5% CO2的培养箱中孵育。待LX2细胞融合度达到80%左右时,用0.25%胰酶消化,按每孔1 000个细胞接种于96孔板中。当细胞贴壁之后,用不含FBS只含1%双抗的DMEM饥饿细胞。24 h后,弃掉培养基,分别用含25、50、100、200、400、800、1 000 μmol·L-1NGN的10%胎牛血清和1%双抗的DMEM处理细胞。24 h后,弃掉培养基,每孔中加入100 μL含有MTT的10%胎牛血清和1%双抗的DMEM。4 h之后,弃掉培养基,每孔中加入150 μL二甲基亚砜。振板10 min,在490 nm处检测每孔的吸光值。
1.3.2细胞及分组 LX2细胞融合度达到80%左右时,用0.25%胰酶消化,按40×107个·L-1密度接种于6孔板中。当细胞贴壁之后,用不含胎牛血清只含1%双抗的DMEM饥饿细胞24 h。细胞分组为:对照组,模型组(TGF-β1),NGN低剂量组(100 μmol·L-1)和NGN高剂量组(200 μmol·L-1)。对照组用含10%胎牛血清和1%双抗的DMEM培养,模型组用含10 μg·L-1TGF-β1的10%胎牛血清和1%双抗的DMEM培养,NGN组用含10 μg·L-1TGF-β1和100/200 μmol·L-1NGN的10%胎牛血清和1%双抗的DMEM培养,24 h后收细胞,用于相关蛋白和基因的检测。
1.3.3动物分组及干预 8~10周龄的雄性C57BL/6小鼠,体质量(20~25)g,购于北京斯贝福生物技术有限公司,许可证号:SCXK(京)2019-0010。小鼠在SPF条件下饲养,环境温度维持在(25±2)℃,环境湿度维持在50%,光照和黑暗12 h更换交替,小鼠可自由获取水和食物。本实验获得北京大学生物医学伦理委员会批准(LA2016035)。
小鼠用普通饲料喂饲3 d后,随机分为3组,即:对照组、模型组、NGN处理组,对照组给予正常饲料,模型组和NGN组给予MCD 饲料,对照组和模型组每天给予0.5%羧甲基纤维素纳灌胃,给药组每天给予NGN(0.5% 羧甲基纤维素纳混悬配制)灌胃,剂量为100 mg·kg-1,6周后,牺牲小鼠,取材,制备石蜡切片进行天狼猩红染色,HE染色以及提取RNA和蛋白质用于检测纤维化相关基因(α-SMA,col1和col3),纤维化相关蛋白(α-SMA和col1)和TGF-β/smad通路蛋白(TGF-β1,p-smad2和p-smad3)的表达水平。
1.3.4苏木精-伊红染色方法检测肝脏形态[8]石蜡切片置于65 ℃烘箱中烘30 min;二甲苯脱蜡10 min,共3次;100%酒精洗2次,每次3 min,95%酒精洗2次,每次3 min,80%酒精洗3 min,70%酒精洗3 min;自来水下清洗切片;将切片放置在苏木精染液中1~3 min,自来水下清洗片子;将切片依次放置在85%酒精、95%酒精中进行脱水处理各5 min。将切片放置在伊红染液中3~5 min。自来水下清洗切片;切片依次放置在100%酒精、95%酒精、80%酒精、70%酒精、二甲苯中各处理5 min;用树脂封片,干燥后,在显微镜下拍照。
1.3.5天狼猩红染色方法检测肝脏纤维化程度 石蜡切片置于65 ℃烘箱中烘30 min;二甲苯脱蜡10 min,共3次;100%酒精洗2次,每次3 min,95%酒精洗2次,每次3 min,80%酒精洗3 min,70%酒精洗3 min;自来水下清洗切片;天狼猩红染液染色1 h。自来水下清洗切片;切片依次放置在100%酒精、95%酒精、80%酒精、70%酒精、二甲苯中各处理5 min;用树脂封片,干燥后,在显微镜下拍照,照片使用ImageJ软件分析其纤维化区域占整个区域的比例,并对结果进行统计分析。
1.3.6实时荧光定量PCR方法检测纤维化相关基因的表达 用TransZol Up提取细胞和肝脏中总RNA;按照RevertAid First Strand cDNA Synthesis Kit说明书将RNA逆转录为cDNA,按照TransStart Top Green qPCR Supermix说明进行实时荧光定量PCR。引物序列见Tab 1。

Tab 1 Primers involved in qPCR
1.3.7Western blot方法检测蛋白的表达[8]使用TPEB裂解细胞和肝脏组织,液氮反复冻融3次,离心,使用BCA试剂盒测量蛋白质浓度。取一定量的蛋白上清液中加入SDS上样缓冲液,在95 ℃煮10 min。处理好的蛋白样品进行SDS-PAGE电泳,然后转移到NC膜上。5%脱脂牛奶封闭2 h,加入一抗(根据说明书配置相应浓度)在4 ℃冰箱中过夜,TBST洗涤3次,加入相应的二抗(1 ∶5 000)在室温下孵育2 h,TBST洗涤3次,条带上滴加ECL,凝胶成像系统拍照,ImageJ软件分析条带灰度值。

2 结果
2.1 NGN对人肝星状细胞LX2存活率的影响MTT实验结果(Fig 1)显示,用25~200 μmol·L-1NGN处理人肝星状细胞后,检测到细胞存活率在80%以上。

Fig 1 Effect of naringenin on LX2 cells
2.2 NGN对TGF-β1诱导的人肝星状细胞LX2细胞纤维化相关基因的影响qPCR结果显示,与对照组相比,模型组col3和col1 mRNA水平明显升高(P<0.05);与模型组相比,NGN低剂量组col1和col3 mRNA表达未出现明显差异,NGN高剂量组col3和col1 mRNA表达明显降低(P<0.05),见Fig 2。所以,在后续的细胞实验中选用200 μmol·L-1NGN研究其抗纤维化的作用及机制。
2.3 NGN对TGF-β1诱导的LX2细胞纤维化相关蛋白的影响Western blot结果显示,与对照组相比,模型组α-SMA蛋白表达水平明显升高(P<0.05);与模型组相比,NGN处理组α-SMA蛋白表达明显降低(P<0.05),见Fig 3。

Fig 2 Effects of naringenin on mRNA expression of genes related to fibrosis in LX2 cells induced by A:mRNA levels of Col3;B:mRNA levels of Col1;1:Control;2:TGF-β1;3:TGF-β1+NGN 100 μmol·L-1;4:TGF-β1+NGN 200 μmol·L-1;*P<0.05 vs control group;#P<0.05 vs TGF-β1 group

Fig 3 Effects of naringenin on protein expression of α-SMA in LX2 cells induced by 1:Control;2:TGF-β1;3:TGF-β1+NGN 200 μmol·L-1;*P<0.05 vs control group;#P<0.05 vs TGF-β1 group
2.4 NGN对TGF-β1诱导的人肝星状细胞LX2细胞TGF-β1/smad通路蛋白的影响Western blot结果显示,与对照组相比,模型组TGF-β1和p-smad2蛋白表达水平明显升高(P<0.05);与模型组相比,NGN处理组TGF-β1和p-smad2蛋白表达明显降低(P<0.05),见Fig 4。

Fig 4 Effects of naringenin on protein expression of TGF-β1 and p-smad2 in LX2 cells induced by 1:Control;2:TGF-β1;3:TGF-β1+NGN 200 μmol·L-1;*P<0.05 vs control group;#P<0.05 vs TGF-β1 group
2.5 NGN对MCD饲料诱导的小鼠体重、肝重的影响与对照组相比,MCD饲料喂饲6周之后小鼠的体质量和肝质量明显降低,肝/体质量比明显升高;与模型组相比,NGN处理组小鼠肝质量、体质量以及肝/体质量比与模型组相比,没有明显改变,见Fig 5。

Fig 5 Effects of naringenin on liver and body weight of mice induced by MCD diet A,B:Body weight;C:Liver weight;D:The ratio of liver weight to body weight;1:Control;2:MCD;3:MCD+NGN 100 mg·kg-1.*P<0.05,**P<0.01 vs control group
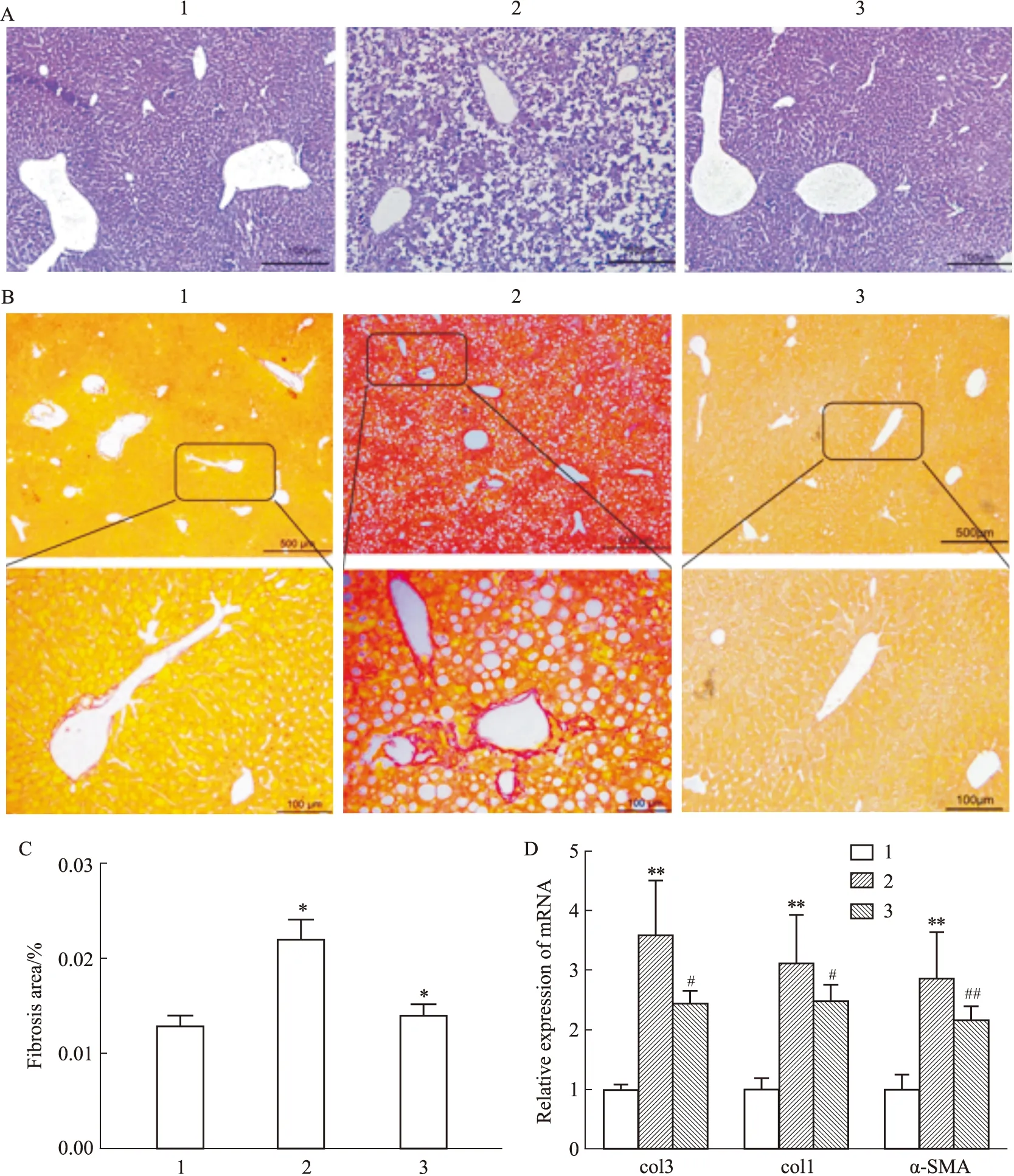
Fig 6 Effects of naringenin on liver fibrosis and mRNA levels of genes related to fibrosis in mice induced by MCD A:HE staining (×100);B,C:Sirius red staining (×100,×500);D:mRNA levels α-SMA,col3,col1;1:Control;2:MCD;3:MCD+NGN 100 mg·kg-1.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs MCD group
2.6 NGN对MCD饲料诱导的小鼠肝脏纤维化及相关基因的影响HE染色和天狼猩红染色结果表明,与对照组相比,MCD饲料喂饲6周后,小鼠肝脏细胞排列不规则,且有空泡形成,纤维化程度明显增加;与模型组相比,NGN处理组细胞排列规则,空泡减少,且肝脏纤维化程度明显降低(Fig 6A-C)。肝脏组织mRNA实时荧光定量PCR结果也显示,与对照组相比,模型组α-SMA,col1和col3 mRNA水平明显升高(P<0.01);与模型组相比,NGN处理组α-SMA,col1和col3 mRNA明显降低(P<0.01,P<0.05,P<0.05),见Fig 6D。
2.7 NGN对MCD饮食诱导的小鼠肝脏纤维化相关蛋白的影响Western blot结果表明,与对照组相比,模型组小鼠肝脏α-SMA和col1蛋白表达水平明显升高(P<0.05);与模型组相比,NGN处理组小鼠肝脏α-SMA和col1蛋白表达水平明显降低(P<0.05),见Fig 7。
2.8 NGN对MCD饮食诱导的小鼠肝脏TGF-β1/smad通路蛋白的影响Western blot结果表明,与对照组相比,模型组p-smad2,p-smad3 和TGF-β1蛋白表达水平明显升高(P<0.05);与模型组相比,NGN处理组小鼠肝脏p-smad2,p-smad3和TGF-β1蛋白表达明显降低(P<0.05),见Fig 8。

Fig 7 Effects of naringenin on protein expression of col1 and α-SMA in mice induced by MCD *P<0.05 vs control group;#P<0.05 vs MCD group
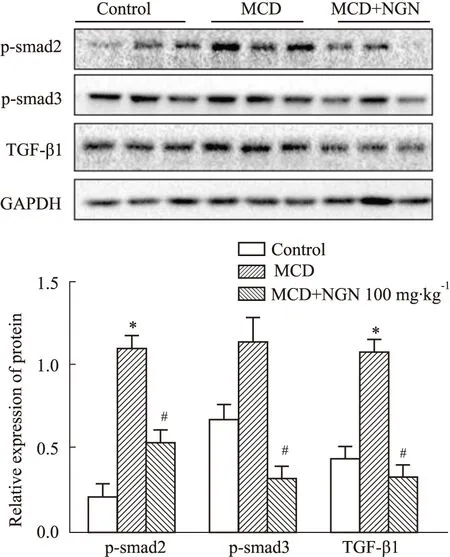
Fig 8 Effects of naringenin on activation of TGF-β1/smad pathway in mice induced by MCD *P<0.05 vs control group;#P<0.05 vs MCD group
3 讨论
肝纤维化是肝脏受到多种肝损伤因素刺激后的一种病理改变,其特征主要是细胞外基质的蓄积[1]。若肝损伤是急性、暂时的,纤维化可逐渐被吸收而恢复成为正常的肝脏结构;但若损伤是慢性、持续的,细胞外基质则会持续积累,部分纤维化会形成瘢痕组织代替肝实质,造成不可逆的肝纤维化,最终可发展为肝硬化、肝衰竭甚至肝癌[11]。在应激条件下,肝星状细胞可由静息状态激活为活化状态,转化为肌成纤维细胞,具有增殖的特性同时合成和分泌细胞外基质(胶原蛋白、纤维连接蛋白等)和细胞因子(转化生长因子-β)[12]。
肝纤维化造模方法包括:化学性损伤[13]、代谢障碍[14]等导致的肝纤维化。化学性损伤如CCL4所致的肝纤维化具有周期短、易操作的特点,但是死亡率高,且化学性损伤所导致的肝纤维化不是临床肝纤维化病人常见的诱发因素[15]。目前代谢障碍导致的肝纤维化在临床中的发病率逐年升高[16],MCD饲料诱导的肝纤维化是代谢性肝纤维化常见的模型。本研究采用MCD饲料喂饲小鼠6周诱导肝纤维化[17],研究NGN抑制肝纤维化的作用与机制,为临床上治疗代谢性肝纤维化提供新的思路。
在本研究中,HE染色和天狼猩红染色结果显示,NGN明显降低了MCD饲料诱导的肝脏纤维化的程度;与MCD饲料造模组相比,实时荧光定量结果显示NGN明显降低纤维化相关基因(a-SMA,col1,col3)的mRNA表达;Western blot对a-SMA和col1的蛋白检测结果显示,与造模组相相比,NGN明显下调该两种蛋白的表达。同样,在人肝星状细胞LX2中,与TGF-β1诱导的模型组相比,NGN低剂量处理组col1和col3 mRNA表达未出现明显差异,NGN高剂量处理组col3和col1 mRNA表达明显降低。此外,200 μmol·L-1NGN明显下调TGF-β1诱导LX2细胞a-SMA蛋白的表达。以上的结果显示,NGN可以剂量依赖性的抑制TGF-β1诱导的LX2细胞纤维化和蛋氨酸、胆碱缺乏饮食诱导的小鼠肝纤维化。
有研究表明TGF-β1/smad3通路参与了纤维化发生、发展。TGF-β1与膜受体结合后,激活smad2和smad3,促使smad2/smad3/smad4复合体形成,随后该复合体转移到细胞核中,促使col1、col3等基因的转录[18]。在本研究中,与MCD饲料造模组相比,NGN处理明显抑制了小鼠肝脏组织中TGF-β1、p-smad2、p-smad3蛋白的表达;此外,在LX2细胞中,NGN处理也同样明显抑制了TGF-β1诱导的TGF-β1、p-smad3蛋白的表达。以上的结果显示,NGN明显抑制了TGF-β/smad通路的激活。
综上所述,NGN对肝脏纤维化具有抑制作用,机制与其抑制TGF-β/smad通路激活有关。