盐胁迫对间歇增氧垂直流人工湿地脱氮性能及微生物群落影响❋
宋利国, 宋维星, 王宜东, 周衍平, 洪 波, 季军远❋❋
(1. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100;2. 中国海洋大学山东省海洋环境地质工程重点实验室, 山东 青岛 266100;3. 山东高速服务开发集团有限公司, 山东 济南 250000)
人工湿地属于生态水处理系统,主要通过微生物的硝化反硝化以及植物吸收作用实现废水脱氮[1]。微生物硝化过程需要氧气作为电子受体,人工湿地中的氧气主要来源于大气自然复氧、水体更新复氧和植物根系泌氧[2],而三者提供的氧气含量有限,使得硝化反应进程受限。虽然垂直潜流人工湿地比水平潜流人工湿地氧气传输速率更高,但仍无法满足湿地脱氮过程中对氧气的需求,对TN的去除率也仅为30%~40%左右[3],极大限制了其在废水脱氮领域的推广及工程应用[4]。湿地植物对废水中氮污染物的去除主要通过根系吸收作用,传统垂直流人工湿地中植物根系多呈分散生长,与废水接触面积有限,这直接影响植物吸收氮污染物的效果。
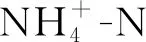

1 材料与方法
1.1 试验装置
新型间歇增氧垂直流人工湿地见图1。湿地为有机玻璃制成的圆柱体,内径30 cm,高80 cm。距底部45 cm处设有法兰和密封盖板。将湿地分为上下两部分,下部自下而上依次填充粒径30~50 mm的粗砾石(高度10 cm)、粒径10~20 mm的细砾石(高度15 cm)、粒径5~10 mm的煤渣(高度20 cm);湿地上部由同心多孔圆环板分成三个区域,最内为内径5 cm的曝气区,底部开口与湿地下部贯通,放置曝气头进行人工曝气,由气体流量计控制曝气流量,继电器控制曝气泵启闭,向外为沙土降解区,由内径14、19和26 cm三层挡板构成,填充粒径1~3 mm沙土(高度25 cm),湿地植物芦苇种植在内径14和19 cm挡板组成的圆环区域内,目的是限制根系发散生长,形成根系屏障墙,充分发挥根系吸收作用和泌氧能力,促进氮污染物去除;最外侧为出水区,废水经湿地处理后由出水口排出。
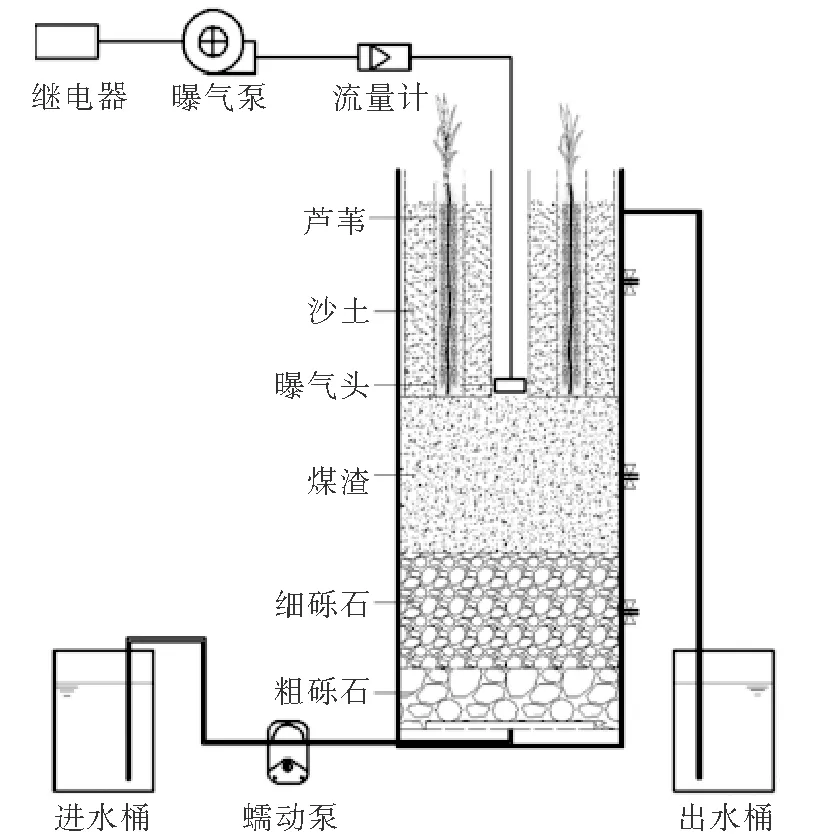
图1 间歇增氧垂直流人工湿地系统
1.2 试验废水
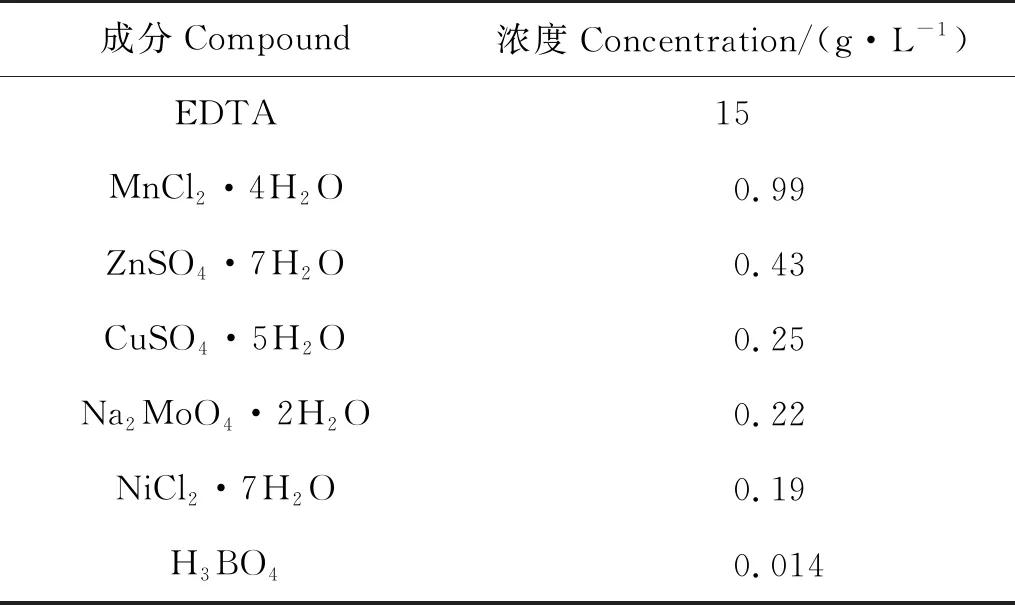
表1 微量元素溶液组成成分
1.3 湿地系统运行
湿地系统采用连续进水方式,由湿地底部进水,上部出水,进水流量为10 L/d,HRT设定为48 h,间歇曝气过程采用前期试验所获取的最优曝气参数,即曝气量2 m3/h、曝停周期6 h、曝停比0.25。继电器控制曝气泵启闭。
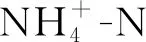
1.4 分析指标及测定方法
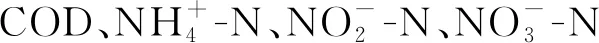
PCR扩增及高通量测序:将对人工湿地定点取样后,采用Power Soil DNA Isolation Kit,按照操作提取样品中DNA,使用1%(质量分数)的琼脂糖凝胶电泳检测DNA浓度和质量。采用细菌16S rRNA基因V3+V4扩增区域,引物为341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC),对DNA进行PCR扩增,扩增体系及扩增条件按文献[12]方法进行。PCR扩增产物使用OMEGA胶回收纯化试剂盒纯化后4 ℃保存。最后交由基质取样后进行超声、离心预处理,预处理后的样本交由北京诺禾致源生物信息科技有限公司进行DNA提取和测序。利用Illumina HiSeq高通量测序技术在HiSeq 2500系统进行测序。
2 结果与讨论
2.1 盐度对人工湿地中污染物去除性能影响
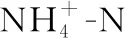
表2 不同盐度和进水浓度下各污染物去除情况

图2 盐度对出水浓度(a)和去除率(b)的影响
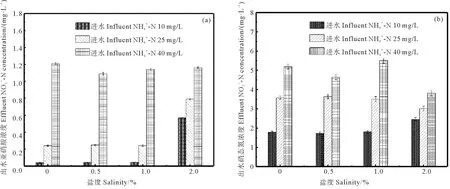
图3 盐度对和出水浓度的影响
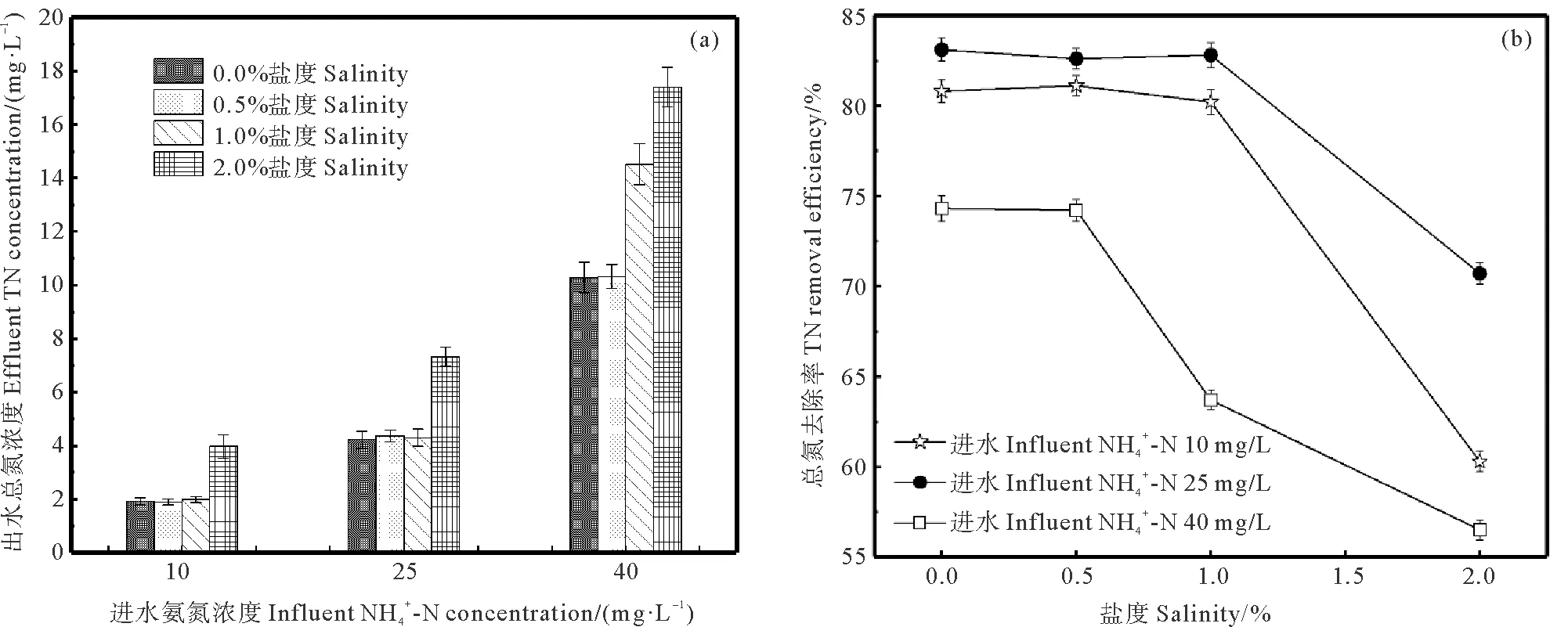
图4 盐度对TN出水浓度(a)和去除率(b)的影响
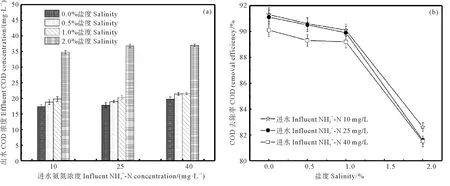
图5 盐度对出水COD浓度(a)和去除率(b)的影响
2.2 盐度对人工湿地微生物群落影响
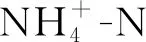
2.2.1 生物样品测序结果与深度验证 8个样品经过测序后,得到的有效序列数平均为59 101个。按97%的一致性将序列聚类为OTUs,共得到1 915个OTUs,将得到的OTUs序列与Sliva数据库进行物种的比较注释,共有1 482个可以注释到属水平。稀释曲线可以直观反映测序数据的准确性并在一定程度上间接反映物种多样性,样品的稀释曲线见图6。由图6可知,样品的测序量均在40 000后已经趋于平缓,更多的测序量仅产生少量的OTUs,说明数据合理,测序深度足以包含样本中绝大部分的微生物物种。提高盐度以后的CW2-P1、CW2-P2、CW3-P1、CW3-P2、CW4-P1和CW4-P2样本稀释曲线对应的OTUs均较无盐工况(CW1-P1、CW1-P2)大,说明各盐度下物种多样性均有所提高。
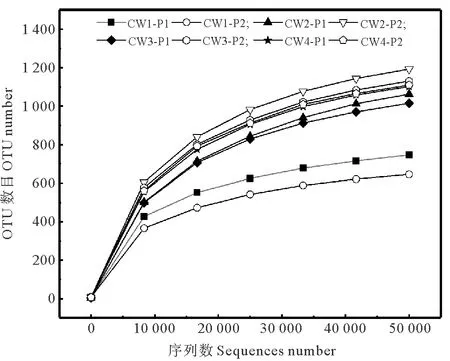
图6 微生物样品稀释曲线
2.2.2 盐度对微生物丰富度和多样性影响 ACE指数和Chao1指数、Simpson指数和Shannon指数可分别表征微生物群落丰富度与多样性,ACE、Chao1指数数值越高,代表物种丰富度越高,Simpson和Shannon指数数值越高,代表物种多样性越高。生物样品多样性分析结果见表3,从表3中可知,8个生物样品物种覆盖率(Coverage)均高于99.5%,表明基质样品中绝大多数物种均涵盖在高通量测序中,测序结果可准确完整地反映湿地微生物样品的真实情况。
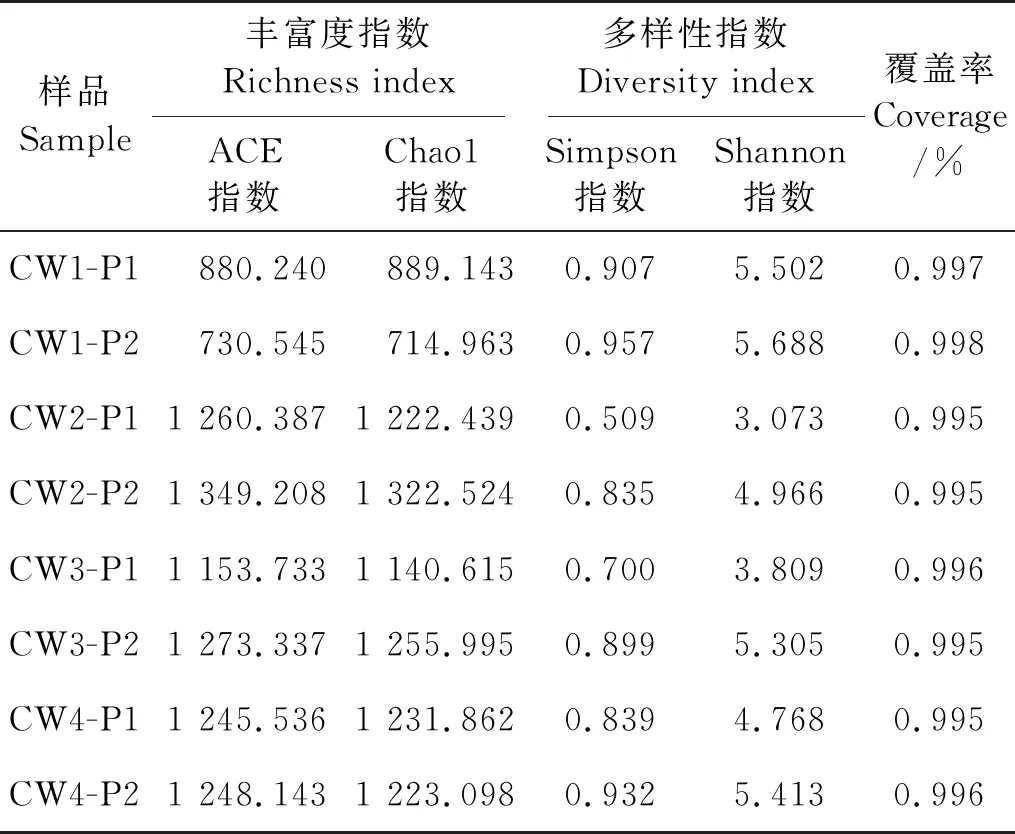
表3 微生物样品的Alpha多样性指数分析
由表3分析得出,8个基质样品中,0.5%盐度(CW2-P1、CW2-P2)、1.0%盐度(CW3-P1、CW3-P2)、2.0% 盐度(CW4-P1、CW4-P2)下样品微生物的ACE指数、Chao1指数均高于无盐(CW1-P1、CW1-P2)下样品微生物的ACE指数、Chao1指数,各盐度下样品中微生物的物种总数、菌落丰富度均较无盐下显著增大。湿地植物沙土区(P1)的4个样品(CW1、CW2、CW3、CW4)微生物的ACE指数、Chao1指数以0.5%盐度下(CW2)为最高,分别为1 260.387、1 222.439;曝气底部填料区(P2)的4个样品(CW1、CW2、CW3、CW4)微生物的ACE指数、Chao1指数以0.5%盐度下(CW2)为最高,分别为1 349.208、1 322.524,0.5% 盐度下样品微生物的菌落丰富度最高。各盐度下曝气底部填料区样品微生物的ACE均高于湿地植物沙土区,但随盐度增加,ACE指数差异减小,曝气底部填料区微生物丰富度较湿地植物沙土区更高。
8个基质样品中,0.5%、1.0%和2.0%盐度下样品微生物的Simpson指数、Shannon指数均低于无盐工况,两个指数的最低值均出现在0.5%盐度下,随盐度提升,Simpson指数、Shannon指数均逐步增大。无盐工况下样品微生物的多样性指数最高,初期过渡到盐环境下微生物的多样性呈剧烈变化,且出现大幅降低,但此盐度(0.5%盐度)下微生物的均匀度最高;随微生物对盐度的逐步适应,微生物多样性又恢复至无盐工况水平,表明盐度对人工湿地系统微生物菌群分布及其多样性产生了显著影响。各盐度下曝气底部填料区样品微生物的Simpson指数、Shannon指数均高于湿地植物沙土区样品,但随盐度增加,两者之间Simpson指数、Shannon指数差异均缩小,0.5% 盐度下两者的Simpson指数、Shannon指数的差异最大,随盐度提升,两者的微生物多样性均有所增加,且两者差异逐步减小。
2.2.3 盐度对微生物群落结构的影响 为探究盐度对人工湿地内微生物群落结构影响,在物种门、纲、属不同水平上进行分类,结果见图7。

图7 微生物不同水平分布
从图7可见,不同盐度的8个基质样品(CW1-P1、CW1-P2、CW2-P1、CW2-P2、CW3-P1、CW3-P2、CW4-P1、CW4-P2)优势细菌群落在门类水平上达到8门以上(见图7A),其中以变形菌门(Proteobacteria)、蓝细菌(Cyanobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)为主,在总序列中的占比为96.1%,其中对氮污染物去除占主要作用的为变形菌门,变形菌属于革兰氏阴性菌,多为兼性或专性厌氧菌,是COD去除和脱氮过程的重要贡献者[25],其在P1(湿地植物沙土区)的4个基质样品中的平均丰度为86.7%,在P2(曝气底部填料区)的4个基质样品中的平均丰度为85.9%,说明湿地植物区更利于变形菌门生长繁殖。同时由图7A可见,8个基质样品中变形菌门在盐度的变化下丰度保持相对稳定,说明其具有一定的耐盐性。在纲类水平上(见图7B),优势菌群以γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、厌氧绳菌纲(Anaerolineae)为主,其中γ-变形菌纲作为典型的氨氧化细菌[26],在8个基质样品中的平均丰度为80.4%,且在湿地植物沙土区中的相对丰度(81.0%)同样略高于曝气底部填料区(79.8%)。在属水平上(见图7C),样品中微生物优势菌群有铁氧化菌属(Ferritrophicum)、硫发菌属(Thiothrix)等,另有大部分属于不可培养细菌(Others),也为进一步湿地中微生物资源的开发利用提供方向。
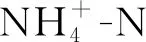
在盐胁迫下一些非脱氮菌属也发生了丰度变化。Ferritrophicum参与铁氧化过程,对铁及碳、氮、磷等元素的生物地球化学循环具有重要意义,在各个盐度下均占据优势地位。Thiothrix作为菌胶团附着的载体,在无盐度下丰度低于10%,在0.5%盐度下丰度大幅提高至71%,使样品中微生物丰富度显著提升;随着盐度继续提升,该菌丰度有所下降,但仍维持在50%左右,表明盐胁迫会促进硫发菌属生长繁殖。从图7C中可得出,CW1-P2菌种分布最为均匀,而表3中CW1-P2也具有最大的Simpson和Shannon指数,证实此盐度下的微生物多样性最大,而CW2-P1中的Thiothrix占比高达71%,其他菌种总丰度不足30%,对应的表3中CW2-P1的Simpson和Shannon指数最小。
3 结论
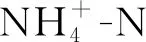
(2) 不同盐度、湿地不同区域(水生植物沙土区、曝气底部填料区)微生物的种群和相对丰度差别较大,0.5%、1.0%、2.0%盐度下湿地微生物丰富度均高于无盐工况,且0.5%盐度下微生物丰富度最高;各盐度下曝气底部填料区微生物丰富度均高于湿地植物沙土区;盐胁迫初期(0.5%盐度)湿地微生物多样性较无盐下显著降低,但随着对盐胁迫环境的逐步适应,微生物多样性初步恢复并接近无盐工况水平。盐度对人工湿地系统微生物菌群分布及其多样性产生了显著影响。
(3) 微生物在门分类水平上是以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)为共有的优势菌门,在纲分类水平上以γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、厌氧绳菌纲(Anaerolineae)为主。属分类水平上,随着盐度由0.0%提升至2.0%,氨氧化细菌(Nitrosomonas)、亚硝酸盐氧化细菌(Nitrospiraceae)平均丰度均降低,分别由2.5%、1.7%降至0.5%、0.3%,表明其对盐度的耐受能力较差;具有反硝化功能的Thiobacillus和Denitratisoma平均丰度较高(分别为11.6%、5.4%)且保持相对稳定,表明其对盐胁迫具有较好的耐受性。

