基于mTOR/Beclin1通路探讨血竭散对克罗恩病大鼠结肠组织自噬和炎症小体的影响
洪寅雯,文 科,吴本升,徐治中,杜 骏,高 莹,孙薛亮
(1.苏州市中西医结合医院,江苏 苏州 215000;2.南京中医药大学附属苏州市中医医院,江苏 苏州 215000)
克罗恩病是累及全消化道的慢性、难治性、非特异性肠道炎症性疾病,在中国发病率呈急剧上升趋势。透壁性炎症是克罗恩病的主要病理特征,可导致多种致残性并发症,如肠管狭窄、肠梗阻、肠穿孔和复杂性肛瘘。尽管多种生物制剂,如英夫利西单抗、乌司奴单抗和维得利珠单抗能实现克罗恩病无激素缓解和肠黏膜愈合,但仅有部分患者获益,有相当比例的患者原发性无应答或继发性失应答[1-3]。探寻克罗恩病的病因病机及有效治疗药物是重要的研究方向。现有研究[4]表明,克罗恩病肠道病变主要位于肠系膜侧,并且系膜血管增生影像学上呈现梳状征。克罗恩病患者血液循环呈高凝状态,血栓栓塞风险显著增加[5]。由此可见,中医理论体系中的血络学说在克罗恩病发病机制中发挥重要作用。国医大师徐景藩认为,瘀血是炎症性肠病的重要致病因素[6]。课题组前期基于吴门医派络病理论“初为气结在经,久则血伤入络”“久病必有瘀”,以及《医林改错》记载的治法“治泄泻病日久不愈,作瘀血治”“百药无效,活血一法”,建立活血通络治则治法,运用宋代朱端章《卫生家宝产科备要》中血竭散(血竭、没药各6 g)治疗克罗恩病,取得较好临床疗效,但作用机制尚不明确。近年研究[7-9]发现,肠黏膜组织中细胞自噬和炎症小体过度活化与克罗恩病发病密切相关,抑制自噬和炎症小体可减轻克罗恩病肠道炎症反应。本研究通过建立克罗恩病大鼠模型,观察血竭散对大鼠结肠炎的治疗作用及其对哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/Beclin1通路介导的自噬和NOD样受体家族含pyrin结构域蛋白3(NOD-like receptor family pyrin domain containing 3,NLRP3)、黑素瘤缺乏因子2(absent in melanoma 2,AIM2)炎症小体的影响,为治疗克罗恩病提供科学依据。
1 材料
1.1 动物 36只SPF级健康雄性SD大鼠,体质量(200±20)g,购自南京中医药大学,动物生产许可证号:SCXK(苏)2018-0049。实验前大鼠于标准实验条件[保持通风,室温(24±2)℃,相对湿度(50±5)%,每12 h进行一次亮/暗循环]下适应性喂养1周,混合饲料喂养,自由进食和饮水。动物实验经苏州市中医医院伦理委员会审查批准(批准号:2020伦动批021)。
1.2 主要试剂和仪器 血竭(产地云南,批号 200406003)、没药(产地广西,批号 200601003):苏州市天灵中药饮片有限公司,所有药物经苏州市中医医院药学部沈多荣副主任药师鉴定符合《中华人民共和国药典》标准;柳氮磺砒啶(sulfasalazine,SASP;批号 20150608,每片0.25 g):上海三维制药有限公司;2,4,6-三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS;P2297)和Trizol试剂盒(T9424):美国Sigma公司;白细胞介素-1β(interleukin-1β, IL-1β)试剂盒(PI303)、IL-18试剂盒(PI553)和肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)试剂盒(PT516):上海碧云天生物技术有限公司;mTOR抗体(ab134903)、p-mTOR抗体(ab278621)、Beclin1抗体(ab207612)、微管相关蛋白轻链3β(microtubule-associated protein light chain 3 beta,LC3B)抗体(ab192890)、NLRP3抗体(ab263899)、AIM2抗体(ab119791)、含Caspase募集结构域的凋亡相关斑点样蛋白(apoptosis-associated space-like protein containing a Caspase recruitment domain,ASC)抗体(ab180799)、Caspase 1抗体(ab138483):美国Abcam公司;SYBR Green实时荧光定量试剂盒(740703)和逆转录试剂盒(RR037B):日本Takara公司。光学显微镜(BX45A):日本Olympus公司;全自动酶标仪(WD-2102A)和凝胶成像分析系统(WD-9413B):北京六一生物科技有限公司;荧光定量PCR仪(Bio-Rad CFX96):美国伯乐公司。
2 方法
2.1 药物制备 采用乙醇提取血竭散有效成分。具体方法如下:血竭、没药研末后,经95%乙醇加热回流2 h,重复进行2次,合并提取液,水浴挥干溶剂,以二甲基亚砜助溶得到浓度为200 mg/mL的溶液,流通蒸汽灭菌30 min,常温保存待用。计算提取液与生药换算比。
2.2 动物分组和模型复制 将36只大鼠随机分为空白组,模型组,血竭散低、中、高剂量组和SASP组,每组6只。参照文献[10]方法建立TNBS诱导的克罗恩病大鼠模型。具体方法如下:大鼠禁食、不禁水24 h后,10%戊巴比妥钠40 mg/kg腹腔注射麻醉,通过3.5 F导管将0.25 mL TNBS与50%乙醇的混合溶液注入距肛缘4 cm结肠内,给药后将大鼠倒置60 s,避免药液流出。每周重复1次,持续6周。TNBS剂量逐周递增:第1周15 mg,第2周30 mg,第3周45 mg,第4、第5和第6周分别60 mg。空白组同时间点予等容积生理盐水灌肠。
2.3 药物干预 空白组和模型组每日分别给予生理盐水灌胃;血竭散低、中、高剂量组根据临床用量换算,每日分别给予0.63、1.26、2.52 g/kg血竭散灌胃;SASP组每日给予0.5 g/kg SASP灌胃。与模型复制过程同时进行,连续给药40 d。
2.4 标本采集 40 d后,大鼠禁食不禁水24 h,使用CO2处死大鼠后立即剖腹,取出全结肠并解剖,立即用4 ℃生理盐水快速漂洗,距肛缘3、5 cm处各剪取长约1 cm肠管,迅速置于-80 ℃冰箱内保存备检测。
2.5 苏木精-伊红(hematoxylin-eosin,HE)染色法观察结肠组织病理学改变 PBS洗涤结肠组织,乙醇脱水,二甲苯清洗,石蜡包埋,切取5 μm切片,HE染色,光学显微镜下观察。组织病理学评分标准[11]:仅为结构改变(0分);可见慢性炎症(1分);固有层见中性粒细胞浸润(2分);上皮层见中性粒细胞浸润(3分);隐窝结构破坏(4分);见糜烂或溃疡(5分)。
2.6 酶联免疫吸附法检测结肠组织中炎症细胞因子IL-1β、IL-18和TNF-α表达水平 RIPA裂解液裂解组织匀浆,4 ℃,12 000 r/min离心20 min,收集上清液。将样品加入已包被的反应孔中,室温下孵育1.5 h。洗涤后,于各孔中加入酶标抗体,室温下孵育1 h。洗涤后,于各孔中加入TMB显色液,室温下孵育0.5 h后终止反应。用酶标仪测得各孔450 nm处光密度(optical density, OD)值,根据OD值计算相应浓度。
2.7 实时荧光定量PCR法检测结肠组织中Beclin1、NLRP3和AIM2 mRNA表达水平 根据试剂盒说明书,用Trizol试剂提取结肠组织总RNA,采用PrimeScript RT反转录合成cDNA,GAPDH作为内参基因。以反转录合成的cDNA为模板,按照RT-PCR试剂盒说明书进行扩增,再用SYBR Green试剂完成荧光定量PCR反应,根据标准曲线和CT值计算Beclin1、NLRP3和AIM2相对表达水平,用2-ΔΔCT表示。引物序列见表1。

表1 实时荧光定量PCR引物序列
2.8 免疫荧光法检测结肠组织中LC3B表达水平 将大鼠结肠组织在10%中性甲醛溶液中固定24 h,石蜡包埋,连续切成5 μm切片。样本脱蜡,再水合,用1%牛血清白蛋白孵育,随后浸泡在H2O2中淬火。加入一抗,4 ℃下孵育12 h。再加入二抗,室温下孵育1 h。DAPI进行反染色,在倒置荧光显微镜下观察并捕获荧光细胞。
2.9 蛋白免疫印迹法检测结肠组织中mTOR、p-mTOR、Beclin1、NLRP3、AIM2、ASC和Caspase-1蛋白表达水平 用含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液裂解组织匀浆,4 ℃,12 000 r/min离心20 min。收集上清液,用BCA法测定并调整蛋白浓度,使各组一致。SDS-PAGE凝胶电泳分离蛋白,转移至PVDF膜上,置于5%牛奶溶液中室温下封闭1.5 h,然后用TBST漂洗3次,加入一抗,4 ℃孵育过夜。TBST漂洗3次,加入辣根过氧化物酶标记的二抗,室温下孵育1 h后用TBST漂洗3次,显影,使用ECL-plus检测系统使蛋白印迹可视化,用灰度分析软件对信号强度进行量化,以GAPDH蛋白作为内参。
3 结果
3.1 血竭散对克罗恩病大鼠结肠黏膜组织形态的影响 模型组大鼠结肠黏膜上皮损伤,隐窝减少,固有层见炎症细胞浸润,病理学评分显著高于空白组(P<0.05),提示模型复制成功。血竭散及SASP干预后,结肠黏膜上皮损伤减轻,隐窝数量增加,浸润的炎症细胞显著减少;与模型组比较,血竭散各剂量组及SASP组结肠病理学评分显著降低(P<0.05)。见图1和表2。
表2 各组大鼠结肠组织病理学评分
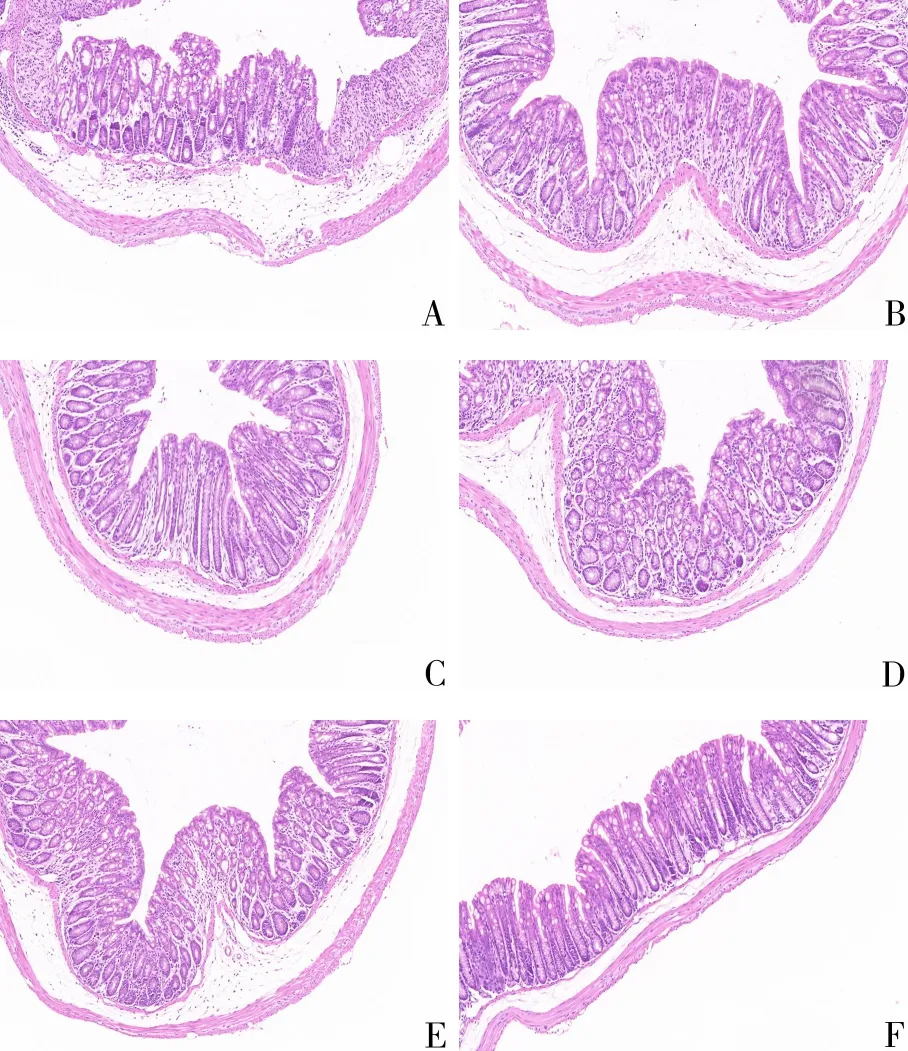
注:A.模型组;B.血竭散低剂量组;C.血竭散中剂量组;D.血竭散高剂量组;E.SASP组;F.空白组
3.2 血竭散对克罗恩病大鼠结肠组织中IL-1β、IL-18和TNF-α表达水平的影响 与空白组比较,模型组大鼠结肠组织中IL-1β、IL-18和TNF-α水平均显著增加(P<0.05)。与模型组比较,血竭散各剂量组及SASP组大鼠结肠组织中IL-1β、IL-18和TNF-α浓度显著降低(P<0.05),血竭散的效应呈剂量依赖性。见表3。
表3 各组大鼠结肠组织中IL-1β、IL-18和TNF-α表达水平比较
3.3 血竭散对克罗恩病大鼠结肠组织中Beclin1、NLRP3和AIM2 mRNA表达水平的影响 与空白组比较,模型组大鼠结肠组织中Beclin1、NLRP3和AIM2 mRNA表达水平均显著增加(P<0.05)。与模型组比较,血竭散各剂量组及SASP组大鼠结肠组织中Beclin1、NLRP3和AIM2 mRNA表达水平均显著降低(P<0.05),血竭散的效应呈剂量依赖性。见表4。
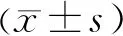
表4 各组大鼠结肠组织中Beclin1、NLRP3和AIM2 mRNA表达水平比较
3.4 血竭散对克罗恩病大鼠结肠组织中炎症小体相关蛋白NLRP3、AIM2、ASC和Caspase-1表达水平的影响 与空白组比较,模型组大鼠结肠组织中NLRP3、AIM2、ASC和Caspase-1表达水平均显著增加(P<0.05)。与模型组比较,血竭散各剂量组及SASP组大鼠结肠组织中NLRP3、AIM2、ASC和Caspase-1表达水平均显著降低(P<0.05),血竭散的效应呈剂量依赖性。与血竭散中剂量组比较,SASP组NLRP3、AIM2、ASC和Caspase-1蛋白表达水平均无明显变化(P>0.05)。见图2和表5。
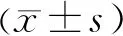
表5 各组大鼠结肠组织中NLRP3、AIM2、ASC和Caspase-1蛋白相对表达水平比较

注:A.模型组;B.血竭散低剂量组;C.血竭散中剂量组;D.血竭散高剂量组;E.SASP组;F.空白组
3.5 血竭散对克罗恩病大鼠结肠组织中自噬相关蛋白mTOR、p-mTOR、Beclin1和LC3B表达的影响 免疫荧光染色显示模型组大鼠结肠组织中LC3B表达水平较空白组显著增加(P<0.05),表现为红色荧光;血竭散和SASP干预后LC3B表达水平显著降低(P<0.05),血竭散的效应呈剂量依赖性。见图3和表6。蛋白免疫印迹法检测结果显示,模型组、血竭散各剂量组及SASP组大鼠结肠组织中mTOR表达水平与空白组比较,差异无统计学意义(P>0.05);模型组p-mTOR表达水平显著降低,Beclin1表达水平显著增加(P<0.05)。与模型组比较,血竭散各剂量组及SASP组p-mTOR表达水平显著升高(P<0.05),Beclin1表达水平显著降低(P<0.05),血竭散的效应呈剂量依赖性。见图4和表6。

表6 各组大鼠结肠组织中LC3B、mTOR、p-mTOR和Beclin1蛋白相对表达水平比较
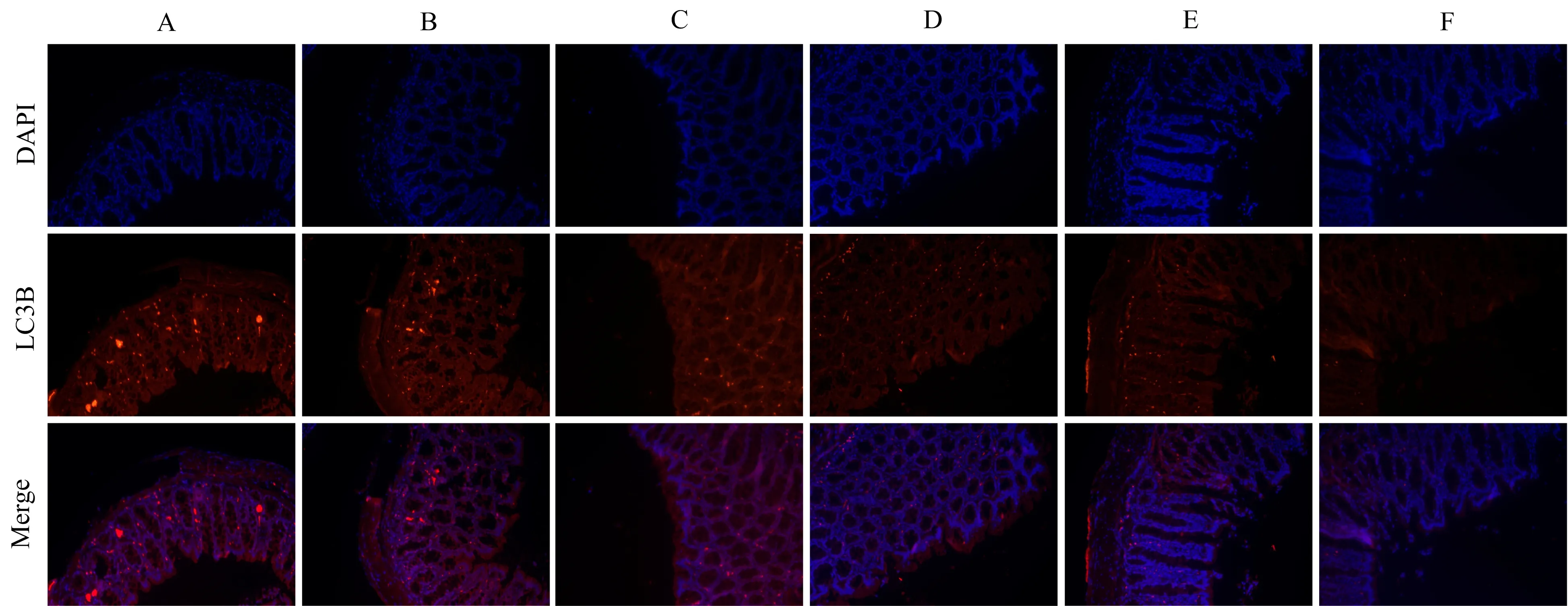
注:A.模型组;B.血竭散低剂量组;C.血竭散中剂量组;D.血竭散高剂量组;E.SASP组;F.空白组

注:A.模型组;B.血竭散低剂量组;C.血竭散中剂量组;D.血竭散高剂量组;E.SASP组;F.空白组
4 讨论
抗TNF-α制剂的问世,使克罗恩病肠黏膜愈合得以实现。然而,以IL-12/IL-23为靶点的乌司奴单抗、整合素α4β7为靶点的维得利珠单抗的出现,表明单一靶点难以治愈克罗恩病。越来越多的炎症性肠病患者寻求中医药的治疗[12]。活血通络法治疗炎症性肠病既活血通络,又化瘀止血,达到活血不伤血、止血不留瘀的治疗目标[13]。血竭具有活血化瘀、定痛止血、敛疮生肌等功效,被誉为“活血之圣药”,能很好地实现上述治疗目标。因而,中华中医药学会脾胃病分会推荐血竭治疗炎症性肠病[14]。本研究结果显示,以血竭为君药的血竭散能减轻克罗恩病大鼠结肠组织损伤,抑制促炎细胞因子IL-1β、IL-18和TNF-α表达,从分子生物学角度明确其缓解克罗恩病肠炎的作用。
IL-1β和IL-18的表达与炎症小体活化密切相关。炎症小体是固有免疫的重要组成部分,可保护机体免受内外部致病因素的入侵。然而,过度活化的炎症小体与多种自身炎症性疾病相关。活动性克罗恩病患者结肠黏膜中NLRP3和AIM2炎症小体表达水平显著增加[8-9]。NLRP3通过识别病原体或损伤相关分子模式,而AIM2通过识别细胞质双链DNA活化,与ASC和Caspase-1结合,形成炎症小体,分泌IL-1β和IL-18。在TNBS或葡聚糖硫酸钠诱导的急性结肠炎模型中,NLRP3炎症小体通过分泌IL-18,修复损伤的结肠上皮组织,维持肠黏膜屏障的完整性,降低通透性,抑制结肠炎;同样,AIM2炎症小体通过调控肠上皮细胞产生抗菌肽,维持肠道菌群稳态,阻止结肠组织损伤,抑制炎症反应[15-16]。然而,慢性结肠炎模型中,NLRP3和AIM2炎症小体过度活化,分泌过多的IL-1β和IL-18,强化肠黏膜炎症反应[17-18]。抑制NLRP3和AIM2炎症小体活化,是克罗恩病的潜在治疗策略。本研究结果显示,TNBS诱导的慢性结肠炎模型中,NLRP3、AIM2、ASC和Caspase-1表达水平增加,分泌过多的IL-1β和IL-18。血竭散干预能下调NLRP3、AIM2、ASC和Caspase-1表达水平,抑制炎症小体过度活化。
Feng等[19]研究发现,mTOR/Beclin1信号通路调控的自噬活化能激活NLRP3炎症小体,破坏肠上皮细胞屏障功能。自噬是一种分解代谢细胞过程。自噬体与溶酶体融合形成自噬溶酶体,降解细胞内病原体、长寿蛋白质和受损的细胞器。自噬失调在炎症性肠病发病机制中发挥重要作用。全基因组关联研究结果显示,自噬相关基因ATG16L1和IRGM突变与克罗恩病的发病密切相关[20]。当肠上皮细胞内自噬缺陷时,入侵的病原体清除减少,致使肠道菌群和Th17/Treg比例失调,激活免疫应答,诱发肠道炎症反应[21]。然而,持续的炎症刺激可使炎症性肠病患者肠上皮细胞内自噬过度活化,加重肠道炎症[22]。Zhang等[23]研究发现,与轻度溃疡性结肠炎患者和健康人群比较,中重度患者肠上皮细胞内可观察到更多的自噬体,并且自噬水平的增加与疾病严重度呈正相关。抑制过度活化的自噬能改善克罗恩病小鼠结肠炎[7,23-24]。MTOR和Beclin1是自噬的经典调控基因,前者通过磷酸化UNC-51样激酶1抑制自噬启动;而后者与Ⅲ型磷脂酰肌醇3-激酶构成复合体,启动自噬体形成。本研究结果显示,TNBS诱导建立克罗恩病慢性结肠炎模型后,大鼠结肠组织中p-mTOR表达水平降低,Beclin1和LC3B表达水平增加,自噬水平升高。血竭散干预后能逆转p-mTOR、Beclin1和LC3B表达水平,抑制大鼠结肠组织中过度活化的自噬。
综上所述,血竭散可能通过调控mTOR/Beclin1信号通路,抑制自噬和NLRP3、AIM2炎症小体过度活化,减少促炎细胞因子分泌,缓解克罗恩病大鼠结肠炎。

