六味地黄汤通过树突状细胞Notch信号通路调节T细胞分化干预自身免疫性脑脊髓炎
丁月文,钱庭霖,刘祝贺,汪鸿浩
(1. 南方医科大学中医药学院, 广东 广州 510515;2. 南方医科大学第一临床医学院,广东 广州 510515;3. 南方医科大学南方医院,广东 广州 510515)
多发性硬化是一种中枢神经系统自身免疫性脱髓鞘疾病,其临床病程多见急性复发和症状缓解交替。目前,临床常用的激素等药物对多发性硬化的疗效欠佳,且有一定的不良反应。中医药在免疫性疾病的治疗上有独特的优势,研究[1-2]发现,补肾类中药对多发性硬化的疗效显著,其作用机制可能与调节免疫,特别是调节CD4+T细胞亚群分化相关[2]。
实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型是研究多发性硬化的经典动物模型,以髓鞘少突胶质细胞糖蛋白多肽35-55(myelin oligodendrocyte glycoprotein 35-55,MOG35-55) 诱导免疫C57BL/6小鼠可以模拟多发性硬化的急性期炎症反应。树突状细胞(dendritic cells,DCs)是体内最重要的抗原呈递细胞(antigen presenting cells,APCs),其通过细胞表面分子以及分泌细胞因子的变化,调节抗原特异性T细胞分化,进而引起不同的免疫应答。关于多发性硬化发病机制的“分子模拟假说”认为,病原微生物抗原和髓鞘成分的交叉反应是多发性硬化发病的重要因素[3]。病原微生物入侵人体后,DCs摄取抗原,使其成为具有免疫原性的多肽,与主要组织相容复合体结合后,刺激并活化初始CD4+T细胞,其中,Notch信号通路介导了初始CD4+T细胞向导致髓鞘炎症的效应性T细胞分化,引起针对髓鞘特异性蛋白的交叉免疫反应损伤[4]。
本研究旨在前期研究基础上,从DCs调节T细胞免疫角度,进一步探讨多发性硬化患者CD4+T细胞免疫活化的调节因素,及“补肾生髓”法调节DCs干预多发性硬化发病的潜在机制,为临床运用“补肾生髓”法治疗多发性硬化提供实验依据。
1 材料
1.1 实验动物 SPF级C57BL/6(C57)雌性小鼠及SPF级雌性Sprague Dawley(SD)大鼠由南方医科大学实验动物中心[动物生产许可证号:SCXK(粤)2016-0041]提供,6~8周龄,2D2小鼠购自美国Jackson实验室,分笼饲养于南方医科大学南方医院实验动物中心,室内温度20~25 ℃,给予标准饲料,自由饮水,标准光照和黑暗节律为12 h/12 h。
1.2 药物、试剂和仪器 六味地黄汤(熟地黄24 g,山茱萸、山药各12 g,泽泻、牡丹皮、茯苓各9 g)按常规方法煎煮,委托南方医科大学南方医院制剂室进行加工,收集滤液,用文火浓缩,制成2 g/mL的水提物,-20 ℃保存备用。MOG35-55(氨基酸序列为MEVGWYRSPFSRVVHLYRNGK):上海吉尔生化公司;RPMI 1640、胎牛血清(fetal bovine serum,FBS)、磷酸盐缓冲盐溶液(phosphate buffer solution,PBS)、L-谷氨酰胺、丙酮酸钠、非必需氨基酸及双抗:Gibco公司;重组小鼠粒细胞-集落刺激因子(granulocyte-colony stimulating factor,GM-CSF)、白细胞介素-4(interleukin-4, IL-4):翘义神州公司;脂多糖(lipopolysaccharide,LPS)、γ分泌酶抑制剂(gamma-secretase inhibitor,GSI):Sigma公司;可固定活性染料450:Thermo Fisher公司;抗-CD3e(APC-CY7)、抗-CD4(BV510)、抗-CD8a(PerCP-Cy5.5)、抗-IL-17A(PE)、抗-Foxp3(Alexa Fluor 647)抗体:BD公司;CD4+T细胞磁珠分选试剂盒:Miltenyi Biotec公司;流式细胞仪:BD LSRFortessa X-20。
2 方法
2.1 含药血清的制备 取200 g雌性SD大鼠,以六味地黄汤(剂量40 g/kg)灌胃,共3 d,每日2次。分别于第3天第2次给药2 h后采血,离心,分离血清,采用0.22 μm微孔滤膜过滤除菌,制成含有10%血清的RPMI 1640,-20 ℃保存待用。
2.2 小鼠骨髓来源树突状细胞(bone marrow derived dendritic cells,BMDCs)的分离、培养及诱导 参考文献[5]的方法分离、培养BMDCs。取6~8周龄C57小鼠股骨和胫骨,剔除骨周围肌肉组织,用70%乙醇浸泡后,再用无菌PBS冲洗2次。将骨移入新培养皿中,用剪刀剪去骨两端,采用一次性注射器针头分别从骨两端插入骨髓腔,反复冲洗骨髓至培养皿中,直至骨完全变白。收集骨髓悬液,采用40 μm滤网过滤,获取单细胞悬液,1 200 r/min离心5 min,弃上清,裂解红细胞后,用含10% FBS的RPMI 1640培养液重悬细胞,将细胞数调整至1×106/mL,接种于12孔板中,每孔1.5 mL,同时加入重组小鼠GM-CSF(20 ng/mL)和IL-4(10 ng/mL),37 ℃、5% CO2孵箱中培养。第6天收集细胞,1 200 r/min离心5 min,弃上清,用含10% FBS的RPMI 1640培养液重悬细胞,并接种于12孔板中,加入重组小鼠GM-CSF(20 ng/mL)、IL-4(10 ng/mL)和LPS(1 μg/mL)。将BMDCs分成对照组、六味地黄汤含药血清组、GSI(20 μg/mL)组。继续培养3 d后,即可获得较成熟的BMDCs。
2.3 脾脏和淋巴结CD4+T细胞的纯化 参考文献[6]的方法分离脾脏和淋巴结的CD4+T细胞。采用MOG35-55免疫2D2小鼠,第7~10天收集小鼠脾脏和淋巴结,研磨后用40 μm滤网过滤,PBS重悬,制备单细胞悬液,1 200 r/min离心5 min,弃上清,裂解红细胞。磁珠分选CD4+T细胞,使用RPMI 1640培养基(含10% FBS、2 mmol/L L-谷氨酰胺、1 mmol/L丙酮酸钠、0.1 mmol/L非必需氨基酸、5×10-5mol/L 二甲氧基雌二醇及双抗)重悬,并调整细胞数至4×106/mL,12孔板中培养细胞,加入MOG35-55至终浓度为100 μg/mL,37 ℃、5% CO2培养箱中孵育细胞5 d。
2.4 CD4+T细胞与BMDCs共培养 将上述分离培养后的CD4+T细胞与BMDCs按照5∶1比例混合,继续添加100 μg/mL MOG35-55,培养3 d后收集细胞。
2.5 被动免疫诱导EAE及病情评分 收集各组培养后的CD4+T细胞与BMDCs共培养细胞,用PBS调整细胞浓度至2.5×108/mL,通过腹腔注射过继给雌性C57小鼠,于免疫当天和48 h后给予每只小鼠注射200 ng PTX。EAE小鼠的病情评分标准参照Terry等[7]报道的方法。1级:部分尾巴下垂;2级:完全尾巴下垂;3级:完全尾巴下垂和站立行走缓慢;4级:后肢部分瘫痪;5级:后肢完全瘫痪;6级:濒死状态。
2.6 采用流式细胞仪检测CD4+T细胞分化情况 收集每组CD4+T细胞,采用Fixable Viability Dye 450标记死细胞,固定、破膜后分别加入抗CD3e(APC-CY7)、抗CD4(BV510)、抗CD8a(PerCP-Cy5.5)、抗IL-17A(PE),避光孵育30 min进行染色,破核膜,采用抗Foxp3(Alexa Fluor 647)进行核内染色后,采用流式细胞仪检测CD4+T细胞分化情况。
2.7 采用Western blot法检测Notch蛋白表达水平 收集细胞,加入RIPA裂解液,冰上裂解30 min后,12 000 r/min、4 ℃离心,取上清。测定蛋白质浓度,变性,上样,SDS-PAGE电泳,转膜,5%脱脂牛奶封闭,洗膜,二抗室温下孵育1 h,ECL显色,采用Image J软件读取条带面积、宽度和灰度值,分析各组Notch1、Jagged1、MAML蛋白表达水平。
2.8 统计学方法 每组实验均进行3次独立重复实验,采用Flowjo 10分析流式细胞仪检测数据,采用GraphPad Prism 8.0进行统计学分析及绘图。多组均数比较使用单因素方差分析,方差齐时均数多重比较使用LSD法,方差不齐时均数多重比较使用DunnettT3法。P<0.05为差异有统计学意义。
3 结果
3.1 六味地黄汤对BMDCs中Notch通路相关蛋白表达水平的影响 与对照组比较,六味地黄汤和GSI组Notch通路相关蛋白Notch1、Jagged1、MAML水平均显著降低(P<0.05)。见图1、图2。
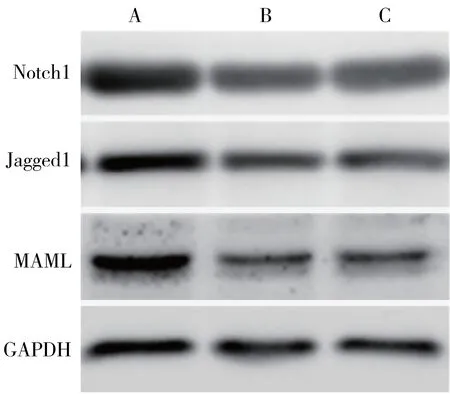
注:A.对照组;B.六味地黄汤组;C.GSI组

注:与对照组比较,*P<0.05
3.2 六味地黄汤诱导Th17/Treg细胞分化 与对照组比较,六味地黄汤组与GSI组CD4+IL-17+T细胞的比例均显著降低(P<0.05),而CD4+FoxP3+T细胞的比例则显著增高(P<0.05)。见图3、图4。

注:A.对照组;B.六味地黄汤组;C.GSI组

注:与对照组比较,*P<0.05
3.3 六味地黄汤减轻被动免疫EAE小鼠症状评分 与对照组比较,六味地黄汤组及GSI组小鼠症状评分均呈降低趋势,其中六味地黄汤组小鼠EAE症状评分在被动免疫6~8 d时显著低于对照组(P<0.05)。见图5。

注:与对照组比较,*P<0.05
4 讨论
多发性硬化可归属于中医学“痿证”范畴。《素问·痿论》中以五脏论五痿,创立痿躄、脉痿、筋痿、肉痿、骨痿等病名。其中痿躄以四肢痿弱,下肢为重,行立不能为主;骨痿多见腰脊酸软,骨节痿弱,难于直立,下肢痿弱无力。二者与多发性硬化症状最为相似。肾藏精,主骨,生髓通脑。补肾为主的方药可以明显改善多发性硬化患者的残疾程度并减少疾病复发率[8-9],其缓解EAE模型小鼠的作用可能与调节外周血CD4+T细胞分化相关[2]。但具体的机制尚不明确。
本研究发现,六味地黄汤可以显著抑制体外成熟DCs中Notch信号通路的关键蛋白Notch1、Jagged1等,DCs作为固有免疫细胞,在发挥抗原提呈作用的同时,也参与获得性免疫反应,DCs摄取外来抗原,将抗原呈递给初始T淋巴细胞,并在多种因素协同下,促进T淋巴细胞激活及进入病灶。进入病灶的炎症细胞进一步产生炎症细胞因子、趋化因子等,从而产生一系列级联免疫反应,导致髓鞘乃至轴突的损伤[10]。
Notch信号通路参与DCs对CD4+T的调节作用,Notch信号通路在进化上高度保守,它由Notch受体、配体及下游分子组成,通过相邻的细胞之间受体和配体的相互作用而传递生物信号,对细胞的增殖、分化和凋亡具有重要调节作用[11]。研究显示,在LPS刺激下DCs可刺激T细胞以增加IL-17的分泌,而抑制Notch通路可以抑制体内Th17细胞活化。Nocth信号的Jagged1配体可以促进Treg细胞的分化,上调Jagged1的表达水平,可以明显增强Treg细胞的功能,其异常表达可导致自身免疫性疾病[12]。
在主动免疫EAE小鼠CD4+T细胞与BMDCs共培养中发现,六味地黄汤及Notch通路抑制剂GSI处理后BMDCs对CD4+T细胞的分化诱导作用显著改变,Th17减少,Treg细胞增多,提示六味地黄汤对Notch信号通路的干预作用可能与抑制BMDCs对CD4+T细胞的促炎诱导有关。进一步采用被动免疫EAE模型验证CD4+T细胞分化改变后对EAE发病的影响。实验结果提示,随着CD4+T细胞促炎分化作用降低,被动免疫小鼠EAE症状积分也显著降低,这也与相关研究中Th17细胞活化对髓鞘炎症损伤的促进作用相一致[13]。
综上所述,Notch通路对DCs的调节作用,可能是“补肾生髓”法代表方六味地黄汤干预CD4+T细胞分化及其对多发性硬化发挥治疗作用的重要途径。

