睡菜醋酸乙酯部位化学成分及其神经保护作用研究
金 冠,何芷芸#,张志麒,刘呈雄,陈剑锋,邹 坤,程 凡*
睡菜醋酸乙酯部位化学成分及其神经保护作用研究
金 冠1,何芷芸1#,张志麒2,刘呈雄1,陈剑锋1,邹 坤1,程 凡1*
1. 三峡大学生物与制药学院 天然产物研究与利用湖北省重点实验室(三峡大学),湖北 宜昌 443002 2. 神农架国家公园管理局,湖北 神农架林区 442400
研究神农架产睡菜全草醋酸乙酯部位的化学成分及其神经保护作用。采用薄层色谱,正相硅胶、AB-8大孔树脂、Sephadex LH-20葡聚糖凝胶及制备型HPLC等柱色谱方法分离纯化,利用NMR、MS等波谱学方法鉴定化合物结构。采用体外建立皮质酮诱导PC12细胞损伤模型,就单体化合物对皮质酮诱导PC12细胞损伤的保护作用进行初步确认。从睡菜醋酸乙酯部位中得到了21个化合物,分别鉴定为4--咖啡酰奎尼酸甲酯(1)、绿原酸甲酯(2)、绿原酸(3)、异秦皮素(4)、异嗪皮啶(5)、7,7′,8,8′-(+)-新-橄榄脂素-4--β--吡喃葡萄糖苷(6)、肿柄雪莲苷(7)、丁香脂素(8)、苏式-(7,8)-愈创木基丙三醇-8-香草醛醚(9)、(7,8)-二氢去氢二松柏醇-4--β--吡喃葡萄糖苷(10)、(−)-落叶松脂素-4--β--吡喃葡萄糖苷(11)、山柰酚-3--芸香糖苷(12)、槲皮素-3--芸香糖苷(13)、去氢吐叶醇(14)、布卢门醇A(15)、黑麦草内酯(16)、()-6-羟基-2,6-二甲基辛-2,7-二烯酸甲酯(17)、3-甲氧基酚-1--α--吡喃鼠李糖基-(1→6)--β--吡喃葡萄糖苷(18)、2-羟基苯并咪唑(19)、丁香醛(20)、1-苯基-1,2-乙二醇(21)。皮质酮诱导PC12细胞损伤的神经保护作用研究显示,化合物1~3、7、9对皮质酮诱导PC12细胞损伤具有显著的保护作用,化合物4、5、10、11、15~17表现出中等的保护作用。化合物1~9、11~12、14~21为首次从该植物中分离得到;部分化合物对皮质酮诱导PC12细胞损伤具有保护作用。
睡菜;抗焦虑;PC12细胞;神经保护;4--咖啡酰奎尼酸甲酯;绿原酸;异秦皮素;苏式-(7,8)-愈创木基丙三醇-8-香草醛醚
睡菜L.为龙胆科睡菜属多年生水生植物,广布于北半球温带地区,我国西藏、云南、四川、贵州、黑龙江、吉林、辽宁及鄂西地区均有分布[1]。又名醉草、绰菜、瞑菜。《本草纲目》记载,睡菜性甘微苦,寒,无毒,以单方入药,治心膈邪热,不得眠;《北方常用中草药手册》曰:睡菜味甘微苦,性温,无毒,能健脾消食、养心安神,治胃炎、胃痛、消化不良、心悸失眠、心神不安[2]。据《南方草木状》记载:“睡菜,夏生于池沼间,叶类慈姑,根如藕条,南海人食之,云令人思睡,呼为瞑菜”[3]。睡菜在民间药食两用,我国民间部分省市有采集睡菜做泡菜的习俗,吃后较为嗜睡,可以治疗失眠,有养心安神的功效。睡菜中主要含有环烯醚萜、挥发油、生物碱、甾体等类成分。
本课题组在前期研究中已证实睡菜提取物毒性较小且具有良好的镇静催眠活性,其中的醋酸乙酯部位具有显著地镇静催眠活性[4]。《问斋医案》所云:“动甚则怔仲,令人惶惕不安,凄怆不乐,甚至心烦虑乱,不知所从,无故多思,寤不成寐”。阐明了焦虑与失眠有着密切联系,并在病因病机方面有着共通之处。有研究显示,失眠作为一项独立的危险因素,在焦虑状态的发病过程中起着决定性的作用[5-6]。PC12细胞株来源于一种可移植的鼠嗜铬细胞瘤,分化的PC12细胞具有典型的神经元的功能,被广泛用于神经细胞分化、离子通道、受体、递质等研究领域[7]。皮质酮是一种糖皮质激素,可导致海马神经元的病理损伤,从而诱导焦虑行为。这一特点使得高浓度皮质酮诱导PC12细胞损伤可模拟焦虑症神经细胞损伤状态[8]。因此本研究从睡菜全草醋酸乙酯部位分离并鉴定得到21个化合物,并通过建立皮质酮损伤的PC12细胞模型探究睡菜中抗焦虑活性物质,该研究结果为深入开发利用睡菜植物资源,发现具有抗焦虑活性的天然活性物质奠定基础。
1 材料与仪器
1.1 仪器与试剂
Bruker AV 400型核磁共振波谱仪(瑞士布鲁克公司);Thermo ISQ LT单四极杆气质联用仪(美国赛默飞公司);Dionex Ultimate 3000型高效液相色谱仪(美国戴安公司);Waters 1525 EF高效液相色谱仪(美国Waters公司);Venusil XBP C18色谱柱(半制备型;250 mm×10 mm,10 μm;分析型:250 mm×4.6 mm,5 μm,天津博纳艾杰尔科技有限公司);低温冷冻干燥机(美国Labconco公司);TECAN infinite F200 PRO酶标仪(瑞士帝肯公司);荧光显微镜(宁波舜宇仪器有限公司XD30A-RFL);CO2培养箱(德国binder公司);低温离心机(德国Eppendorf公司);SZ-93型自动双重纯水蒸馏器(上海亚荣生化仪器厂);MS-TS万分之一电子天平(上海梅特勒-托利多有限公司;正相色谱硅胶(烟台化学工业研究所);反相色谱硅胶(日本YMC公司);Sephadex LH-20(美国Pharmacia公司);MCI GEL(日本三菱化学);1640培养基(美国Gibco公司);胎牛血清(浙江天杭生物科技股份有限公司);皮质酮(美国Medchemexpress公司);MTT(美国Amersco公司);DMSO(美国Sigma公司);高效液相用乙腈、甲醇均为色谱纯(美国Tedia公司);水为三蒸水;其他试剂均为分析纯(国药集团化学试剂有限公司)。
1.2 材料
实验用睡菜全草于2018年9月采自湖北省神农架大九湖,经三峡大学生物与制药学院王玉兵博士鉴定为龙胆科睡菜属植物睡菜L.的全草。植物标本现保存于三峡大学天然产物研究与利用湖北省重点实验室。
实验所用细胞:PC12高分化细胞,为三峡大学医学院提供。接种于含10%胎牛血清,2%谷氨酰胺的DMEM培养液中,在37 ℃、5% CO2培养箱中培养。
2 方法
2.1 提取分离
睡菜干燥全草(6.3 kg)粉碎,用95%乙醇回流提取3次(60 L×3),每次2 h。将乙醇提取液减压浓缩干燥,得到睡菜醇提总浸膏1514 g,总浸膏加水均匀混悬,依次用石油醚、醋酸乙酯、正丁醇萃取,萃取液减压浓缩,得到石油醚萃取部位102 g、醋酸乙酯萃取部位172 g、正丁醇萃取部位350 g。
取醋酸乙酯萃取部位160 g,纯水溶解后,AB-8大孔吸附树脂柱色谱分离,依次用纯水及20%、40%、60%、80%、100%乙醇洗脱,减压浓缩干燥,得到纯水洗脱部位(13 g)、20%乙醇水洗脱部位(6 g)、40%乙醇水洗脱部位(34 g)、60%乙醇水洗脱部位(23 g)、60%乙醇水洗脱部位(30 g)、100%乙醇洗脱片段(50 g)。取40%乙醇水洗脱部位,用C18反相硅胶柱色谱分离,水-甲醇梯度洗脱,经HPLC分析合并,得到10个组分Fr. C1~C10。Fr.C3(1500 mg)经HW-20F凝胶柱分离,得到Fr. C3a~C3i;Fr. C3a经制备型HPLC[乙腈-水(18∶82)]纯化,得到化合物7(2.1 mg)、13(9.1 mg)、18(1.1 mg)、21(5.2 mg);Fr. C3b经制备型HPLC[(乙腈-水(20∶80)]纯化,得到化合物2(24.4 mg)、5(5.3 mg);Fr. C3e经制备型HPLC[乙腈-水(22∶78)]纯化,得到化合物1(3.3 mg)、4(3.2 mg)、14(4.9 mg)、15(3.8 mg);Fr. C3i经制备型HPLC[乙腈-水(23∶77)]纯化,得到化合物12(3.1 mg)、16(3.2 mg)、19(2.5 mg)。Fr. C6经Sephadex LH-20葡聚糖凝胶柱色谱分离,得到Fr. C6a~C6d。Fr. C6c经制备型HPLC[乙腈-水(24∶75)]纯化,得到化合物3(11.7 mg)、8(3.1 mg)、9(3.1 mg)、10(8.1 mg)、11(30.1 mg);Fr. C6d经制备型HPLC[乙腈-水(24∶76)]纯化,得到化合物6(10.1 mg)、17(3.9 mg)、20(2.3 mg)。
2.2 生物活性评价
2.2.1 皮质酮对PC12细胞的浓度选择 将浓度为1.5×105个/mL的处于对数生长期PC12细胞接种于96孔板,培养24 h后,分别加入终浓度为450、550、650、750、850、950、1050、1150μmol/L皮质酮溶液,培养48 h后,每孔加入25 μL MTT(5 mg/mL)继续培养4 h后,弃上清,每孔加入150 μL二甲基亚砜,震摇10 min后,于酶标仪570 nm波长处检测吸光度值。
2.2.2 实验分组及药物处理 将对数生长期的PC12细胞以1.5×105个/mL细胞密度接种于96孔板中,培养24 h后,随机分为对照组(只加细胞)、模型组(650 μmol/L皮质酮)、实验组(650 μmol/L皮质酮+200 μmol/L化合物1~21),继续培养48 h。
2.2.3 MTT法检测单体化合物对皮质酮诱导的PC12细胞的保护作用 PC12细胞按照“2.2.1”项方法处理后,每孔加入25 μL MTT(5 mg/mL)继续作用4 h后,弃上清,每孔加入150 μL二甲基亚砜,震摇10 min后,于酶标仪570 nm波长处检测吸光度值。
2.2.4 数据分析 所有实验数据进行One-way ANOVA比较分析,并釆用数据分析软件Graphpad Prism 5.03 Turkey’s检验进行组间显著性分析,实验数据表示为,<0.05时,不同实验组间存在统计学意义。
3 结果
3.1 结构鉴定
化合物1:白色粉末,EI-MS/: 368 [M]+,分子式为C17H20O9。1H-NMR (400 MHz, DMSO-6): 7.51 (1H, d,= 15.9 Hz, H-7′), 7.06 (1H, d,= 1.9 Hz, H-2′), 7.02 (1H, dd,= 8.1, 1.9 Hz, H-6′), 6.78 (1H, d,= 8.1 Hz, H-5′), 6.28 (1H, d,= 15.9 Hz, H-8′), 4.74 (1H, m, H-4), 4.08 (1H, m, H-5), 3.95 (1H, m, H-3), 3.63 (3H, s, -OCH3), 1.81~2.09 (4H, m, H-2, 6);13C-NMR (100 MHz, DMSO-6): 173.7 (C-7), 166.5 (C-9′), 148.5 (C-4′), 145.6 (C-7′), 144.8 (C-3′), 125.7 (C-1′), 121.3 (C-6′), 115.9 (C-5′), 114.7 (C-2′), 114.5 (C-8′), 75.6 (C-4), 73.5 (C-1), 65.4 (C-5), 64.5 (C-3), 51.7 (-OCH3), 40.9 (C-2), 38.1 (C-6) 。以上数据与文献报道一致[9],故鉴定化合物1为4--咖啡酰奎尼酸甲酯。
化合物2:白色粉末,EI-MS/:368 [M]+,分子式为C17H20O9。1H-NMR (400 MHz, CD3OD): 7.51 (1H, d,= 15.9 Hz, H-7′), 7.05 (1H, d,= 1.9 Hz, H-2′), 6.95 (1H, dd,= 8.1, 1.9 Hz, H-6′), 6.79 (1H, d,= 8.1 Hz, H-5′), 6.20 (1H, d,= 15.9 Hz, H-8′), 5.26 (1H, m, H-3), 4.13 (1H, m, H-5), 3.72 (1H, dd,= 7.5, 3.1 Hz, H-4), 3.69 (3H, s, -OCH3), 2.00~2.23 (4H, m, H-2, 6);13C-NMR (100 MHz, CD3OD): 175.5 (C-7), 168.3 (C-9′), 149.6 (C-4′), 147.4 (C-7), 146.6 (C-3′), 127.5 (C-1′), 123.1 (C-6′), 116.2 (C-5′), 115.2 (C-2′), 115.0 (C-8′), 75.7 (C-1), 72.3 (C-4), 72.1 (C-3), 70.1 (C-5), 53.0 (-OCH3), 38.1 (C-6), 37.6 (C-2)。以上数据与文献报道一致[10],故鉴定化合物2为绿原酸甲酯。
化合物3:白色粉末,EI-MS/:354 [M]+,分子式为C18H18O9。1H-NMR (400 MHz, CD3OD): 7.58 (1H, d,= 15.9 Hz, H-7′), 7.02 (1H, d,= 2.0 Hz, H-2′), 6.95 (1H, dd,= 8.1, 2.0 Hz, H-6′), 6.76 (1H, d,= 8.0 Hz, H-5′), 6.32 (1H, t,= 15.9 Hz), 5.35 (1H, m, H-3), 4.15 (1H, m, H-5), 3.65 (1H, dd,= 8.5, 3.4 Hz, H-4), 1.96~2.22 (4H, m, H-2, 6);13C- NMR (100 MHz, CD3OD): 178.3 (C-7), 169.1 (C-9′), 149.5 (C-4′), 146.6 (C-7′), 146.6 (C-3′), 127.8 (C-1′), 122.8 (C-6′), 116.5 (C-5′), 115.9 (C-8′), 115.1 (C-2′), 75.5 (C-1), 74.8 (C-4), 73.1 (C-3), 68.3 (C-5), 41.6 (C-6), 36.6 (C-2)。以上数据与文献报道一致[10],故鉴定化合物3为绿原酸。
化合物4:白色粉末,EI-MS/: 220 [M]+,分子式为C11H10O5。1H-NMR (400 MHz, CD3OD): 7.89 (1H, d,= 9.5 Hz, H-4), 6.77 (1H, s, H-5), 6.32 (1H, d,= 9.5 Hz, H-3), 3.81 (3H, s, 6-OCH3), 3.77 (3H, s, 7-OCH3);13C-NMR (100 MHz, CD3OD): 160.3 (C-2), 149.9 (C-6), 144.9 (C-4), 140.3 (C-7), 138.5 (C-9), 138.4 (C-8), 114.6 (C-3), 114.5 (C-10), 100.4 (C-5), 60.7 (7-OCH3), 56.1 (6-OCH3)。以上数据与文献报道一致[11],故鉴定化合物4为异秦皮素。
化合物5:白色粉末,EI-MS/:222 [M]+,分子式为C11H10O5。1H-NMR (400 MHz, CD3OD): 7.83 (1H, d,= 9.5 Hz, H-4), 6.91 (1H, s, H-5), 6.20 (1H, d,= 9.5 Hz, H-3), 3.94 (3H, s, 6-OCH3), 3.88 (3H, s, 8-OCH3)。13C-NMR (400 MHz, CD3OD): 163.4 (C-2), 147.8 (C-8), 146.6 (C-4), 146.3 (C-9), 144.8 (C-7), 136.7 (C-8), 112.2 (C-3), 112.1 (C-10), 104.9 (C-5), 61.7 (8-OCH3), 56.7 (6-OCH3)。以上数据与文献报道一致[12],故鉴定化合物5为异嗪皮啶。
化合物6:白色无定形粉末,EI-MS/:538 [M]+,分子式为C26H34O12。1H-NMR (400 MHz, CD3OD): 7.14 (1H, d,= 8.2 Hz, H-5), 7.12 (1H, d,= 1.9 Hz, H-2), 7.02 (1H, d,= 1.7 Hz, H-2′), 6.97 (1H, dd,= 8.2, 1.9 Hz, H-6), 6.87 (1H, dd,= 8.1, 1.7 Hz, H-6′), 6.78 (1H, d,= 8.1 Hz, H-5′), 4.98 (1H, d,= 8.1 Hz, H-7′), 4.93 (1H, d,= 8.4 Hz, H-7), 4.89 (1H, d,= 7.6 Hz, H-1′′), 3.89 (3H, s, 3-OCH3), 3.88 (3H, s, 3′-OCH3), 3.56~3.73 (4H, m, H-9, 9′), 2.32 (2H, m, H-8, 8′);13C-NMR (100 MHz, CD3OD): 151.1 (C-3), 149.2 (C-3′), 147.6 (C-4), 147.4 (C-4′), 138.8 (C-1), 134.7 (C-1′), 120.5 (C-6), 120.3 (C-6′), 118.1 (C-5), 116.2 (C-5′), 111.7 (C-2), 111.2 (C-2′), 103.0 (C-1′′), 84.9 (C-7′), 84.2 (C-7), 78.2 (C-5′′), 77.9 (C-3′′), 74.4 (C-2′′), 71.4 (C-4′′), 62.6 (C-2′′), 61.9 (C-9), 61.7 (C-9′), 56.8 (3-OCH3), 56.5 (3′-OCH3), 55.4 (C-8′), 55.2 (C-8);以上数据与文献报道一致[13],故鉴定化合物6为7,7′,8,8′-(+)-新-橄榄脂素-4--β--吡喃葡萄糖苷。
化合物7:白色无定形粉末,EI-MS/:552 [M]+,分子式为C27H36O12。1H-NMR (400 MHz, CD3OD): 6.77 (1H, d,= 1.8 Hz, H-2′), 6.71 (1H, d,= 8.0 Hz, H-5′), 6.66 (2H, s, H-2, 6), 6.61 (1H, dd,= 8.0, 1.8 Hz, H-6′), 4.86 (1H, d,= 7.6 Hz, H-1′′), 4.75 (1H, d,= 7.0 Hz, H-7), 3.99 (1H, m, H-9′a), 3.88 (1H, m, H-9a), 3.84 (6H, s, 3, 5-OCH3), 3.82 (3H, s, 3′-OCH3), 3.71 (1H, m, H-9′b), 3.58 (1H, d,= 7.5 Hz, H-7′), 2.88 (1H, dd,= 13.4, 5.1 Hz, H-7′a), 2.67 (1H, m, H-8′), 2.48 (1H, dd,= 13.4, 2.4 Hz, H-7′b), 2.32 (1H, m, H-8);13C-NMR (100 MHz, CD3OD): 154.3 (C-3, 5), 147.5 (C-3′), 144.6 (C-4′), 141.4 (C-4), 135.4 (C-1), 133.6 (C-1′), 122.2 (C-6′), 116.4 (C-5′), 113.2 (C-2′), 105.1 (C-1′′), 104.5 (C-2, 6), 83.9 (C-7), 78.2 (C-5′′), 77.7 (C-3′′), 75.6 (C-2′′), 73.8 (C-9′), 71.2 (C-4′′), 62.6 (C-6′′), 60.8 (C-9), 57.1 (3, 5-OCH3), 56.2 (3′-OCH3), 54.2 (C-8), 43.8 (C-8′), 33.5 (C-7′)。以上数据与文献报道一致[14],故鉴定化合物7为肿柄雪莲苷。
化合物8:白色无定形粉末,EI-MS/: 418 [M]+,分子式为C22H26O8。1H-NMR (400 MHz, CDCl3): 6.60 (4H, s, H-2, 2′, 6, 6′), 4.72 (2H, d,= 3.9 Hz, H-7, 7′), 4.29 (2H, dd,= 8.9, 6.4 Hz, H-9a, 9a′), 3.88 (12H, s, 4×OCH3), 3.86~3.92 (2H, m, H-9b, 9b′), 3.10 (2H, m, H-8, 8′);13C-NMR (100 MHz, DMSO-6): 147.2 (C-3, 3′, 5, 5′), 134.5 (C-4, 4′), 132.3 (C-1, 1′), 102.6 (C-2, 2′, 6, 6′), 86.4 (C-7, 7′), 71.8 (C-9, 9′), 56.5 (4×OCH3), 54.6 (C-8, 8′)。以上数据与文献报道一致[15],故鉴定化合物8为丁香脂素。
化合物9:白色无定形粉末,EI-MS/:348 [M]+,分子式为C18H20O7。1H-NMR (400 MHz, DMSO-6): 9.80 (1H, s, H-7′), 7.46 (1H, dd,= 8.4, 2.0 Hz, H-6′), 7.35 (1H, d,= 1.9 Hz, H-2′), 7.23 (1H, d,= 8.5 Hz, H-5′), 7.01 (1H, d,= 1.9 Hz, H-2), 6.80 (1H, dd,= 8.1, 1.9 Hz, H-6), 6.67 (1H, d,= 8.0 Hz, H-5), 4.71 (1H, d,= 5.6 Hz, H-7), 4.65~4.51 (1H, m, H-8), 3.80 (3H, s, 3′-OCH3), 3.73 (3H, s, 3-COH3), 3.65 (1H, dd,= 11.9, 5.9 Hz, H-9a), 3.51 (1H, dd,= 11.9, 3.4 Hz, H-9b);13C-NMR (100 MHz, DMSO-6): 191.2 (C-7′), 154.1 (C-4′), 149.6 (C-4), 147.0 (C-3′), 145.5 (C-3), 132.8 (C-1), 129.2 (C-1′), 125.6 (C-6′), 119.2 (C-6), 114.5 (C-5′), 113.7 (C-5), 111.1 (C-2), 110.3 (C-2′), 83.5 (C-8), 71.4 (C-7), 60.3 (C-9), 56.1 (3′-OCH3), 55.9 (3-OCH3)。以上数据与文献报道一致[16],故鉴定化合物9为苏式-(7,8)-愈创木基丙三醇-8-香草醛醚。
化合物10:白色无定形粉末,EI-MS/:522 [M]+,分子式为C26H34O11。1H-NMR (400 MHz, CD3OD): 7.13 (1H, d,= 8.4 Hz, H-5), 7.01 (1H, d,= 1.7 Hz, H-2), 6.94 (1H, dd,= 8.4, 1.7 Hz, H-6), 6.73 (1H, d,= 1.7 Hz, H-6′), 6.71 (1H, d,= 1.7 Hz, H-2′), 5.53 (1H, d,= 5.8 Hz, H-7), 4.89 (1H, d,= 7.3 Hz, Glc-H-1′′), 3.83 (3H, s, 3-OCH3), 3.82 (3H, s, 3′-OCH3), 3.75 (1H, m, H-9a), 3.66 (1H, m, H-9b), 3.54 (2H, t,= 6.5 Hz, H-9′), 3.45 (1H, m, H-8), 2.62 (2H, t,= 7.5 Hz, H-7′), 1.81 (2H, m, H-8′);13C-NMR (100 MHz, CD3OD): 149.4 (C-3), 146.3 (C-4), 146.1 (C-4′), 143.7 (C-3′), 137.1 (C-1), 135.6 (C-1′), 128.3 (C-5′), 118.0 (C-6), 116.8 (C-5), 116.5 (C-6′), 112.7 (C-2′), 109.7 (C-2), 101.3 (C-1′′), 87.2 (C-7), 76.9 (C-5′′), 76.4 (C-3′′), 73.4 (C-2′′), 70.1 (C-4′′), 63.6 (C-9), 61.2 (C-6′′), 60.7 (C-9′), 55.5 (3-OCH3), 55.2 (3′-OCH3), 54.3 (C-8), 34.5 (C-8′), 31.5 (C-7′)。以上数据与文献报道一致[17],故鉴定化合物10为 (7,8)-二氢去氢二松柏醇-4--β--吡喃葡萄糖苷。
化合物11:白色粉末,EI-MS/522 [M]+,分子式为C26H34O11。1H-NMR (400 MHz, DMSO-6): 7.01 (1H, d,= 9.0 Hz, H-5′), 6.89 (1H, brs, H-2), 6.76 (1H, d,= 1.9 Hz, H-6′), 6.75 (1H, s, H-6), 6.65 (1H, d,= 8.1 Hz, H-5), 6.55 (1H, d,= 2.0 Hz, H-2′), 4.85 (1H, d,= 7.0 Hz, Glc-H-1′′), 4.73 (1H, d,= 6.0 Hz, H-7′), 3.89 (1H, m, 6.0 Hz, H-9′), 3.73 (6H, s, 2×OCH3), 3.45 (2H, m, H-9), 2.21 (1H, m, H-8′), 3.66 (1H, m, H-8′), 3.59 (1H, t,= 7.4 Hz, H-9′), 2.82 (1H, m, H-7′), 2.56 (1H, m, H-8), 2.40 (1H, m, H-7′), 2.20 (1H, m, H-8′);13C-NMR (100 MHz, DMSO-6): 148.6 (C-3′), 147.5 (C-3), 145.4 (C-4′), 144.5 (C-4), 137.1 (C-1′), 131.7 (C-1), 120.7 (C-6), 117.6 (C-6′), 115.4 (C-5), 115.4 (C-5′), 112.6 (C-2′), 112.6 (C-2), 100.2 (C-1′′), 81.6 (C-7′), 77.0 (C-5′′), 71.8 (C-2′′), 71.8 (C-9), 69.7 (C-4′′), 60.4 (C-6′′), 58.4 (C-9′), 56.2 (-OCH3), 55.3 (-OCH3), 52.6 (C-8′), 41.8 (C-8), 32.2 (C-7)。以上数据与文献报道一致[18],故鉴定化合物11为(−)-落叶松脂素- 4--β--吡喃葡萄糖苷。
化合物12:黄色粉末,EI-MS/594 [M]+,分子式为C27H30O15。1H-NMR (400 MHz, DMSO-6): 7.99 (2H, d,= 8.0 Hz, H-2′, 6′), 6.86 (2H, d,= 8.0 Hz, H-3′, 5′), 6.35 (1H, s, H-8), 6.16 (1H, s, H-6), 5.29 (1H, d,= 8.0 Hz, Glc-H-1′′), 4.40 (1H, brs, Rha-H-1′′′), 1.00 (3H, d,= 7.5 Hz, Rha-H-6′′′);13C- NMR (100 MHz, DMSO-6): 177.3 (C-4), 165.4 (C-7), 161.2 (C-5), 160.1 (C-4), 156.5 (C-2), 133.3 (C-3), 131.0 (C-2′, 6′), 120.8 (C-1), 115.2 (C-3′, 5′), 103.4 (C-10), 101.5 (C-1′′), 100.7 (C-1′′′), 99.0 (C-6), 93.8 (C-8), 76.3 (C-3′′), 75.9 (C-5′′), 74.1 (C-2′′), 71.9 (C-4′′′), 70.5 (C-4′′), 70.4 (C-2′′′), 69.8 (C-3′′′), 68.2 (C-5′′′), 67.0 (C-6′′), 17.7 (C-6′′′)。以上数据与文献报道一致[19],故鉴定化合物12为山柰酚-3--芸香糖苷。
化合物13:黄色粉末,EI-MS/: 624 [M]+,分子式为C28H32O16。1H-NMR (400 MHz, DMSO-6): 7.87 (1H, s, H-2′), 7.53 (1H, d,= 8.0 Hz, H-6′), 6.93 (1H, d,= 8.0 Hz, H-5′), 6.41 (1H, s, H-8), 6.20 (1H, s, H-6), 5.45 (1H, d,= 7.2 Hz, Glc-H-1′′), 4.44 (1H, brs, Rha-H-1′′′), 3.27 (3H, s, -OCH3), 0.99 (3H, d,= 6.2 Hz, Rha-H-6′′′), 0.99 (3H, d,= 6.1 Hz, Rha-H-6′′′);13C-NMR (100 MHz, DMSO-6): 177.3 (C-4), 164.5 (C-7), 161.2 (C-5), 157.1 (C-2), 156.1 (C-9), 149.1 (C-4′), 147.5 (C-3′), 133.1 (C-3), 122.4 (C-6′), 121.2 (C-1′), 115.4 (C-5′), 113.4 (C-2′), 103.4 (C-10), 102.2 (C-1′′), 101.0 (C-1′′′), 99.6 (C-6), 94.4 (C-8), 76.7 (C-3′′), 76.1 (C-5′′), 74.5 (C-2′′), 72.1 (C-4′′′), 70.9 (C-2′′′), 70.7 (C-4′′), 70.3 (C-3′′′), 68.5 (C-5′′′), 67.2 (C-6′′), 56.0 (-OCH3), 18.0 (C-6′′′)。以上数据与文献报道一致[20],故鉴定化合物13为槲皮素-3--芸香糖苷。
化合物14:黄色粉末,EI-MS/: 222 [M]+,分子式为C13H18O3。1H-NMR (400 MHz, CD3OD): 7.01 (1H, d,= 15.8 Hz, H-7), 6.46 (1H, d,= 15.8 Hz, H-8), 5.97 (1H, m, H-4), 2.65 (1H, d,= 17.8 Hz, H-2), 2.32 (3H, s, H-10), 1.91 (3H, d,= 1.4 Hz, H-13), 1.07 (3H, s, H-12), 1.01 (3H, s, H-11);13C- NMR (100 MHz, CD3OD): 199.2 (C-9), 199.0 (C-3), 163.1 (C-5), 147.0 (C-7), 130.4 (C-8), 126.5 (C-4), 78.4 (C-6), 49.2 (C-2), 41.7 (C-1), 26.3 (C-10), 23.4 (C-12), 22.1 (C-11), 17.5 (C-13)。以上数据与文献报道一致[21],故鉴定化合物14为去氢吐叶醇。
化合物15:无色油状物,EI-MS/: 224 [M]+,分子式为C13H20O3。1H-NMR (400 MHz, DMSO-6): 5.70 (1H, d,= 15.5 Hz, H-7), 5.63 (1H, d,= 15.5 Hz, H-8), 5.78 (1H, brs, H-4), 4.19 (1H, d,= 6.4 Hz, H-9), 2.35 (1H, d,= 16.6 Hz, H-2a), 2.05 (1H, d,= 16.6 Hz, H-2b), 1.82 (3H, d,= 1.2 Hz, H-13), 1.11 (3H, s, H-10), 0.93 (3H, s, H-11), 0.91 (3H, s, H-12);13C-NMR (100 MHz, DMSO-6): 197.5 (C-3), 164.5 (C-5), 135.8 (C-7), 127.9 (C-8), 125.5 (C-4), 77.9 (C-6), 65.9 (C-9), 49.4 (C-2), 41.0 (C-1), 24.1 (C-10), 23.7 (C-12), 23.1 (C-11), 19.0 (C-13)。以上数据与文献报道一致[22],故鉴定化合物为布卢门醇A。
化合物16:白色无定形粉末,EI-MS/:196 [M]+,分子式为C11H16O3。1H-NMR (400 MHz, CD3OD): 5.73 (1H, s, H-7), 4.18 (1H, m, H-3), 2.42 (1H, dt,= 14.0, 2.8 Hz, H-4b), 2.01 (1H, dt,= 14.5, 2.8 Hz, H-2b), 1.77 (3H, s, H-11), 1.75 (1H, dd,= 14.0, 3.8 Hz, H-4a), 1.51 (1H, dd,= 14.5, 3.8 Hz, H-2a), 1.47 (3H, s, H-9), 1.27 (3H, s, H-10);13C-NMR (100 MHz, CD3OD): 185.4 (C-6), 174.4 (C-8), 113.2 (C-7), 88.8 (C-5), 67.2 (C-3), 47.7 (C-2), 46.3 (C-4), 37.2 (C-1), 30.7 (C-10), 27.1 (C-11), 26.6 (C-9)。以上数据与文献报道一致[23],故鉴定化合物16为黑麦草内酯。
化合物17:黄色油状物,EI-MS/:196 [M]+,分子式为C12H20O2。1H-NMR (400 MHz, CDCl3): 6.75 (1H, dd,= 7.1, 1.3 Hz, H-3), 5.88 (1H, dd,= 17.2, 10.7 Hz, H-7), 5.21 (1H, dd,= 17.2, 1.4 Hz, H-8a), 5.08 (1H, dd,= 10.7, 1.4 Hz, H-8b), 3.71 (3H, s, -OCH3), 2.19 (2H, m, H-4), 1.81 (3H, s, H-10), 1.62 (2H, m, H-5), 1.28 (3H, s, H-9);13C-NMR (100 MHz, CDCl3): 168.7 (C-1), 144.4 (C-7), 142.1 (C-3), 127.6 (C-2), 112.2 (C-8), 73.1 (C-6), 51.7 (-OCH3), 40.7 (C-5), 27.9 (C-9), 23.5 (C-4), 12.2 (C-10)。以上数据与文献报道一致[24],故鉴定化合物17为()-6-羟基-2, 6-二甲基辛-2,7-二烯酸甲酯。
化合物18:白色无定形粉末,EI-MS/:432 [M]+,分子式为C19H28O11。1H-NMR (400 MHz, CD3OD): 7.15 (1H, d,= 6.5 Hz, H-6), 7.03 (1H, d,= 2.9 Hz, H-2), 6.95~7.02 (2H, m, H-4, 5), 4.86 (1H, d,= 6.6 Hz, Glc-H-1′), 4.72 (1H, d,= 1.2 Hz, Rha-H-1′′), 3.86 (3H, s, 3-OCH3), 1.21 (3H, d,= 5.2 Hz, Rha-H-6′′);13C-NMR (100 MHz, CD3OD): 150.7 (C-3), 147.8 (C-1), 124.3 (C-2), 122.2 (C-5), 118.5 (C-6), 113.5 (C-4), 102.5 (C-1′), 102.2 (C-1′′), 77.9 (C-3′), 76.8 (C-5′), 75.0 (C-2′), 74.1 (C-3′′), 72.3 (C-4′′), 72.2 (C-2′′), 71.5 (C-4′), 70.1 (C-5′′), 67.9 (C-6′), 56.8 (-OCH3), 17.9 (C-6′′)。以上数据与文献报道一致[25],故鉴定化合物18为3-甲氧基苯酚-1--α--吡喃鼠李糖基-(1→6)--β--吡喃葡萄糖苷。
化合物19:浅黄色粉末,EI-MS/:134 [M]+,分子式为C7H6N2O。1H-NMR (400 MHz, DMSO-6): 10.71 (2H, s, 2×NH), 7.04~6.97 (4H, m, H-5, 6, 7, 8);13C-NMR (100 MHz, DMSO-6): 155.3 (C-2), 129.7 (C-4, 9), 120.4 (C-6, 7), 108.5 (C-5, 8)。以上数据与文献报道一致[26],故鉴定化合物19为2-羟基苯并咪唑。
化合物20:无色针状晶体(氯仿),EI-MS/: 182 [M]+,分子式为C9H10O4。1H-NMR (400 MHz, CDCl3): 9.79 (1H, s, 1-CHO), 7.13 (2H, s, H-2, 6), 3.91 (6H, s, 3, 5-OCH3);13C-NMR (100 MHz, CDCl3): 190.5 (C-1), 147.1 (C-3, 5), 141.0 (C-4), 128.2 (C-1), 106.8 (C-6), 56.3 (3, 5-OCH3)。以上数据与文献报道一致[27],故鉴定化合物20为syringaldehyde。
化合物21:无色粉末,EI-MS:/138 [M]+,分子式为C8H10O2。1H-NMR (400 MHz, CD3OD): 7.25~7.38 (5H, m, H-2~6), 4.67 (1H, dd,= 7.4, 4.7 Hz, H-1′), 3.64 (2H, m, H-2′);13C-NMR (100 MHz, CD3OD): 143.4 (C-1), 129.1 (C-3, 5), 128.4 (C-4), 127.5 (C-2, 6), 76.1 (C-1′), 68.5 (C-2′)。以上数据与文献报道一致[28],故鉴定化合物21为1-苯基- 1,2-乙二醇。
3.2 皮质酮对PC12细胞损伤的浓度选择
结果(图1)显示,皮质酮对PC12细胞的损伤程度随浓度呈相关性上升,450、550、650、750、850、950、1050、1150 μmol/L皮质酮作用PC12细胞48 h后,其细胞存活率分别为(88.81±2.21)%、(77.07±4.21)%、(52.47±0.99)%、(44.78±0.95)%、(34.26±0.91)%、(26.96±3.36)%、(12.32±0.22)%、(13.21±2.02)%。本结果验证了一定浓度的皮质酮确实能损伤神经元,650 μmol/L皮质酮作用48 h对高分化PC12细胞的抑制率接近50%,故选择以体外650 μmol/L皮质酮48 h作用于PC12细胞以模拟焦虑症神经细胞损伤状态,构建抗焦虑活性成分体外细胞筛选模型。
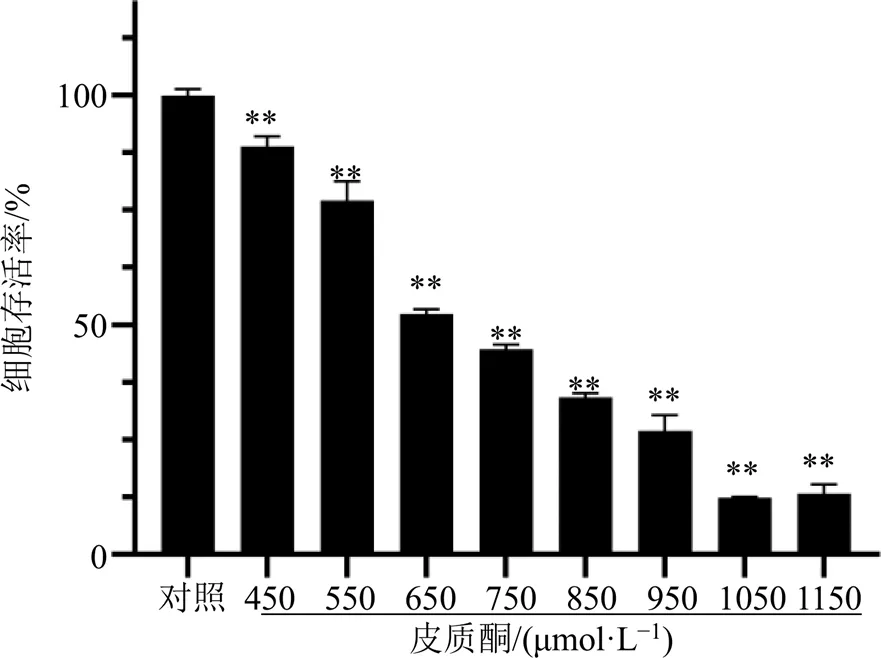
与对照组比较:**P<0.01
3.3 单体化合物对皮质酮诱导的PC12细胞损伤的保护作用
结果显示,与模型组相比,化合物1~5、7、9~11、15~17与650 μmol/L皮质酮共同作用PC12细胞48 h后,细胞存活率分别提高至(92.29±2.31)%、(90.74±1.61)%、(91.62±1.83)%、(63.11±2.30)%、(61.01±1.21)%、(101.18±1.56)%、(105.23±1.11)%、(67.77±1.89)%、(65.66±1.06)%、(75.94±0.24)%、(64.39±1.47)%、(72.88±1.82)%。苯丙素、木脂素、黄酮、单萜类均有不同程度的促进皮质酮(650 μmol/L)诱导的PC12细胞增殖的作用。其中,化合物1~3、7、9对皮质酮(650 μmol/L)诱导的PC12细胞损伤保护作用最为显著,见图2。
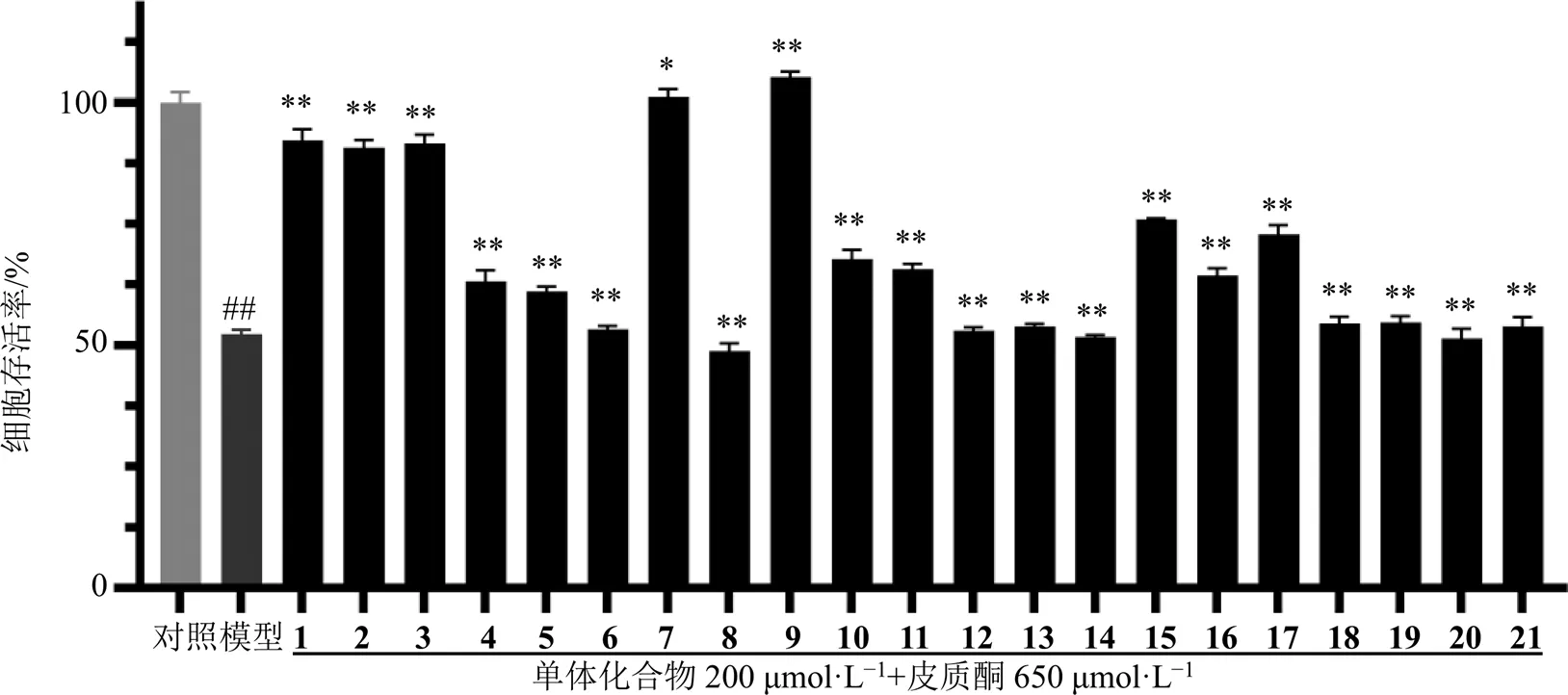
与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01
4 讨论
本研究从睡菜全草醋酸乙酯部位分离并鉴定得到21个化合物,包括3个苯丙素类(1~3),2个香豆素类(4和5),6个木脂素类(6~11),2个黄酮类(12和13),4个单萜类(14~17),4个其他类(18~21)。同时考察了21个化合物对皮质酮诱导损伤的PC12细胞的保护作用。结果表明化合物1~3、7、9表现出显著的保护作用,化合物4、5、10、11、15~17表现出中等的保护作用。
北五味子作为我国传统的安神药,近年来的研究报道了北五味子木脂素具有显著的中枢抑制与安神作用[29]。合欢皮经研究也证明其抗焦虑的主要活性成分是(−)-丁香树脂酚-4--β--葡萄糖苷,其作用机制可能与抑制PC12细胞线粒体凋亡有关[30]。后续将进一步探索睡菜主要活性成分对皮质酮损伤的PC12细胞的抗凋亡及保护作用机制,阐明睡菜抗焦虑活性的药效物质基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1989, 75(2): 300-301.
[2] 中国医学科学院药物研究所. 中药志 [M]. 北京: 人民卫生出版社, 1993: 105-108.
[3] 国家中医药管理局《中华本草》编委会. 中华本草(第七册) [M]. 上海: 科学技术出版社, 1999(19): 757.
[4] 林芳, 陈静文, 张志麒, 等. 睡菜提取物对小鼠急性毒性及镇静催眠活性研究 [J]. 食品研究与开发, 2019, 40(11): 31-35.
[5] Hertenstein E, Johann A, Baglioni C,. Treatment of insomnia - A preventive strategy for cardiovascular and mental disorders [J]., 2016, 4(2): 96-103.
[6] 世界中医药学会联合会, 中华中医药学会. 国际中医临床实践指南焦虑症(2020-10-11) [J].世界中医药, 2021, 16(8): 1188-1191.
[7] Anderson D J, Michelsohn A. Role of glucocorticoids in the chromaffin-neuron developmental decision [J]., 1989, 7(5): 475-487.
[8] Zhou H, Li X, Gao M. Curcumin protects PC12 cells from corticosterone-induced cytotoxicity: Possible involvement of the ERK1/2 pathway [J]., 2009, 104(3): 236-240.
[9] 赵珊, 张宝, 熊丹丹, 等. 苗药黑骨藤的化学成分研究 [J]. 中草药, 2017, 48(8): 1513-1518.
[10] Jung H A, Park J C, Chung H Y,. Antioxidant flavonoids and chlorogenic acid from the leaves of[J]., 1999, 22(2): 213-218.
[11] 刘卫卫, 张于, 郝小江, 等. 佛肚树的化学成分研究[J]. 天然产物研究与开发, 2014, 26(12): 1953-1956.
[12] 张宝, 姚成芬, 汪洋, 等. 耳叶牛皮消水溶性部位的化学成分研究 [J]. 中草药, 2018, 49(4): 786-790.
[13] Kikuchi M, Kikuchi M. Studies on the constituents ofMakino II. On the structures of new glycosides [J].(Tokyo), 2005, 53(1): 48-51.
[14] 冯卫生, 何玉环, 郑晓珂, 等. 望春玉兰花蕾中木脂素类化学成分的研究 [J]. 中国中药杂志, 2018, 43(5): 970-976.
[15] 冯凯, 华沛, 顾琼, 等. 大叶土蜜树化学成分及抗神经炎活性研究 [J]. 天然产物研究与开发, 2019, 31(2): 264-268.
[16] Sakushima A, Ohno K, Maoka T,. Guaiacylglycerol-7′--methyl 8′-vanillic acid ether and related compounds from[J]., 2003, 14(1): 48-53.
[17] Zhao X C, Du J L, Xie Y G,. Chemical constituents of the flowers of[J]., 2018, 54(3): 556-558.
[18] Su J, Wu Z J, Shen Y H,. Lignans from[J]., 2008, 44(5): 648-650.
[19] Sawabe A, Nesumi C, Morita M,. Glycosides in African dietary leaves,[J]., 2005, 54(3): 185-191.
[20] Ni L, Qiu Y T, Shi Y,. Chemical constituents of the roots of[J]., 2019, 55(5): 972-974.
[21] Demmak R G, Bordage S, Bensegueni A,. Chemical constituents fromand their cholinesterase inhibitory activity [J]., 2019, 25(2): 115.
[22] 阎新佳, 郑威, 温静, 等. 白花败酱草的化学成分研究 [J]. 中草药, 2017, 48(2): 247-251.
[23] 文庆, 王宝杰, 高雨秋, 等. 香港鹰爪花枝叶中的化学成分研究 [J]. 中草药, 2019, 50(3): 551-556.
[24] Marco J A, Sanz-Cervera J F, Sancenon F,. Oplopanone derivatives monoterpene glycosides from[J]., 1993, 34(4): 1061-1065.
[25] Zhang Y M, Xu J, Xiao L,. A New Phenolic Glycoside fromvar.f. crippsii [J]., 2013, 18(1): 1255-1261.
[26] Liu P, Wang Z M, Hu X M. Highly efficient synthesis of ureas and carbamates from amides by iodosylbenzene- induced Hofmann rearrangement [J]., 2012, 2012(10): 1994-2000.
[27] Niu X M, Li S H, Peng L Y,. Constituents from[J]., 2001, 3(4): 299-311.
[28] 卢辛甜, 邵莉, 赵碧清, 等. 苦笋化学成分及其抗炎活性 [J]. 中成药, 2019, 41(11): 2663-2667.
[29] Kim S R, Lee M K, Koo K A,. Dibenzocyclooctadiene lignans fromprotect primary cultures of rat cortical cells from glutamate-induced toxicity [J]., 2004, 76(3): 397-405.
[30] 吴婉琴. 合欢皮抗焦虑活性部位作用机理研究及主要活性成分对PC12细胞凋亡的影响 [D]. 武汉: 湖北中医药大学, 2017.
Chemical constituents of ethyl acetate extract fromand their neuroprotective activity
JIN Guan1, HE Zhi-yun1, ZHANG Zhi-qi2, LIU Cheng-xiong1, CHEN Jian-feng1, ZOU Kun1, CHENG Fan1
1. Hubei Key Laboratory of Natural Products Research and Development, College of Biological and Pharmaceutical Sciences, China Three Gorges University, Yichang 443002, China 2. Shengnongjia National Park Administration, Shengnongjia Forestry District 442400, China
To study the chemical constituents of the ethyl acetate extract from the whole herb ofof Gentianaceae.various chromatographic techniques, including positive phase silica gel column chromatography, thin-layer chromatography, AB-8 macroporous resin column chromatography, Sephadex LH-20 and preparative HPLC were used to separate and purify the chemical constituents.cell model was used for preliminary confirmation of the neuroprotective ability of compounds on corticosterone (CORT)-induced neurotoxicity in differentiated PC12 cells.Their structures were determined by various spectral data. Finally, 21 compounds were isolated from the acetic ether extract ofand the structures were identified as 4--caffeoylquinic acid methyl ester (1), methylchlorogenate (2), chlorogenic acid (3), isofraxetin (4), isofraxidin (5), 7,7′,8,8′-(+)-neo-olivil-4--β--glucopyranoside (6), conicaoside (7), (−)-syringaresinol (8),-(7,8)-guaiacylglycerol 8-vanillin ether (9), (7,8)-dihydrodehydrodiconiferyl alcohol-4--β--glucopyranoside (10), (−)-lariciresinol-4--β-- glucoyranoside (11), kaempferol-3--rutinoside (12), quercetin-3--rutinoside (13), dehydrovomifoliol (14), blumenol A (15), loliolide (16), ()-6-hydroxy-2,6-dimethylocta-2,7-dienoicacidmethylester (17), 3-methoxyphenol 1--α--rhamnopyranosyl- (1→6)--β--glucopyranoside (18), 2-hydroxybenzimidazole (19), syringaldehyde (20), 1-phenyl-1,2-ethanediol (21). The neuroprotective effects investigation of compounds on CORT-induced neurotoxicity in differentiated PC12 cells showed that compounds 1—3, 7, 9 had significant protective effects on PC12 cells, and compounds 4, 5, 10, 11, 15—17 showed moderate protective effects.Compounds 1—9, 11—12, 14—21 are isolated fromfor the first time. Some compounds exert neuroprotective activity to corticosterone-induced injury of PC12 cells.
L.; anxiolytic activity; PC12 cell; neuroprotective activity; 4--caffeoylquinic acid methyl ester; chlorogenic acid; isofraxetin;-(7,8)-guaiacylglycerol 8-vanillin ether
R284.1
A
0253 - 2670(2022)04 - 0985 - 08
10.7501/j.issn.0253-2670.2022.04.004
2021-10-19
国家自然科学基金资助项目(81773952);国家自然科学基金资助项目(81803383);湖北省神农架林区自然科学基金(SNJKJ2016029)
金 冠(1996—),硕士研究生,研究方向为天然药物化学。E-mail: 1026102943@qq.com
程 凡(1973—),副教授,硕士生导师,研究方向为天然药物化学。E-mail: chengf@ctgu.edu.cn
#共同第一作者:何芷芸(1997—),硕士研究生,研究方向为天然药物化学。E-mail: 373389451@qq.com
[责任编辑 王文倩]

