丹参酮类脂溶性成分及其干预缺血性脑卒中机制的研究进展
王哲义,孙怿泽,邓欣祺,王春国,田金洲,卢 涛*
丹参酮类脂溶性成分及其干预缺血性脑卒中机制的研究进展
王哲义1, 2, 3, 4,孙怿泽2,邓欣祺3,王春国2,田金洲4*,卢 涛3*
1. 山东大学齐鲁医院,山东 济南 250012 2. 北京中医药大学,北京 100029 3. 北京中医药大学生命科学学院,北京 100029 4. 北京中医药大学东直门医院,北京 100010
缺血性脑卒中是一种由于脑部供血受阻导致缺血灶不可逆损伤的中枢神经系统疾病,其发病突然、传变迅速、病程复杂,静脉溶栓和血管内介入是早期干预的主要措施,但时间窗和禁忌症使其应用受到限制。丹参et为传统中药材,其中丹参酮类脂溶性成分治疗缺血性脑卒中疗效确切并在临床广泛应用。总结了丹参酮类脂溶性成分干预缺血性脑卒中的可能机制,包括抗凋亡、抗炎、调节自噬、限制谷氨酸兴奋性毒性、抑制氧化应激、促进新生血管形成等,以期为临床应用提供一定的借鉴。
丹参;缺血性脑卒中;丹参酮ⅡA;丹参酮ⅡB;丹参酮Ⅰ;隐丹参酮;抗凋亡;抗炎;调节自噬
脑卒中是一种急性脑血管疾病,以脑组织缺血或血管损伤症状为主要临床表现[1]。数据显示,脑卒中已经成为中国人死亡和致残的首要原因[2]。其中,缺血性脑卒中占60%~70%[3],其发病突然、传变迅速、病程复杂,以神经元坏死和损伤为主要病理改变[4]。国内外指南指出,静脉溶栓和血管内介入是早期干预的主要措施[5],但时间窗和禁忌症使其应用受到限制,因此针对缺血性脑卒中急性期错过溶栓和介入最佳治疗时间的患者,有必要寻求其他有效的替代治疗方法。
丹参为传统中药材,始载于《神农本草经》,列为上品。丹参为唇形科鼠尾草属植物丹参Bge.的干燥根及根茎,味苦微寒,归心、肝经,具有活血祛瘀、通经止痛、清心除烦、凉血消痈的功效[6],《妇人明理论》记载丹参“补血生血,功过归地;调血敛血,力堪芍药;逐瘀生新,性倍川芎”,1味药物有4物之功。丹参的化学成分主要分为脂溶性的丹参酮类化合物和水溶性的酚酸类化合物2类。脂溶性丹参酮类成分的药理研究始于20世纪30年代,其治疗缺血性脑卒中疗效确切并在临床广泛应用[7]。然而,丹参酮类脂溶性成分干预缺血性脑卒中的靶点和机制尚缺乏系统梳理,本文主要对丹参酮类脂溶性成分及其干预缺血性脑卒中机制的研究进展进行综述,旨在为后续研究提供一定参考。
1 丹参酮类脂溶性成分
目前从丹参中分离出83种丹参酮类脂溶性成分,其由4个异戊二烯聚合而成。根据结构特征,将丹参酮类化合物进一步划分为2个亚类。一类化合物包含邻萘醌结构,见图1;另一类包含对萘醌结构,见图2。此外,还有不符合这2种结构的其他成分,见图3。在所有的丹参酮类化合物中,丹参酮IIA的相关研究最为广泛,已有大量关于其药理活性方面的报道[8]。丹参中的丹参酮类化合物见表1。
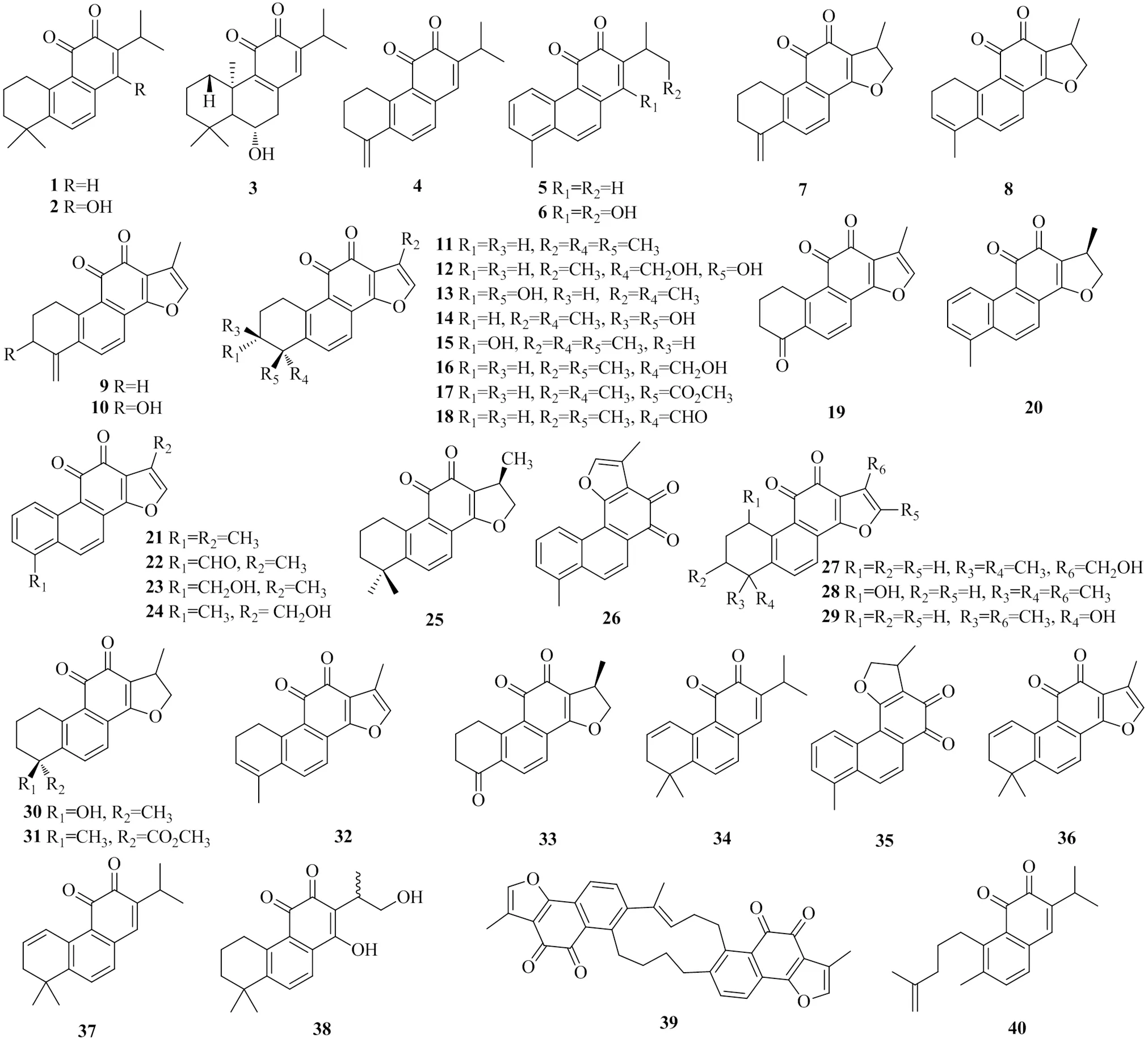
图1 丹参中邻萘醌型丹参酮类化合物的化学结构

图2 丹参中对萘醌型丹参酮类化合物的化学结构

图3 丹参中其他丹参酮类化合物的化学结构
表1 丹参中的丹参酮类化合物
Table 1 Tanshinones in Salviae MiltiorrhizaeRadix et Rhizoma
编号化合物名称分子式文献 1丹参新酮(miltirone)C19H22O2 9 2脱氧基新隐丹参酮(deoxyneocryptotanshinone) C19H22O310 37β-羟基-8,13-松香二烯-11,12-二酮(7β-hydroxy-8,13-abietadiene-11,12-dione)C20H28O311 44-亚甲丹参新酮(4-methylene miltirone)C18H18O211 52-异丙基-8-甲基菲-3,4-二酮(2-isopropyl-8-methylphenanthrene-3,4-dione)C18H16O212 6丹参酮VI(tanshinone VI)C18H16O411 7次甲二氢丹参醌(methylenedihydrotanshinquinone)C18H16O311 81,2,5,6-四氢丹参酮I(1,2,5,6-tetrahydrotanshinone I)C18H16O311 9亚甲基丹参醌(methylene tanshinquinone)C18H14O313 103-羟基亚甲基丹参醌(3-hydroxymethylenetanshinquinone)C18H14O414 11丹参酮IIA(tanshinone IIA)C19H18O315 12丹参二醇A(tanshindiol A)C18H16O516 13丹参二醇B(tanshindiol B)C18H16O516 14丹参二醇C(tanshindiol C)C18H16O516 153α-羟基丹参酮IIA(3α-hydroxytanshinone IIA)C19H18O416 16丹参酮IIB(tanshinone IIB)C19H18O417 17丹参酸甲酯(methyl tanshinonate)C20H18O518 18丹参醛(tanshinaldehyde)C19H18O418 19去甲丹参酮(nortanshinone) C17H12O416 20二氢丹参酮I(15,16-dihydrotanshinone I)C18H14O315 21丹参酮I(tanshinone I)C18H12O315 22醛基丹参酮(formyltanshinone)C18H10O411 23tanshinol AC18H12O419 24紫丹参素乙(przewaquinone B)C18H12O420 25隐丹参酮(cryptotanshinone)C19H20O315 26异丹参酮II(isotanshinone II)C18H12O321 27紫丹参素甲(przewaquinone A) C19H18O420 28羟基丹参酮IIA(hydroxytanshinone IIA)C19H18O418 29tanshinol BC18H16O419 30紫丹参素丙(przewaquinone C)C18H16O418 31二氢丹参酮酸甲酯(methyl dihydronortanshinonate)C20H20O522 321,2-二氢丹参醌(1,2-dihydrotanshinquinone)C18H14O323 33二氢丹参酮(dihydronortanshinone)C17H14O424 34去氢丹参新酮(1,2-didehydromiltirone)C19H20O211 35二氢异丹参酮II(dihydroisotanshinone II)C18H14O325 36∆1-去氢丹参酮IIA(∆1-dehydrotanshinone IIA)C19H16O310 37∆1-丹参新酮(∆1-dehydromiltirone)C19H20O211 38丹参酮V(tanshinone V)C19H22O426 39甘西鼠尾新酮A(neo-przewaquinone A)C36H28O627 40红根草邻醌(saprorthoquinone)C20H24O228 41新隐丹参酮II(neocryptotanshinone II)C19H22O310 42丹参新醌乙(danshenxinkun B)C18H16O315

续表1
2 丹参酮类脂溶性成分干预缺血性脑卒中的机制
缺血性脑卒中的发生发展与多种因素有关,脑组织缺血缺氧引发细胞能量衰竭、离子稳态失衡,并能诱导钙超载、兴奋性毒性、氧化应激、神经炎症和细胞凋亡,一系列缺血级联反应启动了细胞死亡途径[44]。自噬参与缺血性脑卒中的病理进程甚至决定神经细胞命运,近年来日益受到重视和关注[45-46]。另有研究表明,缺血区域中组织氧分压的降低经常导致补偿性新血管形成以满足代谢需求,并且卒中后的血管生成与患者的生存率呈正相关[47]。本文将从细胞凋亡、神经炎症、氧化应激、兴奋性毒性、细胞自噬、血管形成等方面概述丹参酮类脂溶性成分干预缺血性卒中机制的研究进展。
2.1 抗细胞凋亡
细胞凋亡在缺血发作数小时后开始,主要见于缺血半暗带区。神经元凋亡是细胞内死亡程序启动致使细胞“自杀”的过程,神经细胞体积变小,细胞膜通透性改变,胞质减少,胞核固缩于边缘,DNA降解,凋亡小体形成,最终被吞噬细胞吞噬[48]。缺血性神经元凋亡主要是由B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)家族基因、半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)家族基因介导的线粒体凋亡过程。研究表明,连续ip丹参酮ⅡA4、8 mg/kg 7、15 d,可通过下调Caspase-3和Caspase-8蛋白表达,减小大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)大鼠的梗死面积[49]。Bcl-2相关X蛋白(Bcl-2-associated X,Bax)活化后破坏线粒体膜通透性,释放细胞色素C而介导线粒体途径的细胞凋亡。而Bcl-2与Bax形成异源二聚体,抑制细胞凋亡。ig丹参酮ⅡA30 mg/(kg∙d) 7 d,可通过增加Bcl-2/Bax值,在大鼠MCAO模型中发挥抗凋亡作用[50]。ig丹参酮ⅡA15、30 mg/kg 3 d可调节凋亡蛋白的作用机制在MCAO/再灌注损伤(reperfusion,R)模型大鼠中也得到验证[51]。星形孢菌素是一种强效的、ATP竞争性激酶抑制剂,丹参酮ⅡB1~100μmol/L干预24 h均能显著抑制星形孢菌素诱导的大鼠皮层神经元凋亡,降低Caspase-3、Bax蛋白含量[52]。氧糖剥夺(oxygen-glucose deprivation,OGD)是在细胞水平上模拟缺血/低氧的刺激模型,常被用作缺血性脑卒中体外研究。隐丹参酮也是目前研究较多的丹参脂溶性成分之一,有研究共培养脑微血管内皮细胞、星形胶质细胞和神经元,建立了神经血管单元的体外模型,再进行OGD/复氧(recovery,R)构建缺血缺氧模型,结果发现隐丹参酮2.5、5.0 μmol/L干预3 h可抑制Caspase-3的活化和聚ADP-核糖聚合酶的降解,增加Bcl-2/Bax值,从而抑制神经细胞凋亡[53]。周亮[54]研究发现,将丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮等15种丹参酮类化合物混合,并以5 μg/mL干预OGD大鼠原代神经细胞5 d,通过实时荧光聚合酶链式反应技术与蛋白质免疫印迹法分别检测和mRNA与蛋白质表达水平,结果发现,丹参酮类混合物干预组可以显著逆转OGD导致的Bcl-2下调以及Bax上调。总之,丹参部分脂溶性化合物可通过抑制凋亡诱导因子表达而发挥神经保护作用。
2.2 抑制神经炎症
卒中破坏促炎和抗炎反应之间的动态平衡,缺血中心区组织细胞坏死,引起炎症细胞活化,释放大量的炎症介质,从而促发炎症反应,卒中患者预后不良与炎症标志物水平升高密切相关[44]。丹参酮ⅡA可通过抑制炎性细胞的活化及趋化因子的表达,抑制卒中后炎症爆发[55]。在OGD/R体外模型中,丹参酮ⅡA0.5、1、2 μg/mL干预12 h可抑制核苷酸结合寡聚结构域(nucleotide binding oligomerization domain,NOD)样受体家族3(NOD-like receptors,NLRP3)相关信号通路的活化,降低白细胞介素-1β(interleukin-1β,IL-1β)、Caspase-1及IL-18的表达,进而减轻小胶质细胞BV2损伤[56]。在MCAO体内模型中,ip丹参酮ⅡA5 mg/kg 7 d,大鼠海马和皮层IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、C-反应蛋白水平均受到抑制,且脑梗死体积、脑水肿和神经功能缺损评分显著降低[57]。有研究改进了丹参酮IIA的给药剂型,发现与iv相比,阳离子白蛋白缀合的聚乙二醇化纳米颗粒可增加血药浓度和延长循环时间,更加有效地通过血脑屏障,抑制促炎细胞因子TNF-α和IL-8的表达,上调抗炎细胞因子IL-10,提高转化生长因子β水平,抑制中性粒细胞浸润,从而缩小梗死面积,改善神经功能[58]。另外,丹参酮ⅡA16、32 mg/kg持续干预7 d,可降低细胞间黏附分子-1的表达,减轻白细胞浸润及细胞黏附分子所致的脑损伤[59]。
2.3 调节细胞自噬
细胞自噬是细胞利用溶酶体降解自身受损的细胞器和大分子物质、维持内环境稳态的过程。脑组织缺血缺氧可诱导神经细胞自噬,从而抵抗不利环境的变化[60]。但是,自噬究竟是内源性神经保护机制,还是促进细胞死亡,其双重作用机制尚存争议。哺乳动物雷帕霉素受体(mammalian target of rapamycin,mTOR)是调控自噬的中心蛋白,磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/ 蛋白激酶B(protein kinase B,PKB/Akt)信号传导可激活mTOR,从而抑制自噬活性。研究表明,大鼠ig丹参酮ⅡA10 mg/kg 4 d可逆转同源性磷酸酶-张力蛋白的下降趋势,抑制卒中后自噬相关通路PI3K/Akt/mTOR的过度激活,并通过Longa评分证实其减轻脑组织损伤的药效机制[61]。丹参酮IIA磺酸钠是丹参酮IIA磺化后的成分,其注射剂型已在临床中广泛用于卒中的治疗。研究显示,丹参酮IIA磺酸钠10、20、40 mg/kg下调自噬相关蛋白苄氯素、轻链蛋白3-Ⅱ的表达,抑制细胞自噬,改善大鼠神经功能缺损并减轻脑水肿[62]。有研究对丹参酮ⅡA磺酸钠抑制神经元自噬的机制进行深入研究,发现ip丹参酮ⅡA磺酸钠20、50、100 mg/kg可通过激活Akt/mTOR信号通路改善新生大鼠的缺血缺氧性脑损伤[63]。
2.4 限制谷氨酸兴奋性毒性
缺血性脑卒中引发突触外谷氨酸的过度释放和谷氨酸受体的活化,大量谷氨酸引起活性氧增加、内质网应激和炎性小体活化,导致神经元受损。有研究通过高效液相色谱法测定海马组织内氨基酸含量,发现ip丹参酮IIA2、4 mg/kg可减少MCAO大鼠皮层和海马组织内谷氨酸及γ-氨基丁酸的含量,提高局灶性脑缺血大鼠神经行为学评分[64]。ip丹参酮B钠盐4、8、16 mg/kg 3 d能够降低兴奋性神经递质谷氨酸,减少-甲基--天冬氨酸受体1通道蛋白表达,进而抵抗缺血再灌注脑损伤[65]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号级联在神经递质胞吐过程中起关键作用,Ca2+内流可增强MAPK/MEK磷酸化和谷氨酸释放,丹参酮IIA3~100 μmol/L以浓度相关性的方式,抑制突触前Ca2+内流和MAPK信号活化,减少大鼠皮质突触小体中的谷氨酸释放[66]。
2.5 抗氧化应激
生理状态下,由线粒体产生的自由基处于较低水平,可以被内源性自由基清除酶如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化系统清除。在缺血及再灌注时,由于兴奋性毒性及恢复血流和氧供,活性氧生成加快,远超过抗氧化系统的清除速度,氧化和抗氧化系统稳态破坏,自由基大量积累而形成的氧化应激状态导致神经元损伤,是缺血再灌注的关键病理机制[67]。有研究在脑缺血再灌注大鼠中检测到GSH-Px活性增强,推测与缺血后的代偿性反应相关,丹参酮ⅡA干预后,GSH-Px活性进一步增强,表明丹参酮ⅡA可以通过提高GSH-Px水平而增强抗氧自由基效用[68]。另外,ip丹参酮ⅡA磺酸钠10、20、30 mg/kg可通过沉默信息调节因子2相关酶1/叉头蛋白O3α信号通路,增强GSH和SOD活性,减少丙二醛、一氧化氮等自由基的产生,增加机体清除自由基的能力,从而降低MCAO术后大鼠死亡率,改善神经功能评分,减轻脑水肿[69]。
2.6 促进血管形成
血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)是VEGF家族的成员之一,是脑缺血后血管生成的重要生长因子,在梗死及梗死周围区域、远端皮层区域的表达升高[70]。VEGF及其受体在卒中低氧条件下激活,促进新生血管形成,增加受累组织供氧量及血流灌注,降低神经元凋亡率,进而缓解脑损伤程度。实验表明,丹参酮ⅡA磺酸钠20、40、80 μg/mL可以提高人脐静脉内皮细胞的细胞迁移能力,增加细胞小管生成结节点,并在体内研究中将海绵植入大鼠皮下持续2周,取出海绵后检测VEGFA的表达变化,发现丹参酮ⅡA磺酸钠4、12、16、24 mg/kg干预后其表达水平明显上调,说明其可促进血管新生[71]。还有研究发现丹参酮ⅡA1、2、5 mg/mL能显著增加人脐静脉融合细胞VEGF/ VEGF-2的表达,可能是其促血管新生的分子机制[72]。在以人脐静脉内皮细胞为模型的体外实验中发现,5 mg/L丹参脂溶性成分(二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA)能够以VEGFA和基质金属蛋白酶9为主要靶点阻滞内皮细胞的增殖、迁移和抑制血管新生。这项研究与其他实验的结果相悖,可能与实验模型及条件等多种因素相关,尚需更多研究的证实[73]。
3 结语
丹参酮类脂溶性化合物有83种,药理研究主要集中在丹参酮ⅡA、丹参酮ⅡB、丹参酮Ⅰ和隐丹参酮等,并以丹参酮ⅡA的相关研究最为丰富。丹参酮类脂溶性化合物可能通过抗凋亡、抗炎、调节自噬、限制谷氨酸兴奋性毒性、抑制氧化应激、促进新生血管形成保护缺血脑组织,减轻缺血缺氧后神经细胞损伤,缩小梗死面积。然而,缺血性脑卒中的病理机制复杂,各个环节互有重叠、相互影响,丹参酮类脂溶性成分的机制研究零散,未来可针对脑卒中动态级联反应中涉及的病理过程进行系统研究。另外,丹参酮ⅡA以外的其他丹参酮类脂溶性化合物的机制研究相对缺乏,仍需进一步完善。
利益冲突 所有作者均声明不存在利益冲突
[1] GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990-2016: A systematic analysis for the Global Burden of Disease Study 2016 [J]., 2019, 18(5): 439-458.
[2] 王陇德, 刘建民, 杨弋, 等. 我国脑卒中防治仍面临巨大挑战: 《中国脑卒中防治报告2018》概要 [J]. 中国循环杂志, 2019, 34(2): 105-119.
[3] Campbell B C V, De Silva D A, Macleod M R,. Ischaemic stroke [J]., 2019, 5(1): 70.
[4] Muoio V, Persson P B, Sendeski M M. The neurovascular unit-concept review [J]., 2014, 210(4): 790-798.
[5] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2018 [J]. 中华神经科杂志, 2018, 51(9): 666-682.
[6] 任雨贺, 田静, 刘淑莹, 等. 2015年版《中国药典》(一部)含丹参成方制剂的归类分析 [J]. 中成药, 2018, 40(12): 2770-2775.
[7] 万新焕, 王瑜亮, 周长征, 等. 丹参化学成分及其药理作用研究进展 [J]. 中草药, 2020, 51(3): 788-798.
[8] Ansari M A, Khan F B, Safdari H A,. Prospective therapeutic potential of tanshinone IIA: An updated overview [J]., 2021, 164: 105364.
[9] Wang N, Luo H W, Niwa M,. A new platelet aggregation inhibitor from[J]., 1989, 55(4): 390-391.
[10] Lin H C, Chang W L. Diterpenoids from[J]., 2000, 53(8): 951-953.
[11] Chang H M, Cheng K P, Choang T F,. Structure elucidation and total synthesis of new tanshinones isolated fromBunge (Danshen) [J]., 1990, 55(11): 3537-3543.
[12] Onitsuka M, Fujiu M, Shinma N,. New platelet aggregation inhibitors from Tan-Shen;ofBunge [J]., 1983, 31(5): 1670-1675.
[13] Li H B, Chen F. Preparative isolation and purification of salidroside from the Chinese medicinal plantby high-speed counter-current chromatography [J]., 2001, 932(1/2): 91-95.
[14] Ma Z J, Zhang M, Song Z H. Characterization of tanshinones with quinone reductase induction activity fromby liquid chromatography/ tandem mass spectrometry [J]., 2009, 23(18): 2857-2866.
[15] Don M J, Shen C C, Syu W J,. Cytotoxic and aromatic constituents from[J]., 2006, 67(5): 497-503.
[16] Luo H W, Wu B J, Wu M Y,. Pigments from[J]., 1985, 24(4): 815-817.
[17] Yu X Y, Lin S G, Zhou Z W,. Tanshinone IIB, a primary active constituent from, exhibits neuro-protective activity in experimentally stroked rats [J]., 2007, 417(3): 261-265.
[18] Wang X H, Morris-Natschke S L, Lee K H. New developments in the chemistry and biology of the bioactive constituents of tanshen [J]., 2007, 27(1): 133-148.
[19] Ryu S, No Z, Kim S,. Two novel abietane diterpenes from[J]., 1997, 63(1): 44-46.
[20] 杨保津, 钱名堃, 秦国伟, 等. 丹参有效成分的研究—V.紫丹参甲素和乙素的分离和化学结构 [J]. 药学学报, 1981, 16(11): 837-841.
[21] Nagy G, Günther G, Máthé I,. Diterpenoids from,,androots [J]., 1999, 52(6): 1105-1109.
[22] Lin H C, Chang W L, Chen C. Phytochemical and pharmacological study on(VI)-cytotoxic activity of tanshinones [J]., 1995, 47(1): 77-80.
[23] Ikeshiro Y, Mase I, Tomita Y. Abietane type diterpenoids from[J]., 1989, 28(11): 3139-3141.
[24] Lin H C, Chang W L. Phytochemical and pharmacological study on(I) isolation of new tanshinones [J]., 1991, 43(1): 11-17.
[25] Li Y G, Song L, Liu M,. Advancement in analysis ofet(Danshen) [J]., 2009, 1216(11): 1941-1953.
[26] 刘静, 戴忠, 王钢力, 等. 丹参活性成分及相关分离分析方法研究进展 [J]. 中国实验方剂学杂志, 2012, 18(11): 288-295.
[27] Sun A L, Zhang Y Q, Li A F,. Extraction and preparative purification of tanshinones fromBunge by high-speed counter-current chromatography [J]., 2011, 879(21): 1899-1904.
[28] Kuo Y H, Wu C H. Synthesis of 5-(3-hydroxypropyl)-7-methoxy-2-(3′-methoxy-4′-hydroxyphenyl)-3-benzo[b] furancarbaldehyde, a novel adenosine A1 receptor ligand from the root of[J]., 1996, 59(6): 625-628.
[29] Lin H C, Ding H Y, Chang W L. Two new fatty diterpenoids from[J]., 2001, 64(5): 648-650.
[30] Yang M, Liu A, Guan S,. Characterization of tanshinones in the roots of(Dan-Shen) by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry [J]., 2006, 20(8): 1266-1280.
[31] Lee A R, Wu W L, Chang W L,. Isolation and bioactivity of new tanshinones [J]., 1987, 50(2): 157-160.
[32] Han Y M, Oh H, Na M,. PTP1B inhibitory effect of abietane diterpenes isolated from[J]., 2005, 28(9): 1795-1797.
[33] Danheiser R L, Casebier D S, Loebach J L. Total synthesis of Dan Shen diterpenoid quinones [J]., 1992, 33(9): 1149-1152.
[34] 罗厚蔚, 吴葆金, 吴美玉, 等. 丹参新醌丁的分离与结构测定 [J]. 药学学报, 1985, 20(7): 542-544.
[35] Dat N T, Jin X, Lee J H,. Abietane diterpenes frominhibit the activation of hypoxia-inducible factor-1 [J]., 2007, 70(7): 1093-1097.
[36] Lu X Z, Luo H W, Masatake N. Trijuganone A and B: Two new phenanthrenequinones from roots of[J]., 1990, 56(1): 87-88.
[37] Wang X H, Bastow K F, Sun C M,. Antitumor agents. 239. isolation, structure elucidation, total synthesis, and anti-breast cancer activity of neo-tanshinlactone from[J]., 2004, 47(23): 5816-5819.
[38] Don M J, Shen C C, Lin Y L,. Nitrogen-containing compounds from[J]., 2005, 68(7): 1066-1070.
[39] Li X, Xu X, Wang J,. A system-level investigation into the mechanisms of Chinese traditional medicine: Compound Danshen Formula for cardiovascular disease treatment [J]., 2012, 7(9): e43918.
[40] Asari F, Kusumi T, Zheng G Z,. Cryptoacetalide and epicryptoacetalide, novel spirolactone diterpenoids from[J]., 1990, 19(10): 1885-1888.
[41] Kusumi T, Ooi T, Hayashi T,. A diterpenoid phenalenone from[J]., 1985, 24(9): 2118-2120.
[42] Ginda H, Kusumi T, Ishitsuka M O,. Salviolone, a cytotoxic bisnorditerpene with a benzotropolone chromophore from a Chinese drug Dan-Shen () [J]., 1988, 29(36): 4603-4606.
[43] 张义平, 陈鸿雁, 程伟贤, 等. 云南丽江丹参化学成分研究 [J]. 中药材, 2008, 31(2): 226-229.
[44] 张艾嘉, 王爽, 王萍, 等. 缺血性脑卒中的病理机制研究进展及中医药防治 [J]. 中国实验方剂学杂志, 2020, 26(5): 227-240.
[45] Mo Y, Sun Y Y, Liu K Y. Autophagy and inflammation in ischemic stroke [J]., 2020, 15(8): 1388-1396.
[46] Liu J, Guo Z N, Yan X L,. Crosstalk between autophagy and ferroptosis and its putative role in ischemic stroke [J]., 2020, 14: 577403.
[47] Chen R L, Balami J S, Esiri M M,. Ischemic stroke in the elderly: An overview of evidence [J]., 2010, 6(5): 256-265.
[48] Radak D, Katsiki N, Resanovic I,. Apoptosis and acute brain ischemia in ischemic stroke [J]., 2017, 15(2): 115-122.
[49] Zhou L, Bondy S C, Jian L,. Tanshinone IIAattenuates the cerebral ischemic injury-induced increase in levels of GFAP and of caspases-3 and-8 [J]., 2015, 288: 105-111.
[50] 赵丽萍, 张琳成, 陈冰, 等. 丹参酮IIA对脑缺血再灌注损伤大鼠神经保护作用的研究 [J]. 中华中医药学刊, 2019, 37(9): 2082-2085.
[51] 李浩, 刘开祥, 俸军林, 等. 丹参酮IIA对鼠脑缺血再灌注损伤Bcl-2和Caspase-3表达的影响 [J]. 中国康复医学杂志, 2008, 23(8): 691-693.
[52] Yu X Q, Xue C C, Zhou Z W,. Tanshinone IIB, a primary active constituent from, exerts neuroprotective effect via inhibition of neuronal apoptosis[J]., 2008, 22(6): 846-850.
[53] Zhao H, Zheng T, Yang X,. Cryptotanshinone attenuates oxygen-glucose deprivation/recovery-induced injury in anmodel of neurovascular unit [J]., 2019, 10: 381.
[54] 周亮. 丹参酮抑制脑梗死大鼠模型中的神经元细胞凋亡和炎症反应的实验研究 [D]. 济南: 山东大学, 2018.
[55] 冯晶晶, 李铁军, 章越凡. 丹参酮IIA对脑缺血后炎性反应影响机制的研究进展 [J]. 药学实践杂志, 2018, 36(2): 108-111.
[56] 蔡琳, 易小波, 袁利邦, 等. 丹参酮IIA通过NLRP3炎症体信号通路对小胶质细胞糖氧剥夺/再灌注损伤的保护作用 [J]. 四川大学学报: 医学版, 2016, 47(5): 660-664.
[57] Zhou L, Zhang J, Wang C,. Tanshinone inhibits neuronal cell apoptosis and inflammatory response in cerebral infarction rat model [J]., 2017, 30(2): 123-129.
[58] Liu X, Ye M, An C,. The effect of cationic albumin-conjugated PEGylated tanshinone IIAnanoparticles on neuronal signal pathways and neuroprotection in cerebral ischemia [J]., 2013, 34(28): 6893-6905.
[59] 胡霞敏, 周密妹, 胡先敏, 等. 丹参酮IIA预防性给药对脑缺血/再灌注损伤炎症反应的影响[J]. 中国药理学通报, 2006, 22(4): 436-440.
[60] Zhang Y, Miao J M. Ginkgolide K promotes astrocyte proliferation and migration after oxygen-glucose deprivation via inducing protective autophagy through the AMPK/mTOR/ULK1 signaling pathway [J]., 2018, 832: 96-103.
[61] 徐璇, 汤其强. 丹参酮IIA对大鼠脑缺血后PTEN-PI3K/AKT/mTOR信号通路的影响 [J]. 安徽医科大学学报, 2020, 55(11): 1706-1709.
[62] Wang L, Xiong X, Zhang X,. Sodium tanshinone IIAsulfonate protects against cerebral ischemia-reperfusion injury by inhibiting autophagy and inflammation [J]., 2020, 441: 46-57.
[63] 朱波, 杨艳, 苏仁意, 等. 丹参酮IIA注射液对缺血缺氧性脑损伤新生大鼠皮质神经元自噬及Akt-mTOR通路的影响 [J]. 中国中医急症, 2019, 28(2): 204-208.
[64] 何治, 潘志红, 鲁文红. 丹参酮IIA对局灶性脑缺血大鼠的神经保护作用及其机制初探 [J]. 中药药理与临床, 2009, 25(5): 32-34.
[65] 蔡青, 张伯礼, 黄淑芸, 等. 丹参酮B钠盐对局灶性脑缺血/再灌注损伤大鼠海马神经递质含量的影响 [J]. 天津中医药, 2010, 27(6): 486-489.
[66] Lin T Y, Lu C W, Huang S K,. Tanshinone IIA, a constituent of Danshen, inhibits the release of glutamate in rat cerebrocortical nerve terminals [J]., 2013, 147(2): 488-496.
[67] Chamorro Á, Dirnagl U, Urra X,. Neuroprotection in acute stroke: Targeting excitotoxicity, oxidative and nitrosative stress, and inflammation [J]., 2016, 15(8): 869-881.
[68] Huang Y, Long X, Tang J,. The attenuation of traumatic brain injury via inhibition of oxidative stress and apoptosis by tanshinone IIA[J]., 2020, 2020: 4170156.
[69] 同思雅. 丹参酮IIA磺酸钠对缺血性脑卒中模型大鼠神经保护作用及机制研究 [D]. 西安: 西安医学院, 2020.
[70] Stowe A M, Plautz E J, Nguyen P,. Neuronal HIF-1 alpha protein and VEGFR-2 immunoreactivity in functionally related motor areas following a focal M1 infarct [J]., 2008, 28(3): 612-620.
[71] 苏梅, 秦引林, 娄雅静, 等. 丹参酮IIA磺酸钠体内外促血管新生作用的研究 [J]. 现代药物与临床, 2019, 34(4): 934-940.
[72] 郝栋. 丹参酮IIA促血管新生作用的实验研究 [D]. 武汉: 华中科技大学, 2012.
[73] 范雪梅, 任桂香, 梁琼麟, 等. 丹参脂溶性成分抑制体外血管新生及机制研究 [J]. 中国中药杂志, 2014, 39(4): 744-747.
Research progress on liposoluble constituents of tanshinone and their intervention mechanisms in ischemic stroke
WANG Zhe-yi1, 2, 3, 4, SUN Yi-ze2, DENG Xin-qi3, WANG Chun-guo2, TIAN Jin-zhou4, LU Tao3
1. Qilu Hospital, Shandong University, Jinan 250012, China 2. Beijing University of Chinese Medicine, Beijing 100029, China 3. School of Life Science, Beijing University of Chinese Medicine, Beijing 100029, China 4. Dongzhimen Hospital of Beijing University of Chinese Medicine, Beijing 100010, China
Ischemic stroke is a central nervous system disease that causes irreversible damage to the ischemic focus due to the obstruction of blood supply to the brain. It has a sudden onset, rapid transmission, and complex course. Intravenous thrombolysis and intravascular intervention are the main measures for early intervention. However, the time window and contraindications restrict its application. Danshen (et) is a traditional Chinese medicine of the motherland. Liposoluble constituents of tanshinone have a definite curative effect in treatment of ischemic stroke and are widely used in clinical practice. The possible mechanisms of tanshinone compounds intervention in ischemic stroke are summarized in this paper, including anti-apoptosis, anti-inflammation, regulating autophagy, limiting glutamate excitotoxicity, inhibiting oxidative stress, promoting neovascularization, etc., in order to provide a certain reference for clinical application.
et; ischemic stroke; tanshinone IIA; tanshinone IIB; tanshinone I; implicit tanshinone; anti-apoptosis; anti-inflammation; regulating autophagy
R282.710.5
A
0253 - 2670(2022)04 - 1181 - 10
10.7501/j.issn.0253-2670.2022.04.027
2021-07-20
北京市双一流高层次人才科研资助项目(1000041510053)
王哲义(1991—),男,博士研究生,研究方向为复杂性疾病的研究。E-mail: zheyi91@126.com
卢 涛(1968—),男,博士,研究方向为复杂性疾病的研究。E-mail: taolu@bucm.edu.cn
田金洲(1956—),男,博士,研究方向为神经变性病的中医药防治。E-mail: jztian@hotmail.com
[责任编辑 崔艳丽]

