A152G突变对GH43家族麦氏交替单胞菌木聚糖酶XynZT-2的影响
徐佳,高廷,杨彦博,刘永辉,田艳杰,崔彩霞,郭长江*,周晨妍*
1(新乡医学院 生命科学技术学院,河南 新乡,453003) 2(新乡医学院 三全学院,河南 新乡,453003)
木聚糖是植物半纤维素的主要成分,是一种仅次于纤维素的可再生资源[1]。木聚糖酶是一类包括β-1,4-内切木聚糖酶和β-木糖苷酶的酶系[2],广泛存在于自然界的细菌[3]、真菌[4]、动植物等多种生物中[5]。β-木糖苷酶是木聚糖酶的一种[6],根据氨基酸的序列相似性,含有此酶活性的糖苷水解酶家族包括GH5、GH43等[7]。由于海洋特殊的环境,海洋微生物有较独特的代谢系统,是新物种、基因、药物及生物材料的主要来源[8]。近年来,对海洋来源的木聚糖酶的研究日益增多[9]。
来自GH43家族的麦氏交替单胞菌是本实验室从山东烟台近海分离的细菌,无毒副作用,对环境无污染,除氮效果好,可作为去除水产养殖中无机氮的理想菌株[10]。本实验室从该菌基因组中分离到木聚糖酶基因xynZT-2(GenBank登陆号:MT814836),前期研究发现它属于GH43家族成员。目前,对于木聚糖酶的分子改造主要有酶活性、热稳定性[11]、底物特异性[12]等方面,且研究多集中于GH10、GH11家族,对GH43家族的分子改造研究较少。为探索保守位点区域的突变对木聚糖酶功能的影响,本研究对GH43家族木聚糖酶XynZT-2保守位点区域的第152个氨基酸位点丙氨酸进行分子改造,在获得突变基因xynZT-2A152G后,将其在大肠杆菌中异源表达,研究重组突变酶与原酶的酶学性质差异,为该酶结构研究做出理论支撑。
1 材料与方法
1.1 材料与仪器
麦氏交替单胞菌、大肠杆菌 BL21(DE3)、质粒pET28a,本实验室保存;DL2000 DNA Marker、蛋白质Marker、限制性内切酶、T4 DNA 连接酶及IPTG,TaKaRa 公司;DNA 质粒小量抽提试剂盒、卡那霉素(Kan)、DNA胶回收试剂盒,上海生工生物工程有限公司;桦木木聚糖,Sigma 公司;其余生化试剂均为国产分析纯产品。PCR扩增仪,美国 Bio-Rad公司;其余均为国产仪器。
1.2 同源序列比对以及同源建模
在GenBank中通过BLAST查询xynZT-2的同源基因序列,序列的同源性比较及核苷酸序列分析利用DNAMAN9.0软件处理。翻译为氨基酸序列后,在NCBI上,通过blastp查询麦氏交替单胞菌氨基酸相似序列,MEGA软件进行序列比对。酶的三维结构采用Swiss-model同源建模。
1.3 引物设计
根据麦氏交替单胞菌基因组及载体pET-28a的多克隆位点,设计引物:
A152G-F:5′CCGGGCGTTTTCGAAGACGAT 3′;
A152G-R:5′AACGCCCGGATCGATGCTGTA 3′;
ZT-2-F:5′GGAAGAATTCATGCCGGAGAAACAGT 3′(EcoRⅠ酶切位点);
ZT-2-R:5′CCCAAGAAGCTT TTATTCAACGCGGAC 3′(Hind Ⅲ 酶切位点)
送至金唯智生物公司合成。
1.4 突变基因的获得
采用重叠延伸PCR法,从麦氏交替单胞菌基因组上获得木聚糖酶基因xynZT-2,以xynZT-2为模板,引物ZT-2-F、A152G-R、A152G-F、ZT-2-R各0.5 μL,dNTP 2 μL,ddH2O 16.5 μL,高保真Taq酶0.5 μL,分别获得上下段。再以含突变点的上下段为模板,突变点ZT-2-F、ZT-2-R为引物,其他条件不变,获得突变后的基因序列xynZT-2A152G,构建pET-28a-xynZT-2,pET-28a-xynZT-2A152G,琼脂糖凝胶电泳后,割胶回收。
1.5 重组工程菌的构建
用限制性内切酶EcoRⅠ、Hind Ⅲ双酶切xynZT-2、突变基因xynZT-2A152G和空质粒pET-28a,反应条件37 ℃、2.5 h,对双酶切产物进行切胶回收。T4 DNA连接酶连接双酶切产物,转化大肠杆菌BL21(DE3),涂布至含Kan抗性的 LB 固体培养基上,经检测验证后的阳性菌落,即为成功构建的重组大肠杆菌BL21/xynZT-2及BL21/xynZT-2A152G。
1.6 重组目的基因的表达
将重组大肠杆菌目的菌株过夜培养(pET-28a转化菌株作为对照菌株,同步培养),取1 mL 菌液接种于含Kan的100 mL LB 液体培养基中,放入37 ℃培养箱,220 r/min 培养至OD600为0.6时,加 IPTG 进行诱导,24 ℃诱导培养12 h后,离心得到菌体。将沉淀用5 mL Na2HPO4-NaH2PO4(pH 6.0) 缓冲液悬浮,超声波破碎,离心得到的上清液为粗酶液。
1.7 重组酶的纯化
对含His标签的原酶及突变酶,采用镍金属螯合的亲和层析柱纯化,收集洗脱过的样品液,即为原酶XynZT-2和突变酶XynZT-2A152G,运用SDS-PAGE蛋白电泳检测[13]。
1.8 重组木聚糖酶活力测定
运用DNS法[14]。1 mL酶液与1.5 mL的桦木木聚糖底物(体积分数为0.5%),在50 ℃反应15 min,1 min得到1 μmol还原糖需要的酶量即为1个酶活力单位。
1.9 重组酶酶学性质分析
分别在温度为35~60 ℃、pH 3.0~9.0处,测定突变酶XynZT-2-A152G与原酶XynZT-2最适温度、温度稳定性[15]、最适pH及pH稳定性[16]。
2 结果与分析
2.1 木聚糖酶同源序列比对及突变位点的选择
GH43家族木聚糖酶基因编码的蛋白质有5组β-折叠片层,5组β-折叠片层围绕着中心轴腔,形成典型的圆桶形结构[17]。选取blastp上查询的与麦氏交替单胞菌GH43家族木聚糖酶相似性>75%的同源蛋白序列,序列比对后,对第3组折叠片处的活性中心序列进行分析(表1),发现活性中心关键氨基酸天冬氨酸(D)和脯氨酸(P)后保守区域位点存在丙氨酸(A)和甘氨酸(G) 2种氨基酸。序列分析显示,在GH43家族相关物种中,保守位点区域对应氨基酸多数为Ala,仅有Luteimonassp.LNNU 24178突变为Gly。本研究选择麦氏交替单胞菌木聚糖酶XynZT-2第3组β折叠片层上第152位氨基酸Ala进行改造,突变为Gly(图1)。

表1 木聚糖酶XynZT-2的同源序列比对Table 1 Homologous sequence comparison of xylanase XynZT-2
2.2 重组工程菌的构建
从基因组上获得木聚糖酶基因xynZT-2(图2),以xynZT-2为模板,运用重叠延伸PCR法[18],得到突变基因上下段(图3-a、图3-b)及突变基因xynZT-2A152G(图3-c),突变基因经酶切、连接、转化后,获得麦氏交替单胞菌重组工程菌BL21/xynZT-2及BL21/xynZT-2A152G。
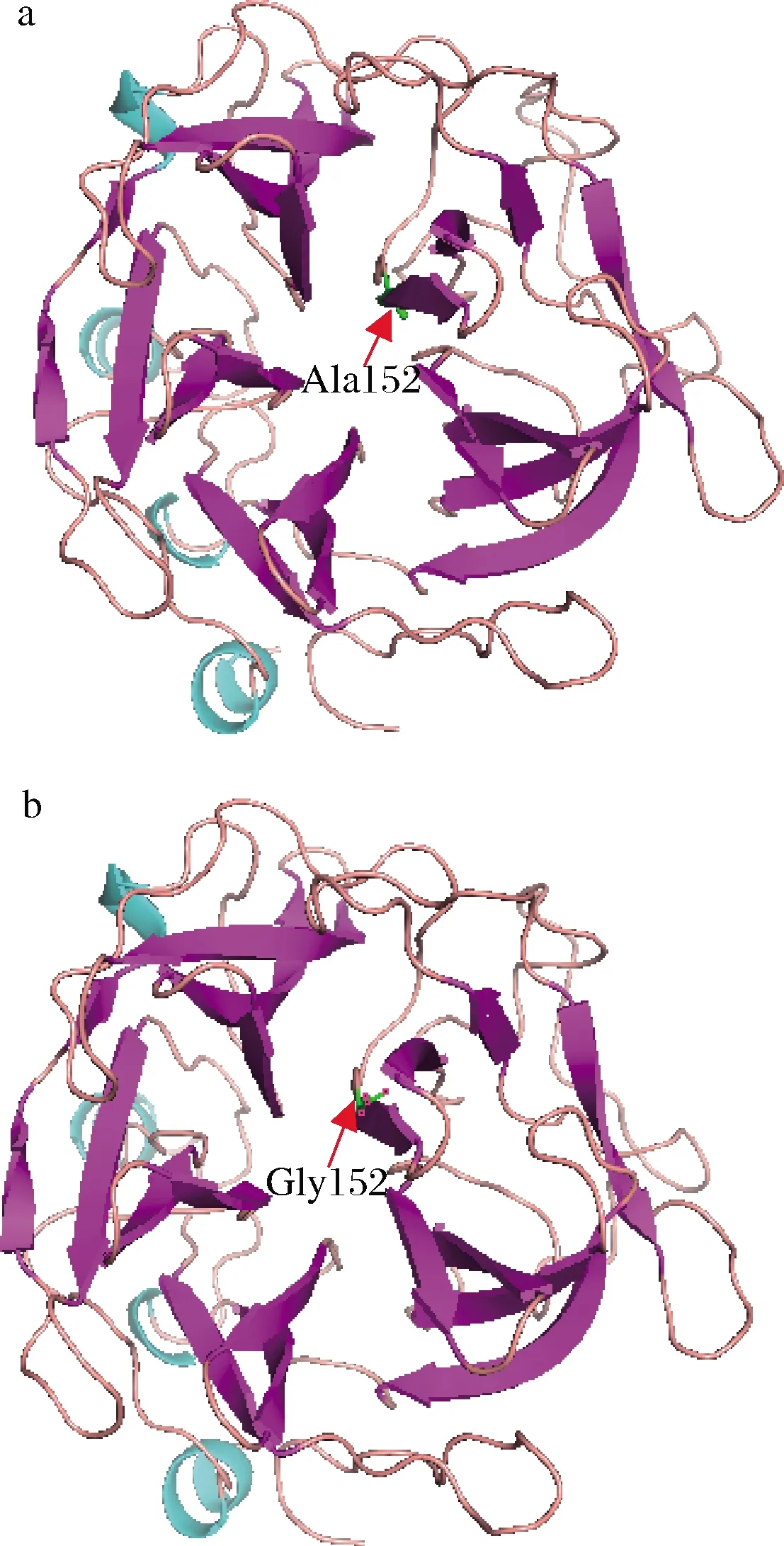
蓝色-a-螺旋;紫色-β-折叠;粉色-无规卷曲; 绿色-突变的氨基酸位点(红色箭头处) a-XynZT-2的三维结构;b-XynZT-2A152G的三维结构图1 XynZT-2和XynZT-2A152G三维结构Fig.1 3D structure of XynZT-2 and XynZT-2A152G
M-marker;1-基因 xynZT-2图2 基因xynZT-2Fig.2 The xynZT-2 gene
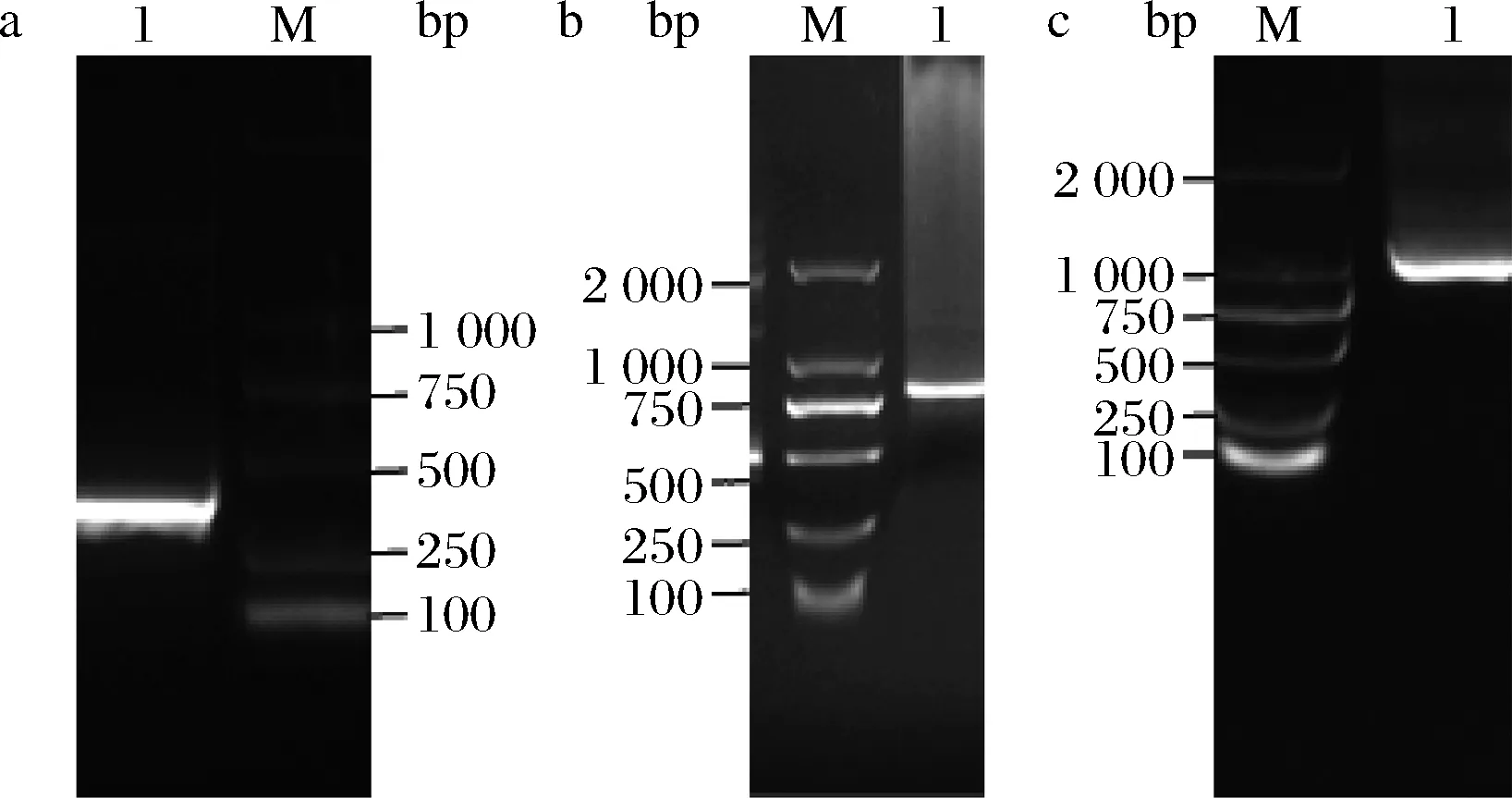
M-marker a-突变基因上段;b-突变基因下段;c-突变基因xynZT-2A152G图3 突变基因片段Fig.3 The fragment of the mutant gene
2.3 重组工程菌基因的验证
2.3.1 双酶切验证
双酶切验证从工程菌中提取的重组质粒如图4所示。结果显示,原酶与突变酶重组质粒pET8a-xynZT-2、pET8a-xynZT-2A152G双酶切后,在5 369和1 029 bp处均有2条目的条带,测序验证显示,与预期序列一致,表明重组工程菌得以成功构建。

M-marker;1-质粒pET8a-xynZT-2双酶切结果; 2-质粒pET8a-xynZT-2A152G双酶切结果图4 双酶切验证Fig.4 Identified by restriction enzyme digestion
2.3.2 突变体与原始酶的表达与纯化
为了验证突变体与原酶是否表达木聚糖酶,进行SDS-PAGE 凝胶电泳和酶活力测定。如图5所示,在 38.9 kDa 处,对照菌株无条带,纯化后的突变酶与原酶、突变酶粗酶液有相同且明显的目的条带,重组酶得以成功表达。重组突变菌BL21/xynZT-2A152G与重组菌BL21/xynZT-2均有酶活性(pH 6)(图6),提示重组菌能够产木聚糖酶,且突变位点不会抑制酶活力的产生。

M-marker;1-DE3-pET28a粗酶液;2-BL21/xynZT-2粗酶液; 3-BL21/xynZT-2A152G粗酶液;4-纯化的BL21/xynZT-2A152G图5 SDS-PAGE 凝胶电泳检测Fig.5 SDS-PAGE gel electrophoresis

图6 重组菌的酶活力Fig.6 Enzyme activity of the recombinant bacterias
2.4 酶学性质比较
2.4.1 最适温度
如图7所示,原酶XynZT-2最适温度45 ℃,突变酶XynZT-2A152G最适温度55 ℃。突变酶XynZT-2A152G比原酶XynZT-2有明显提高。说明保守位点附近的第152位氨基酸Ala突变为Gly,此突变使木聚糖酶最适温度得到提高。
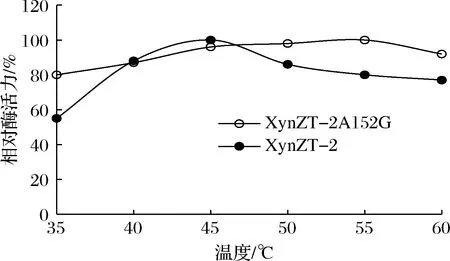
图7 突变酶与原酶的最适温度Fig.7 Optimal temperatures of original xylananse and mutant
2.4.2 最适pH
原酶最适pH为6.0,突变酶最适pH为7.0,二者差别不大(图8)。在pH 3.0~5.0处,突变酶相对酶活力<30%;在pH 7.0~9.0处,突变酶相对酶活力>80%,高于原酶,说明突变酶适宜偏碱性环境。
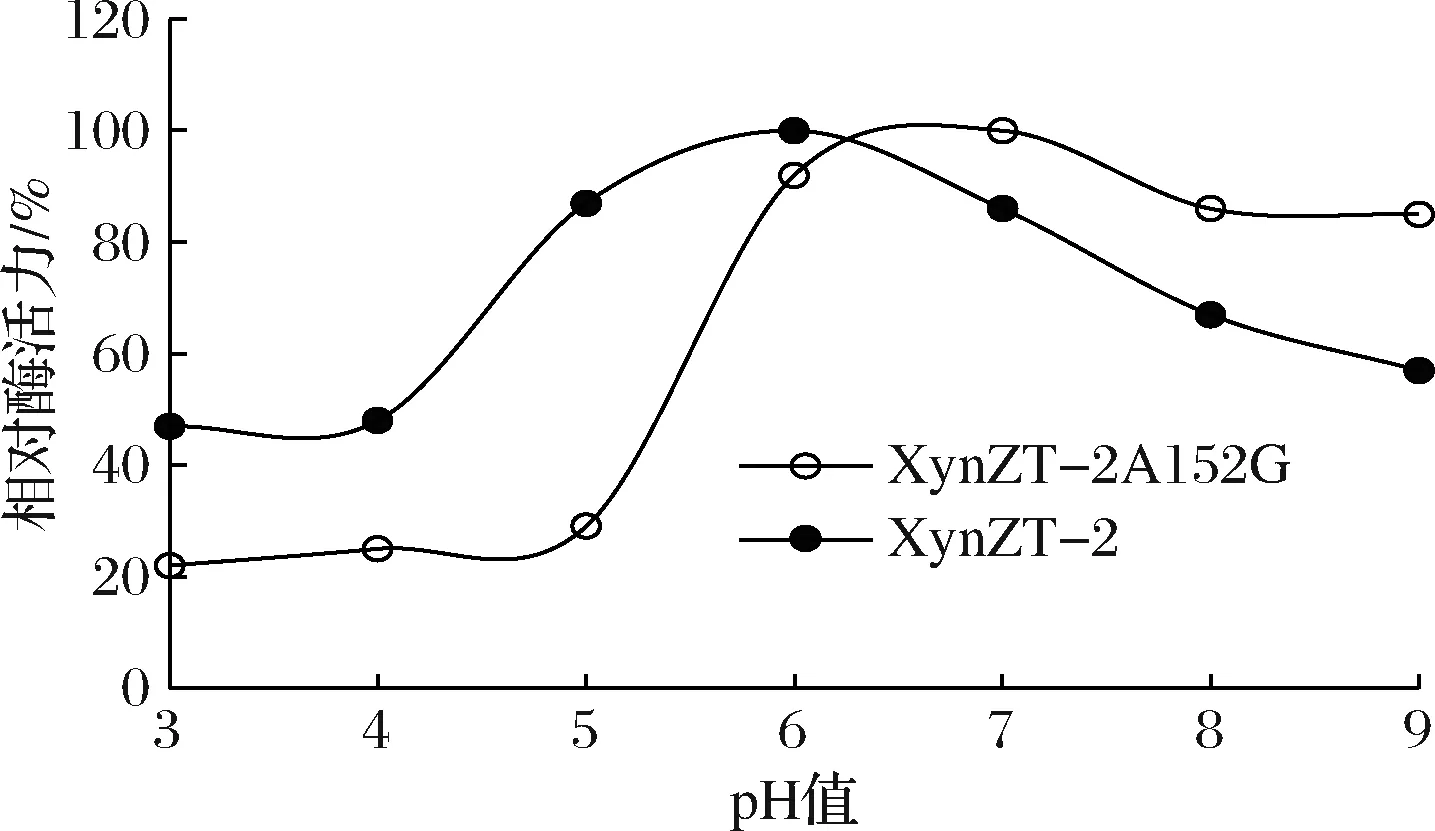
图8 突变酶与原酶的最适pHFig.8 Optimum pH of original xylananse and mutant
2.4.3 pH稳定性
突变酶在pH 3.0~7.0相对酶活力与原酶相差不大,在 pH 8.0~9.0酶活力均高于80%(图9),突变酶在碱性条件下比原酶稳定性更强。
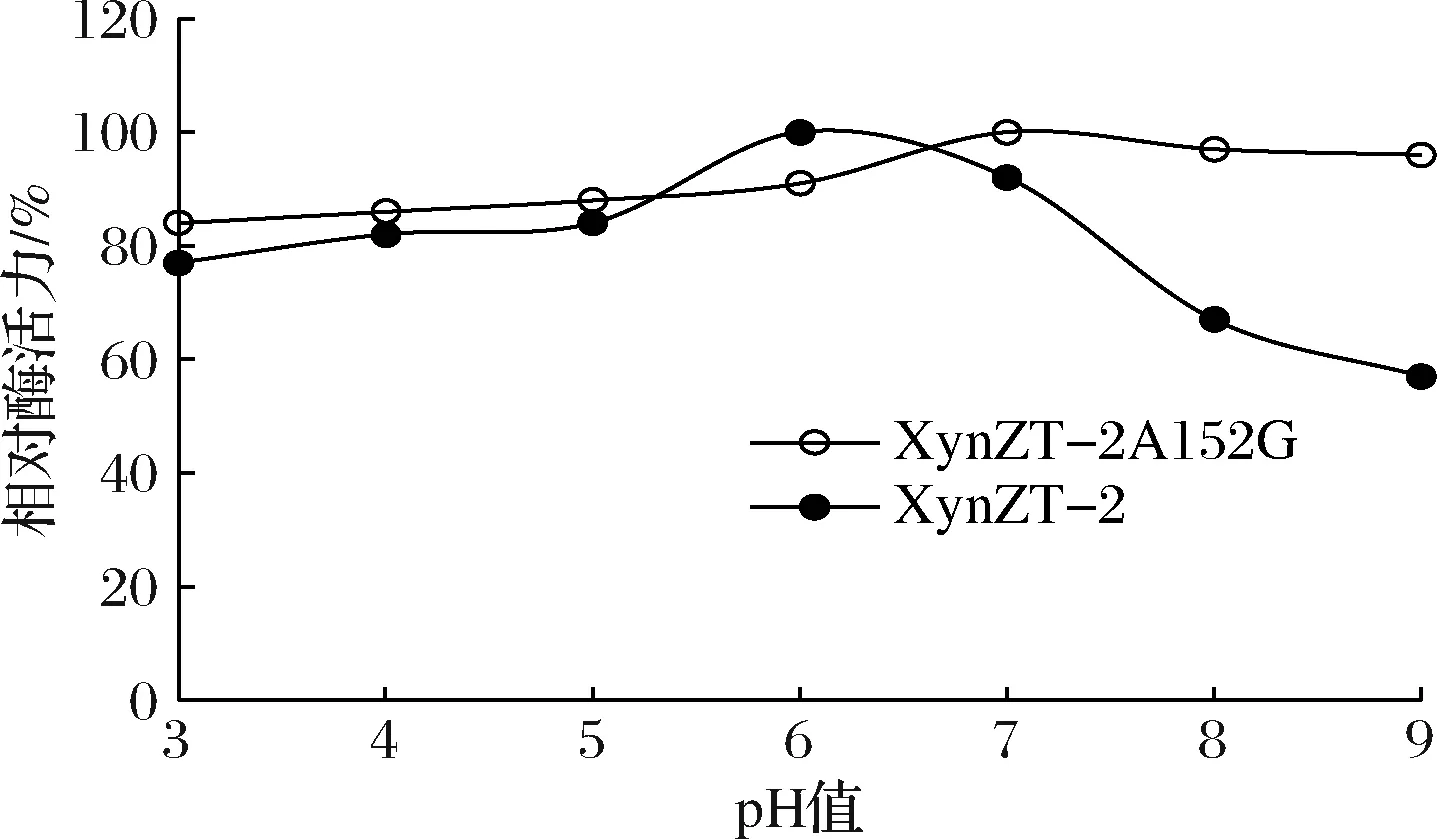
图9 pH稳定性Fig.9 pH stability of original xylananse and mutant
2.4.4 温度稳定性
在55和60 ℃,突变酶保温20 min以内,二者相对酶活力均有少许降低;保温20~60 min,突变酶相对酶活力均在80%以上,高于相对酶活力在70%以上的原酶(图10),说明突变酶在高温环境中,热稳定性较高。
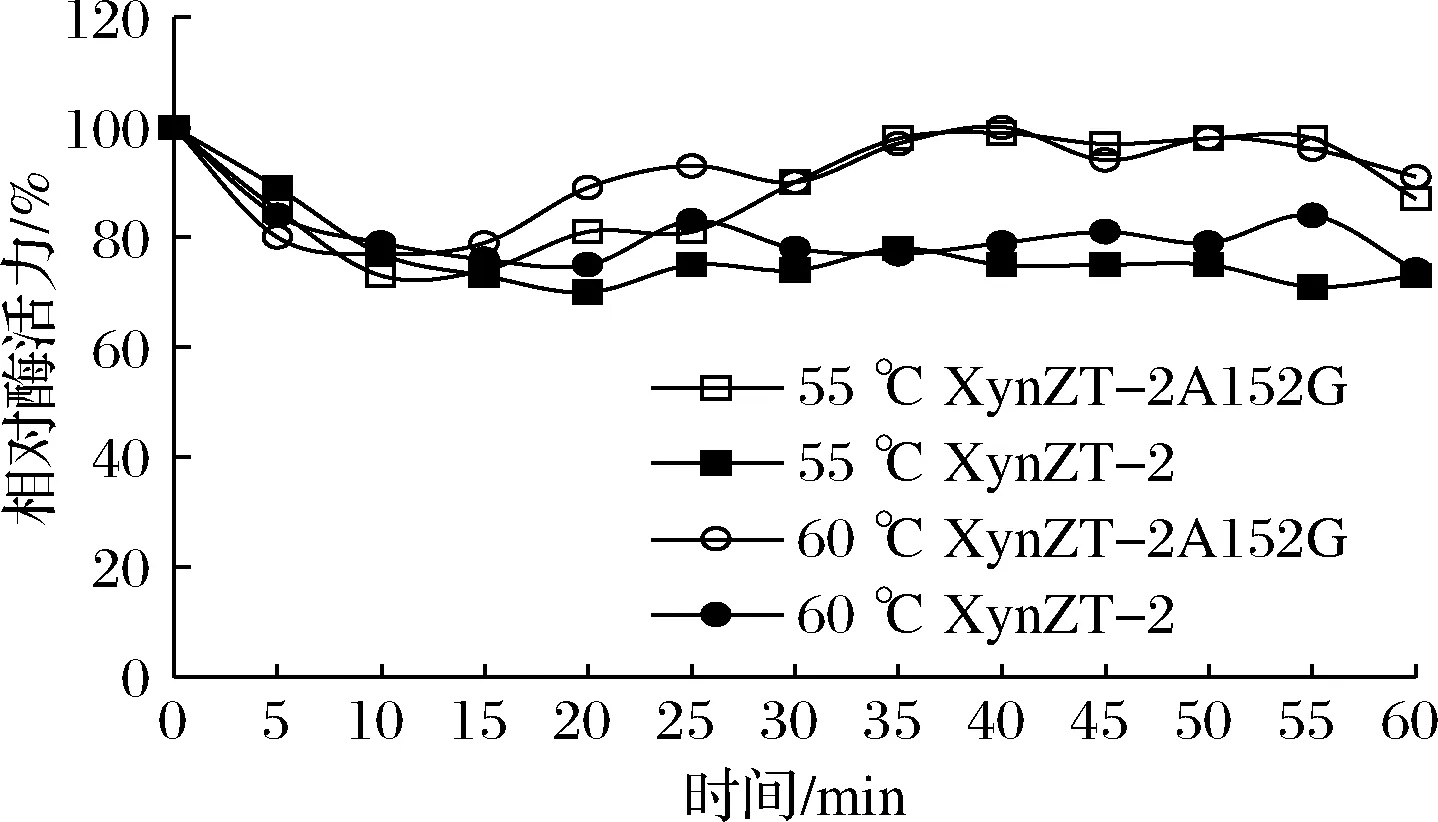
图10 原酶和突变酶的温度稳定性Fig.10 Temperature stability of original xylananse and mutant
3 讨论与结论
木聚糖在医疗卫生、食品化工等领域中有巨大应用潜力。低聚木糖是2~6个聚合度的木聚糖,不仅能在大肠内显著增加有益菌,改善肠道微环境,还能降低结直肠癌发病率[19]。木聚糖酶能催化β-1-4糖苷键水解,是生成低聚木糖的一种重要酶。工业生产需要较高热稳定性的木聚糖酶。自然界存在较少的产耐热木聚糖酶微生物,通过人工定点突变分子改造提高木聚糖酶热稳定性更为可行[20]。
通过分子改造木聚糖酶,在热稳定性方面已经取得显著成果。对木聚糖酶 Xyn A 第209位氨基酸进行定点突变,His突变为 Asn后,木聚糖酶热稳定性得到提升[21]。木聚糖酶Umxyn10A 的第31位氨基酸Ala替换为Phe后,热稳定性也得到显著提高[20]。GH43家族来源的木聚糖酶的3个与催化相关的残基及酶的中心Ca2+和组氨酸残基对酶活性的影响比较重要[22]。目前对GH43家族木聚糖酶分子改造的报道较少,本研究利用软件计算、随机突变及天然存在的突变对GH43家族麦氏交替单胞菌进行保守位点区域天然突变位点的引入,希望得到更适合工业生产的酶。分子改造后,突变酶比原酶在最适温度方面得以提高;55和60 ℃保温20~60 min,突变酶相对酶活力均在80%以上,丙氨酸突变为甘氨酸后,能使蛋白质更稳定[23],热稳定性也得到提高。在最适pH方面,pH为7.0~9.0时,突变酶相对酶活力为80%以上,而原酶相对酶活力在80%以上的pH为5.0~7.0,相比原酶适合中性及偏酸环境,突变酶则适宜中性及偏碱性环境;在 pH 8.0~9.0处,突变酶保温1 h后,相对酶活力仍高于80%,原酶则低于65%,表明在碱性条件下,突变酶比原酶pH稳定性更强。
本研究在已有GH43家族麦氏交替单胞菌木聚糖酶基因xynZT-2的基础上,通过序列分析和结构建模,对第152个氨基酸位点的丙氨酸进行同源位点替换,研究发现木聚糖突变酶XynZT-2A152G最适温度比原酶XynZT-2 提高了10 ℃;在酸碱度方面,木聚糖突变酶XynZT-2A152G在pH 8.0~9.0 较原酶更稳定,说明麦氏交替单胞菌木聚糖酶XynZT-2保守位点区域第3组β折叠片层上第152位氨基酸对酶结构及稳定性有重要的影响。

