重庆地区8个薄壳山核桃品种叶片光合生理测定分析
何惠川,何丙辉,刘玉民,陈 林,李 薇,吴耀鹏,毕贇斐
(1.西南大学 资源环境学院,重庆 400715;2.重庆綦江区林业局,重庆 401420)
光合作用是植物生长发育的基础,光合参数能够有效反映植物潜在的光合能力[1-2]。叶片的一些形态学、生理学参数能够表征植物光合能力强弱,并且与植物健壮程度紧密关联,是植物适应外界变化所形成的生存机制的表现[3]。植物最大净光合速率,暗呼吸速率,单位质量叶片氮、磷、钾含量,单位面积叶片干物质量是体现全球叶片生存适应策略的核心性状[4]。植物主要通过调整与权衡叶片相关指标来优化叶片构型模式以此提高植物的生态系统功能[5],植物叶片核心性状之间的协同作用是长期自然选择的结果。研究表明,不同植物种群、群落、生态系统中植物叶片的核心特征具有相似关系[6]。例如,植物光合生理活性在种间的差距与叶片中积累的氮素密不可分[7],植物光合作用氮素利用效率与叶片比叶面积存在稳定的正相关关系[8]。一般来说,叶片比叶质量低、最大净光合速率高、氮高的植物能以较小的资源投入获得较大的碳同化能力,并且植物具有较大的生长潜能[9]。因此,研究植物叶片资源分配情况,对于揭示植物的光合应用潜力及生态适应性尤为重要。
薄壳山核桃Carya illinoensis原产于北美地区,是世界著名的干果油料树种。我国引种薄壳山核桃已有百年历史,引种范围较广,近年来有关研究主要集中在生长动态、营养变化、光合特性等方面[10-12]。作为引进重庆的林果树种,量化多个植物叶片相关指标从而比较植物的生长策略与适应机制有利于薄壳山核桃的良种选择。为此,本研究以8 个薄壳山核桃品种作为试验材料,测定光响应、CO2响应曲线,并对叶片养分(氮、磷、钾)含量、叶绿素含量及光合氮分配等生化指标进行分析,比较不同品种的光合能力及生理适应性差异,探讨叶片相关指标对光合生理的影响,以期为薄壳山核桃栽培及选育利用提供参考。
1 材料与方法
1.1 试验材料
试验地点位于重庆市綦江区永新镇(28.99°N,106.50°E),海拔460~480 m,西南坡向,坡度10.2°,属于亚热带季风性湿润气候。该地区年均气温17.5℃,年均降水量为1 037.3 mm,土壤类型为山地黄壤。供试材料为中国林科院亚林所新选育或收集的5年生薄壳山核桃新品种,分别为‘YLC12’‘YLC13’‘YLJ042’‘YLC29’‘YLC10’‘YLC35’‘YLJ5’‘Mahan’,于2017年栽植于试验地,各品种随机区组排列,株行距4 m×4 m,3 次重复。供试材料适时灌溉、除草,树体长势良好。
1.2 试验方法
1.2.1 光合参数的测定
于2020年8月中旬晴朗天气下9:00—11:30进行气体交换参数的测定。每一品种选择长势一致、生长健康的树木,测量复叶从下数第2 或第3 对叶片,并做好标记。采用Li-6800 便携式光合仪(美国Li-cor 公司)测定薄壳山核桃叶片的光合参数,参比室温度控制为30℃左右,相对湿度约为55%,待叶片活化完成后测定光响应曲线和CO2响应曲线。测定光响应曲线时,CO2浓度为400 μmol·mol-1,光合有效辐射强度(PAR)共设置11 个梯度(0、20、50、80、100、200、300、600、1 000、1 500、2 000 μmol·m-2s-1);测定CO2响应曲线时,叶室光强设为饱和光强,CO2浓度共设置11个梯度(400、300、200、100、50、400、600、800、1 000,1 200,1 500 μmol·mol-1)。植物CO2响应曲线、光响应曲线均使用Photosynthesis 光合助手拟合,并计算出最大净光合速率(Pmax)、光饱和点(LSP)、光补偿点(LCP)、暗呼吸速率(Rd)、最大羧化速率(Vcmax)、最大光合电子传递速率(Jmax)、最大磷酸丙糖利用速率(TPU)等光合特征参数[13]。
1.2.2 比叶重和养分含量的测定
光合测定完成后,采集标记叶片及周围健康叶片,利用智能叶面积测量系统(浙江托普云农科技公司)测定每片叶的叶面积,随后将叶片杀青烘干至恒质量。比叶重(SLW)=干质量(g)/叶面积(m2)。将烘干的叶片粉碎后,采用半微量凯氏定氮法、钼锑抗比色法和火焰光度法分别测定单位质量叶氮(Nmass)、叶磷(Pmass)和叶钾(Kmass)含量。光合氮素利用效率(PNUE)=Pmax/Nmass;光合磷素利用效率(PPUE)=Pmax/Pmass[7]。
1.2.3 叶绿素含量的测定
称取0.02 g 鲜叶片浸入盛有10 mL 提取液(80%丙酮)的离心管中,暗处理使叶片变白后,使用 Spectrumlab22ke 可见分光光度计测定样品叶绿素(Chl)含量[14]。
1.2.4 叶片光合器官中的氮分配
光合系统中的氮分配比例可划分为三部分:Rubisco、生物力能组分以及捕光组分氮分配比例[15],其各部分氮分配比例的计算方法分别如下:

式中:CC为叶绿素含量;Vcr(Rubisco 的比活度)、Jmc(以细胞色素f 为基础的最大电子传递速率)和CB(结合PS Ⅰ、PS Ⅱ和LHC Ⅱ中的叶绿素)为常数;6.25 是氮转换为蛋白的系数;8.06 为氮素与细胞色素f 之间的转换系数。
1.3 数据分析
利用Excel 和SPSS 25.0 软件统计分析数据。显著性检验采用单因素方差分析(ANOVA),相关显著性检验采用Pearson 相关分析。利用Origin 2018 软件作图。
2 结果与分析
2.1 薄壳山核桃光响应和CO2 响应参数
由图1可知,8 个薄壳山核桃品种Pn-PAR 变化趋势相似。当PAR 为0~500 μmol·m-2s-1时,随着PAR 的增大各品种叶片净光合速率增加很快;当PAR 为500~1 500 μmol·m-2s-1时,随着PAR 的增大,各品种叶片净光合速率增幅逐渐减小,Pn-PAR 变化较为平缓;当PAR>1 500 μmol·m-2s-1时,随着PAR 的增大,‘YLC13’‘YLC29’‘YLC35’‘Mahan’叶片净光合速率呈现微弱上升趋势,其余4 个品种叶片净光合速率出现下降。‘YLC13’‘YLC35’光合能力较强,在相同光强下两者Pn始终较其他6 个品种高。
不同品种薄壳山核桃光响应曲线拟合R2均达到0.99,所得光响应参数见表1。不同品种之间Pmax、LSP、LCP、Rd存在差异。8 个品种中,‘YLC35’的Pmax最高,为15.10 μmol·m-2s-1,与‘YLC13’差异不显著,属于光合能力强的品种,‘YLJ5’‘YLJ042’的Pmax最低,分别为8.52、8.78 μmol·m-2s-1;‘YLC35’‘YLC29’‘YLC13’的LSP 最高,分别为1 684.10、1 632.70、1 620.64 μmol·m-2s-1,显著高于除‘Mahan’以外的其他4 个品种,说明三者利用强光的能力较 强;‘YLC10’‘YLJ042’ 的LCP 最低,分别为28.94、29.07 μmol·m-2s-1,显著低于‘YLC13’‘YLC12’‘YLC35’,说明二者对弱光的利用能力较强;‘YLC12’‘YLC35’的Rd最高,分别为1.74、1.73 μmol·m-2s-1,显著高于除‘YLC13’‘Mahan’以外的其他4 个品种,说明光强为0 时,两者具有最高的呼吸速率。相较于其他品种而言,‘YLC35’‘YLC13’的Pmax、LSP 较高,两者表现出较强的光合能力。
8 个薄壳山核桃品种Pn-CO2响应曲线变化趋势较为一致(图1)。当CO2浓度为0~800 μmol·mol-1时,各品种叶片净光合速率近似呈直线增加;当CO2浓度为800~1 500 μmol·mol-1时,‘YLC29’逐渐平缓,‘Mahan’出现微弱下降,其他6 个品种仍呈现微弱增加。相较于其他品种,‘YLC35’的Pn具有更明显的增长趋势。
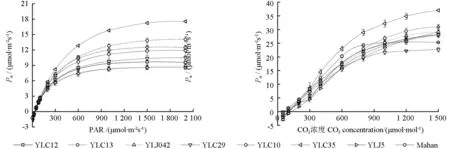
图1 不同品种薄壳山核桃光响应曲线(左)和CO2 响应曲线(右)Fig.1 Light-response curves (left) and CO2 response curves (right) of different pecan varieties
CO2响应特征参数(表1)表明,不同品种之间的Vcmax、Jmax、TPU 存在差异。8 个品种中,‘YLC35’的Vcmax最高,为59.89 μmol·m-2s-1,与‘YLC13’差异不显著,‘YLC29’的Vcmax最低,为38.77 μmol·m-2s-1;‘YLC35’‘YLC10’‘YLC13’的Jmax最高,分别为47.47、46.19、44.53 μmol·m-2s-1,与‘YLC12’差异不显著,‘Mahan’ 的Jmax最低,为30.36 μmol·m-2s-1;‘YLC35’‘YLC13’的TPU 最高,分别为13.82、13.41 μmol·m-2s-1,与‘YLC12’差异不显著,‘Mahan’的TPU 最低,为8.36 μmol·m-2s-1。综上,‘YLC35’具有较高的Vcmax、Jmax、TPU,而‘YLC29’‘Mahan’则相反,其他品种介于两者之间。以上结果表明,‘YLC35’‘YLC13’具有较高的羧化能力及耐光抑制能力,而‘YLC29’‘Mahan’的光合效率、对CO2的利用效率较弱,其他品种的羧化能力、碳同化能力一般。

表1 不同品种薄壳山核桃光合特征参数†Table 1 Photosynthetic parameters of different pecan varieties
2.2 薄壳山核桃重要叶片相关指标
不同品种薄壳山核桃叶片的相关指标如表2所示。8 个品种叶片Nmass为16.52~20.37 g·kg-1,最大值‘YLC13’是最小值‘Mahan’的1.23倍,仅二者存在显著差异;叶片Pmass为1.36~1.92 g·kg-1,最大值‘YLC13’是最小值‘YLJ042’的1.36 倍,各品种间不存在显著差异;叶片Kmass为7.36~11.67 g·kg-1,‘Mahan’‘YLJ5’‘YLC10’的Kmass最高,分别为11.67、10.76、10.74 g·kg-1,显著高于‘YLC12’。8 个品种的PNUE、PPUE分别在0.48~0.77、5.73~9.57 μmol·g-1s-1之间,均以‘YLC35’最高。‘YLC29’‘YLJ5’‘YLC13’的SLW 最高,分别为96.03、95.87、95.26 g·m-2,显著高于‘YLC35’和‘Mahan’。与SLW 相反,‘YLC35’‘Mahan’的Chl 含量较高,分别为3.05、2.93 mg·g-1,且‘YLC35’的Chl 含量显著高于‘YLC10’。
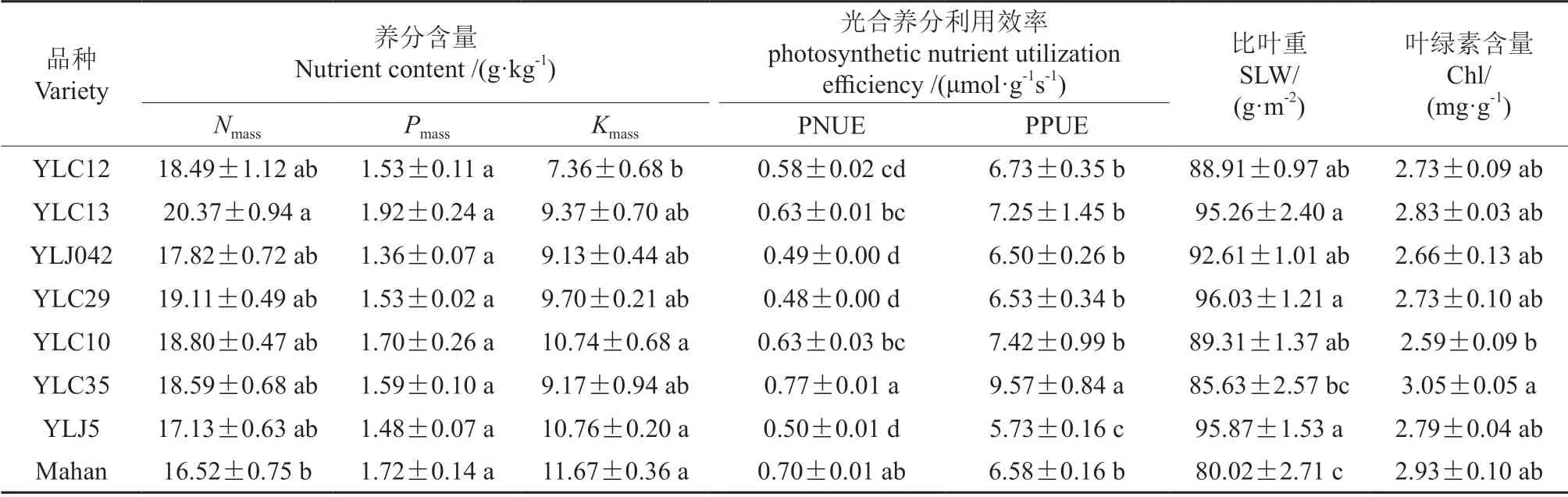
表2 不同品种薄壳山核桃叶片相关指标Table 2 Leaf related indexes of different pecan varieties
2.3 薄壳山核桃光合氮分配比较
由图2可知,不同品种之间分配至捕光色素的氮(PL)、羧化系统中的氮(PC)、生物力能学组分的氮(PB)、光合系统的氮(PT)存在差异。‘Mahan’‘YLC35’的PL较高,与除‘YLJ5’之外的其他品种的PL具有显著差异;‘YLC10’‘YLC12’‘YLC35’的PB最高,显著高于其他品种;‘YLC35’的PC、PT最高,‘YLC29’最小,两者与其他6 个品种的PC、PT均存在显著差异。综上,‘YLC35’具有较高的PL、PB、PC,而‘YLC29’相反,其他品种介于两者之间。
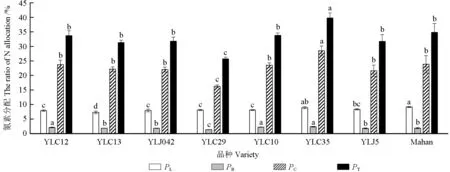
图2 薄壳山核桃叶片氮素在光合系统的分配Fig.2 Leaf nitrogen allocation in photosynthetic system of pecan varieties
2.4 薄壳山核桃光合生理特征间的相关性
对薄壳山核桃光合特征参数与不同因子进行Pearson 相关性检验,结果(表3)表明,叶片Pmax与SLW 呈负相关,与其他指标呈正相关,但Pmax仅与Chl、PC呈显著相关关系;叶片LSP 与Chl 呈极显著正相关,与其他指标相关性较弱,说明叶片的Chl 含量越高,叶片利用强光的能力就越强;叶片LCP、Vcmax、Jmax和TPU 与Chl、Kmass相关性较大,但均未达到显著水平。分析PNUE与其他参数的相关性,对具有显著相关性的参数进一步确定其回归关系。如图3所示,薄壳山核桃叶片PNUE 随着植物的PC、Pmax增加而增加,呈显著或极显著正相关关系,r分别为0.76 和0.94;而PNUE 与SLW 呈显著负相关关系,r为0.73。

表3 薄壳山核桃光合参数与不同因子的相关性†Table 3 Correlation analysis among leaf photosynthetic characteristics and different factors in pecan varieties

图3 薄壳山核桃叶片PNUE 与Pmax、SLW、PC 的相关性Fig.3 Relationship between maximum net photosynthetic rate (Pmax),specific leaf weight (SLW),N content in carboxylation(PC) with photosynthetic nitrogen-use efficiency (PNUE) of pecan leaves
3 讨 论
薄壳山核桃光合作用受到外部光强与CO2浓度的制约[16]。通过研究薄壳山核桃光响应曲线和CO2响应曲线来分析薄壳山核桃对光和CO2的响应。在光响应曲线中,LSP、LCP 分别反映植物对强光、弱光的利用能力,LSP 值高、LCP 值低的植物光适应能力较好[17-18]。本研究中,‘YLC35’的Pmax值高、LSP 值高,说明其光合能力强,利用强光的能力强。而‘YLJ5’则相反,较低的Pmax、LSP 特征表明其较弱的光合利用效率及光合生理活性。综合8 个品种的LCP 值、LSP 值得知‘YLC29’的光能利用范围较大,通常认为较宽的光能利用区间会使得植物体内的物质更易累积[19]。而‘YLC10’的LSP、LCP 均低,说明其具有较窄的光能利用区间,在一定程度上可能降低了其生态竞争能力。相较于光饱和情况下,薄壳山核桃叶片在CO2饱和情况下表现出更高的净光合速率,表明强光条件下植物叶片光合能力受CO2供应限制。有研究指出,较高的Vcmax、Jmax说明植物的光合活性及其对CO2同化、利用效率也高[20]。本研究中,‘YLC35’的Vcmax、Jmax最高,相较于其他品种其具有更高的光合酶活性、光合利用效率及生态适应性。
植物对外界的生态适应性直接或间接与叶片性状有关,且叶片性状之间一般相互关联[9]。薄壳山核桃各品种的叶片性状具有较大差异,植物在本地环境下具有多样的生态适应方式。植物叶片Chl 含量在揭示植物光合作用方面充当重要角色[21],各品种Chl 含量的差异表明植物吸收和传递光能的能力存在差别。其中,‘YLC35’的Chl含量最高,易于在强光条件下截获和利用光能。‘YLC10’的Chl 含量显著低于‘YLC35’,其对光能的利用能力相对较低,这也与其最低LSP 值所展现的结果一致。本研究中,薄壳山核桃叶片Chl 含量与LSP 呈极显著正相关关系,说明较低的叶绿素含量限制了植物对强光的利用效率。除此之外,大部分植物叶绿素含量与光合速率间存在的相关性也在本研究中得到验证[22-23],植物Chl含量与Pmax呈显著正相关关系(R2=0.758)。SLW是表征植物叶片物质累积和转移的参数,SLW 越小,叶片在有限的资源条件下竞争优势越大[22]。本研究中,‘YLC35’‘Mahan’的SLW 较小,说明二者捕获光资源能力较强,碳收获能力较强。‘YLC13’‘YLC29’‘YLJ5’的SLW 较大,三者消耗利用了更多的资源用于叶片的防御构建,在逆境条件中相对占有优势。SLW 与Pmax的关系非常复杂,部分研究认为Pmax与SLW 呈线性负相关关系[5,24],而赵晓焱等[25]发现兴安落叶松的Pmax与SLW 为极显著的正相关关系。也有研究认为,SLW 与植物光合的相关性会随生长周期而发生波动[26]。本研究中,SLW 与Pmax不存在显著相关关系,这与杨婷等[27]在高山杜鹃中的发现相似。
研究发现,更低的SLW、更高的N 含量使入侵植物较本地种具有了更强的生态适应性[14]。‘YLC35’同时具有较高的Nmass及较低的SLW,其光合优势明显。此外,‘YLC13’‘Mahan’的Pmax相似,但叶片SLW、Nmass表现相反,二者采取了不同的资源利用策略,这也表明植物具有多样的生态适应方式。黄端等[7]指出,乔木较草本分配更多的叶氮用于增加叶片韧性及厚度,‘Mahan’最低的SLW 说明其叶片更薄,这可能减小了其对氮素的需求,但其体内可能存在高效的氮素利用机制,较低的SLW 使其保持了较高的分配至光合系统的氮比例来参与光合作用。氮、磷、钾直接或间接参与光合进程,与植物生长紧密关联[4]。本研究中Pmax与Nmass、Pmass、Kmass相关性不显著,其可能受到矿质元素在叶片中的分配、叶片面积差异或其他因子的多方面影响[28]。也有研究表明,植物叶片性状间的相关性会随着样本量、空间尺度的扩大而逐渐增强[4]。此外,叶氮的增加有利于提高植物光合酶活性和对CO2的同化速率[29],‘Mahan’较低的Nmass可能是其Vcmax、Jmax较低的原因。
薄壳山核桃叶片Nmass与Pmax的相关决定系数较低(R2=0.357),但氮素在光合器官中的利用与分配模式与Pmax具有极高的相关性,植物Pmax受到PC的显著影响。这与前人的研究一致,植物叶片氮素在光合器官各组分间的分配能力在一定程度上能够解释品种间光合能力的差异,PC越高,植物则具有更高的Pmax[30]。结果表明,‘YLC35’具有最高的PC,其具有高效的光合氮分配机制,而‘YLC29’分配到光合器官的氮素有限,可能致其光合效率较低。PNUE 能够综合反映植物生理状况及适应策略,其受各项功能性状的影响[29]。朱军涛等[30]在探究豆科与非豆科植物的氮分配时发现,非豆科植物较高的PNUE 与其较低的氮含量没有显著关系,而是因其具有较高的分配至Rubisco 的氮比例。而曾小平等[8]的研究结果表明,SLW 较低的植物通过分配更多的氮到光合器官中从而得到更高的PNUE,SLW 也是影响植物PNUE 的关键因子。除此之外,叶片高的PNUE也被归因于高的Pmax[31]。本研究结果表明,PC、SLW、Pmax是影响薄壳山核桃PNUE 的主要因素,这与以上研究结果一致。相较于其他品种,‘YLC35’具有最高的Pmax、PC值和较低的SLW 值,这些生理优势使其PNUE 显著高于除‘Mahan’外的其他品种。叶片相关关系中,PNUE、Pmax的相关性最强,与郑淑霞等[26]的研究结果一致,这也间接表明了基于质量的叶氮含量对植物光合能力的限制较小。
有研究认为,PNUE、Pmax与叶片耐环境胁迫强弱、生长速率等也紧密相关[8]。因此结合各品种的生长情况来探讨植物的光合生理生化机制可能会更准确度量植物的生态适应性。除此之外,各品种的光合生理适应性差异可能是植物环境胁迫耐性的表现,重庆高温高光强环境使品种间可能存在有较大的抗旱性差异。为了进一步弄清植物抗性生理和光合作用之间的关系,可以进一步开展不同品种薄壳山核桃在重庆地区越夏抗旱耐热性比较研究。
4 结 论
8 个薄壳山核桃品种光合参数等重要叶片相关指标存在差异,总体而言,‘YLC35’的Pmax、PNUE 相对较高,同时具有较低的SLW 和较高的光合氮分配比例,属于光合碳同化能力及资源利用率高的材料,可作为高光效的薄壳山核桃种质深入研究和利用。叶片部分功能性状是影响薄壳山核桃光合能力的重要因素,更高的叶绿素含量及光合氮分配比例提高了薄壳山核桃的光合效率。

