过表达miR-370调控哮喘小鼠肺损伤及其机制
任彦红,张凌云,赵少聪,张广超,孙晓敏
支气管哮喘是由多种细胞(如T淋巴细胞、中性粒细胞和嗜酸性粒细胞等)和细胞组分参与的异质性疾病,一般症状为喘息、气促、胸闷和咳嗽等,若治疗不及时会严重威胁患者生命安全。研究[1-2]表明,支气管哮喘发病机制是体液中辅助性T细胞(Th细胞)失衡,Th2激活B细胞并产生免疫球蛋白(immunoglobulins,Ig)E,IgE介导嗜酸性粒细胞和肥大细胞等诱发气道炎症。miR-370是一类由人胚胎干细胞中被克隆的microRNA,位于人类4号染色体上,长度约75个碱基。研究[3]表明,miR-370在炎性疾病中表达严重下调,且在多种肿瘤及炎性疾病中发挥调节作用,如miR-370通过靶向SIRT6和调节核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)信号通路来加速脑缺血再灌注损伤[4],通过抑制性别决定域Y框12(sex determining region Y,SOX12)在膀胱癌中充当肿瘤抑制因子[5],通过靶向Toll样受体4(Toll-like receptor 4,TLR4)抑制由氧化的低密度脂蛋白触发的血管炎症和氧化应激[6],通过靶向叉形头转录因子1 (forkhead box O1,FOXO1)抑制过氧化氢诱导的心肌细胞氧化应激和凋亡[7]等。但miR-370在支气管哮喘中的作用研究鲜见报道。该研究通过建立卵清蛋白(ovalbumin,OVA)诱导的哮喘小鼠模型,观测过表达miR-370对OVA诱导的哮喘小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)和肺组织中炎症因子、免疫调节因子及凋亡蛋白表达水平的影响,初步探索过表达miR-370在哮喘小鼠肺损伤中的保护作用,为支气管哮喘的诊断和治疗提供新的依据。
1 材料与方法
1.1 动物与试剂40只雌性BALB/c小鼠购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0011,使用许可证号:SYXK(京)2017-0033,实验动物使用过程中严格遵守3R原则,并通过医学伦理委员会批准,伦理审批号IACUC:LYZYJSXYYXY-20190201,实验前在恒温25 ℃的环境中采用标准的饲料进行喂养,自由取水。OVA购自美国Sigma公司;miR-NC和miR-37过表达腺病毒购自美国Ambion公司;RT-PCR试剂盒、苏木精-伊红(HE)染色试剂盒、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒均购自美国Sigma公司;末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)染色试剂盒购自美国Roche公司;Bcl-2相关的X蛋白(Bcl-2 associated X protein,Bax)、B细胞淋巴瘤蛋白2(B-cell lymphoma protein 2,Bcl-2)和胱天蛋白酶3(caspase-3,cas-3)抗体购自美国Abcam公司。miR-370、IL-12和IL-4引物由上海生工生物工程股份有限公司合成。miR-370,上游序列:5′-TAGCGGGTTTTGCTAGGGC-3′,下游序列:5′-TAGCGCCTAGGGCATCGATC-3′;IL-4上游序列:5′-TACAGCCACCATGAGAAGGAC-3′,下游序列:5′-TGATCGTCTTTAGCCTTTCCA-3′;IL-12,上游序列:5′-GACCATCACTGTCAAAGAGTT TCTAGAT-3′,下游序列:5′-AGGAAAGTCTTGTTTTTGAAATTTTTTAA-3′;GADPH,上游序列:5′-CTAGAGAGCTGACAGTGGG-TAT-3′,下游序列:5′-AG ACGACCAATGCGTCCAAA-3′。
1.2 动物分组、建模及转染将40只雌性BALB/c小鼠(6~8周龄,体质量15~20 g)随机分为4组(n=10):对照组(Control组)、模型组(OVA组)、阴性对照组(OVA+miR-NC组)、miR-370过表达组(OVA+miR-370组)。对照组常规饲养,不予任何处理,其余各组均采用致敏加激发法建立哮喘小鼠模型。致敏激发:小鼠于第1~7天腹腔注射致敏液0.1 ml/只(0.1 ml致敏液含OVA 0.1 mg,氢氧化铝0.02 mg);第14天将小鼠置于自制透明雾化玻璃箱中,3% OVA溶液10 ml超声雾化吸入,30 min/d,持续6 d。当小鼠出现躁动不安、呼吸急促、频繁点头动作、腹部抽动加剧、频繁揉鼻等症状时表示造模成功。造模成功后,OVA+miR-NC组尾静脉注射30 μl miR-NC腺病毒,OVA+miR-370组尾静脉注射30 μl miR-370过表达腺病毒,1次/d,持续2 d。确定干扰成功后24 h处死小鼠,收集肺组织并分离气管,结扎左主支气管,将气管上部剪出一个斜切面,以0.1 mol/L PBS缓冲液反复抽吸2~3次,每次吸取0.5 ml。得到支气管肺泡灌洗液(BALF)。4 ℃、1 000 r/min条件下离心10 min,收集上清液并置于-20 ℃冰箱中保存,剩余BALF中的细胞用红细胞裂解缓冲液处理,然后用细胞计数器通过显微镜统计细胞总数。然后将细胞涂在载玻片上,干燥,并使用瑞氏-吉姆萨染色剂染色,在高倍镜下进行炎症细胞分类计数。
1.3 RT-PCR取小鼠肺组织约70 mg,超声研磨匀浆,于4 ℃、3 000 r/min条件下离心15 min,用TRIzol试剂提取总RNA,测定RNA的浓度和纯度并根据逆转录试剂盒操作说明进行逆转录。PCR反应条件,95 ℃、10 min,95 ℃、15 s,60 ℃、 1 min(40个循环),熔解曲线60 ℃~95 ℃,每 15 s升0.3 ℃。以目的基因和GADPH比值表示mRNA表达水平,采用2-ΔΔCt法分析结果,独立重复实验3次,取平均值。
1.4 ELISA严格按照ELISA试剂盒操作说明书进行操作。ELISA检测支气管肺泡灌洗液中白细胞数、IgE水平、INF-γ和IL-13蛋白表达水平。
1.5 HE染色将固定的肺组织进行脱水、石蜡包埋等处理,按试剂盒操作说明行HE染色,显微镜下观察组织切片病理形态变化。
1.6 TUNEL染色取肺组织于4%多聚甲醛溶液中充分固定,48 h后脱水、浸蜡、石蜡包埋。按照TUNEL染色试剂盒说明书进行染色,凋亡细胞即阳性细胞,在光镜下呈棕黄色或棕褐色,非凋亡细胞即阴性细胞,呈蓝色。
1.7 Western blot实验使用胰酶消化细胞,用RIPA蛋白裂解液于冰上提取总蛋白,用BCA蛋白浓度测定试剂盒测定蛋白浓度,经SDS-PAGE电泳、转模、脱脂奶粉封闭,加入一抗(1 ∶1 000),4 ℃孵育摇床过夜。回收一抗,加入按比例稀释HRP标记的对应二抗(1 ∶4 000),室温孵育120 min。采用ECL进行化学发光法于暗室下曝光显影(GADPH作内参)。将胶片进行扫描存档,Photoshop整理去色,Alpha软件分析吸光度,独立实验重复3次,取平均值。
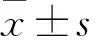
2 结果
2.1 miR-370过表达与Control组相比,OVA组小鼠miR-370表达水平极低(F=68.25,P=0.036);与OVA组相比,OVA+miR-NC组miR-370表达水平差异无统计学意义,OVA+miR-370组miR-370表达水平上调(F=57.41,P=0.042)。见图1。
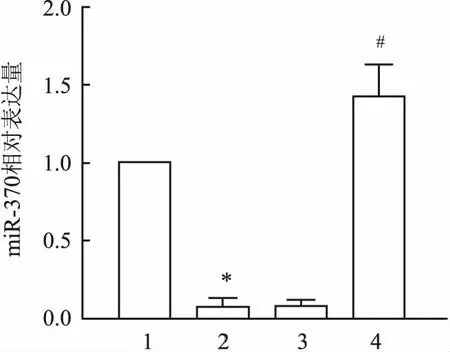
图1 RT-PCR检测各组小鼠miR-370表达水平1:Control组;2:OVA组;3:OVA+miR-NC组;4:OVA+miR-370组;与Control组比较:*P<0.05;与OVA组比较:#P<0.05
2.2 各组小鼠BALF中炎症细胞数目比较与Control组相比,OVA组小鼠BALF中白细胞总数目增多(F=74.19,P=0.026);与OVA组相比,OVA+miR-NC组炎症细胞总数目差异无统计学意义,OVA+miR-370组炎症细胞总数目减少(F=69.57,P=0.031)。见图2。
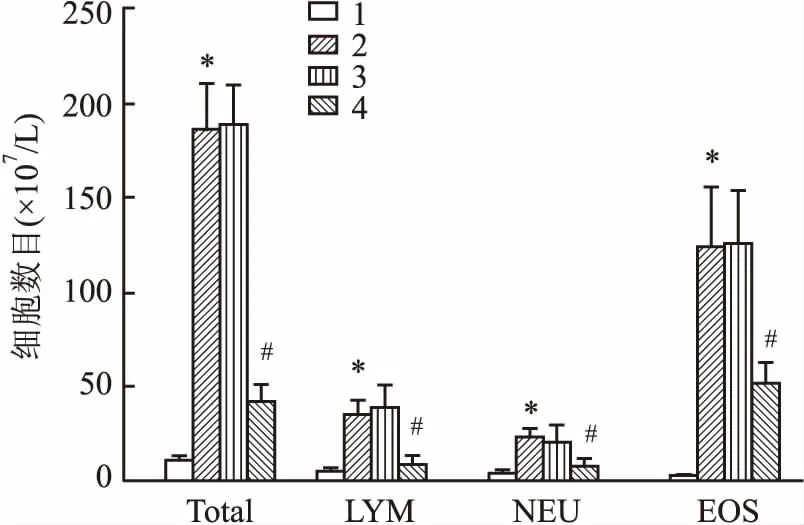
图2 各组小鼠BALF中炎症细胞计数1:Control组;2:OVA组;3:OVA+miR-NC组;4:OVA+miR-370组;Total:白细胞总数;LYM:淋巴细胞;NEU:中性粒细胞;EOS:嗜酸性粒细胞;与Control组比较:*P<0.05;与OVA组比较:#P<0.05
2.3 各组哮喘小鼠BALF IgE水平比较与Control组相比,OVA组小鼠BALF中总IgE水平和OVA特异性IgE水平均升高(F=81.42、76.33,P=0.014、0.018);与OVA组相比,OVA+miR-NC组总IgE水平和OVA特异性IgE水平均差异无统计学意义,OVA+miR-370组总IgE和OVA特异性IgE水平均降低(F=65.27、61.98,P=0.039、0.041)。见图3。
图3 ELISA检测各组小鼠BALF中IgE含量A:OVA特异性IgE水平;B:各组小鼠BALF中总IgE水平;1:Control组;2:OVA组;3:OVA+miR-NC组;4:OVA+miR-370组;与Control组比较:*P<0.05;与OVA组比较:#P<0.05
2.4 各组哮喘小鼠BALF中免疫调节因子蛋白含量比较与Control组相比,模型组高表达IFN-γ和IL-13(F=69.15、61.22,P=0.031、0.037);与OVA组相比,OVA+miR-NC组IFN-γ和IL-13含量差异无统计学意义,OVA+miR-370组IFN-γ水平下调(F=58.35,P=0.042),IL-13含量上调(F=61.42,P=0.044)。RT-PCR检测BALF中IL-12和IL-4 mRNA表达水平,结果如图4B所示,与Control组相比,OVA组IL-12和IL-4均高表达(F=58.11、62.47,P=0.043、0.035);与OVA组相比,OVA+miR-NC组IL-12和IL-4表达水平差异无统计学意义,OVA+miR-370组IL-12表达下调(F=64.33,P=0.030),IL-4 mRNA表达上调(F=60.02,P=0.036)。见图4。
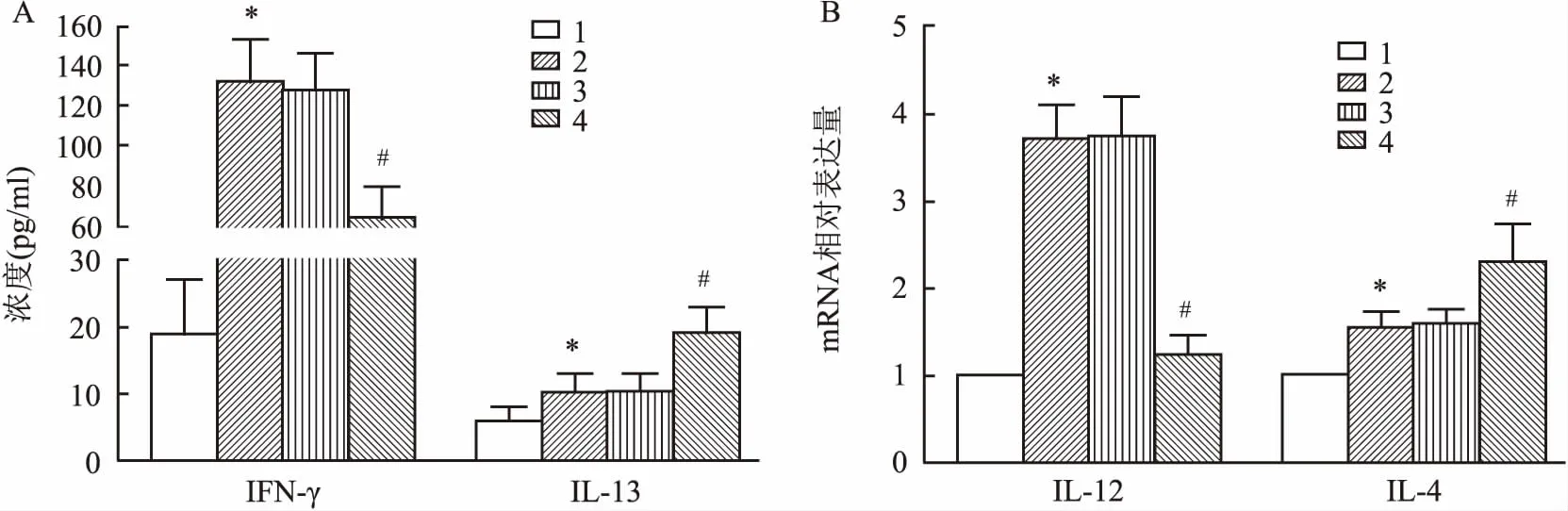
图4 ELISA检测各组小鼠BALF中免疫调节因子蛋白含量A:Th1细胞因子IFN-γ和Th2细胞因子IL-13浓度;B:IL-12和IL-4 mRNA表达水平;1:Control组;2:OVA组;3:OVA+miR-NC组;4:OVA+miR-370组;与Control组比较:*P<0.05;与OVA组比较:#P<0.05
2.5 各组哮喘小鼠肺组织病理损伤和细胞凋亡比较HE染色和TUNEL染色观察小鼠肺组织形态和凋亡水平变化,如图5所示,Control组小鼠肺泡壁结构完整,肺泡大小无差异,黏膜和管周未见炎性细胞浸润,凋亡细胞极少(棕褐色);与Control组相比,OVA组小鼠无完整的肺泡结构,支气管上皮损伤严重,支气管黏膜和管周可见大量的淋巴细胞、嗜酸性粒细胞和中性粒细胞浸润,管腔内出现大量分泌物,凋亡细胞明显增多;与OVA组相比,OVA+miR-370组小鼠肺泡结构形态、炎性细胞浸润和凋亡细胞数减少。

图5 HE和TUNEL染色检测各组小鼠肺组织病理损伤和凋亡情况 ×400
2.6 各组哮喘小鼠肺组织炎症水平比较采用5分制对肺组织10个视野下的HE染色病理图进行炎症评分,评分标准:支气管周围无炎性细胞计为0分,出现少量的炎性细胞计为1分;在支气管周围环绕细胞层厚度炎性细胞1个计为2分,2~4个计为3分,≥4个计为4分。与Control组相比,OVA组小鼠肺组织炎症评分升高(F=81.53,P=0.011);与OVA组相比,OVA+miR-370组小鼠肺组织炎症评分降低(F=78.34,P=0.027)。见图6。
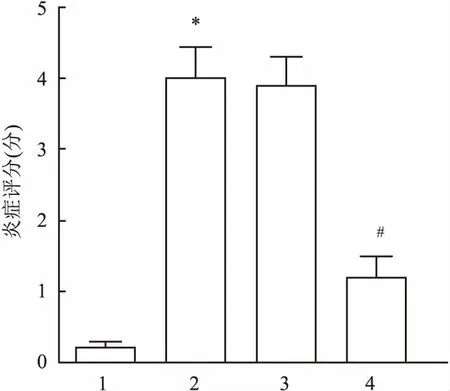
图6 小鼠肺组织炎症评分1:Control组;2:OVA组;3:OVA+miR-NC组;4:OVA+miR-370组;与Control组比较:*P<0.05;与OVA组比较:#P<0.05
2.7 各组哮喘小鼠肺组织中凋亡蛋白表达水平比较与Control组相比,OVA组小鼠肺组织中Bax/Bcl-2和cleaved cas3/cas3蛋白表达水平上调(F=65.53、63.12,P=0.030、0.032);与OVA组相比,OVA+miR-NC组Bax/Bcl-2和cleaved cas-3/cas3表达水平无差异,OVA+miR-370组Bax/Bcl-2和cleaved cas3/cas3蛋白表达水平下调(F=68.33、70.22,P=0.028、0.024)。见图7。

图7 各组小鼠肺组织中Bax/Bcl-2和cleaved cas3/cas3蛋白表达水平1:Control组;2:OVA组;3:OVA+miR-NC组;4:OVA+miR-370组;与Control组比较:*P<0.05;与OVA组比较:#P<0.05
3 讨论
支气管哮喘常伴随呼吸困难、发作性咳嗽、胸闷等症状,是一种发病机制极其复杂的慢性呼吸道疾病,以气道炎症和气道重塑为主要特征[8]。研究[9]
表明,肺组织炎症、免疫系统紊乱、组织细胞凋亡是导致支气管哮喘的主要病理生理因素。该研究通过建立OVA诱导的哮喘小鼠模型,探索过表达miR-370在哮喘小鼠BALF和肺组织炎症反应、免疫应答及凋亡中的调节作用。
炎症细胞是一类参与炎症反应的细胞,包括肥大细胞、淋巴细胞、中性粒细胞和嗜酸性粒细胞等。在支气管哮喘发生时,炎症细胞大量分泌,加剧支气管气道炎症反应,促使支气管哮喘与炎症反应双向作用,并最终诱发重症哮喘[10]。嗜酸性粒细胞的浸润情况与哮喘气道炎症严重程度密切相关,嗜酸性粒细胞被激活后,一方面合成并释放嗜酸性粒细胞阳离子蛋白(ECP)、碱基蛋白和神经毒素等损伤气道上皮;另一方面,不断分泌TGF-β1作用于成纤维细胞上,使气道结构重塑,继而诱发气道炎症反应[11]。Th1/Th2在哮喘中起调控作用,Th1/Th2失衡或Th2细胞因子异常升高会诱导哮喘发生,IFN-γ、IL-12、IL-4和IL-13是Th1和Th2细胞分泌的炎症调控因子[12]。IL-4诱导Th细胞向Th2细胞分化,促进免疫球蛋白E(IgE)的合成,同时引起嗜酸性粒细胞在炎症部位聚集诱发哮喘[13]。IL12和 IFN-γ则与之相反,IL-12诱导Th细胞向Th1细胞分化,抑制IgE的合成,IFN-γ则抑制IL-4诱导的IgE合成,阻断IgE介导的的哮喘发生[14]。
凋亡蛋白Bax、Bcl-2、cas-3和cas-9是凋亡发生过程中的重要调控蛋白,凋亡发生时,上游细胞凋亡起始蛋白cas-9与细胞色素C结合形成凋亡小体,cas-9被活化后诱导并激活下游细胞凋亡执行蛋白cas-3,凋亡蛋白cas-9和cas-3被异常激活,使得大脑组织产生大量的cleaved cas-3和cleaved cas-9,并进一步执行DNA裂解及细胞凋亡过程,加重肺组织损伤。Bcl-2则抑制细胞色素c与cas-9结合,从而发挥抗细胞凋亡作用[15]。
该研究结果显示,OVA组小鼠BALF中出现大量淋巴细胞、中性粒细胞和嗜酸性粒细胞,IgE和OVA特异性IgE在哮喘小鼠BALF中异常升高。而过表达miR-370抑制哮喘小鼠BALF中炎症细胞和IgE水平,同时,降低INF-γ、IL-12水平,升高IL-13、IL-4水平。因此,过表达miR-370通过降低哮喘小鼠炎症水平缓解肺组织损伤。为进一步明确过表达miR-370在哮喘小鼠肺组织中的保护作用,该研究通过检测哮喘小鼠肺组织病理损伤程度及凋亡情况,结果显示,过表达miR-370改善哮喘小鼠肺组织损伤程度,抑制肺组织凋亡。
综上所述,过表达miR-370通过调控哮喘小鼠肺组织中炎症水平、免疫应答和细胞凋亡在哮喘小鼠肺损伤中发挥保护作用。该研究通过动物模型初步探索了过表达miR-370在哮喘小鼠肺损伤中的调控作用,但具体的作用机制有待进一步的研究。后续实验可对过表达miR-370调节哮喘小鼠肺组织炎症、免疫应答和凋亡的作用机制进行研究,为哮喘的诊断和治疗提供新的思路。

