缺血性脑卒中致脑室运动纤毛功能障碍诱发脑水肿
赵玉洁,张 玲,马 兰,滕增光,贾金鑫,曹晓璐
缺血性脑卒中(cerebral ischemic stroke, CIS)占脑卒中总数的60%~70%[1],易发生缺血性脑卒中/再灌注(cerebral ischemic stroke-reperfusion,CIS/R)损伤,并继发脑水肿,使病死率增加[2]。已知CIS-R过程伴随血管内大分子物质渗透到脑细胞间隙,最终导致脑实质、脑室脉络丛等部位发生脑水肿[3]。研究[4]表明,运动纤毛紊乱会导致原发性纤毛运动障碍,在神经系统表现为脑水肿,敲除纤毛相关基因Spag6后,室管膜细胞上运动纤毛出现结构和功能损伤。然而,目前尚未见报道,CIS/R继发脑水肿损伤是否与室管膜细胞运动纤毛的结构功能异常以及运动纤毛相关基因Spag6表达异常相关。该研究拟在整体动物水平,检测脑缺血/再灌注继发脑水肿损伤后,脑室管膜细胞运动纤毛的结构和功能变化,以及运动纤毛相关蛋白的表达调控,初步探讨缺血性脑卒中继发的脑水肿与室管膜细胞上运动纤毛功能障碍的调控机制。
1 材料与方法
1.1 动物及处理方法雄性SPF级SD大鼠60只,6周龄,体质量(260~300)g,购自斯贝福(北京)生物技术有限公司[许可证号:SCXK(京)2019-0010]。分笼饲养于标准环境中,常温、常规大鼠饲料喂养,自由饮水。利用随机数字表法将60只SD大鼠随机分为两组:假手术组(Sham组)和模型组(MACO/R组),30只/组。假手术组仅暴露颈总动脉不做栓塞处理,模型组大鼠采用大脑中动脉栓塞法(middle cerebral artery occlusion,MCAO)建立脑缺血2 h再灌注24 h模型。
1.2 主要试剂和器材兔抗SPAG6多抗(bs-12291R)、兔抗β-actin(bs-0061R)、兔抗SPAG6/Cy3(bs12291R-Cy3)购自北京博奥森生物技术有限公司;Ac-α-Tubulin(#5335)购自美国Cell Signaling Technology;山羊抗兔Cy3(125799)、山羊抗兔FITC(133027)和苏木精-伊红(HE)染色试剂盒购自武汉科瑞生物技术有限公司;激光共聚焦显微镜(日本奥林巴斯,FV1000);扫描电镜(scanning electron microscope,SEM)由中国科学院武汉病毒研究所分析测试中心提供。
1.3 方法
1.3.1MCAO/R模型的构建 将长4 cm的鱼线一端浸入熔化的石蜡中并迅速提起,反复几次,待鱼线表面石蜡凝固后即作为线栓备用。大鼠术前禁食不禁水,称重后用10%水合氯醛腹腔注射麻醉(350 mg/kg),固定于手术台上,以颈正中线行纵向切口,剥离筋膜,钝性分离两侧组织,暴露右侧颈总动脉(common carotid artery,CCA)并分离,之后分离右侧颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA),结扎ECA,动脉夹夹住CCA和ICA,在ECA距离与ICA分叉处4 mm处,用眼科剪剪一小口,夹持线栓插入ECA,经由CCA插入ICA,插入深度为16~18 mm为止。将线栓与ECA结扎固定,最后缝合筋膜、皮肤。线栓插入成功后,记录缺血时间,2 h后拔出线栓,结扎ECA近心端。
1.3.2神经功能评分 缺血/再灌注24 h后采用Longa′s评分标准对大鼠神经功能进行评分。0分:活动正常,无神经功能缺损;1分:左前肢不能完全伸展;2分:爬行时向左侧转圈;3分:爬行时向左侧倾倒;4分:不能自发行走,意识丧失。选取评分为1~4分的大鼠进行实验。
1.3.3脑水肿测定 再灌注24 h后,将大鼠麻醉,取新鲜脑组织,去掉小脑后,用滤纸吸干表面血渍,分开左右脑,置于电子分析天平测右脑湿重,之后放入110 ℃恒温箱中连续烘烤48 h,称量右脑干重。按Elliot公式计算脑含水量,脑含水量=(湿重-干重)/湿重×100%。
1.3.42,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色 将大鼠麻醉,断颈取脑,-20 ℃冷冻30 min后行冠状切片(厚度约2 mm),置入1% TTC溶液中,37 ℃避光孵育约20 min,之后置于4%多聚甲醛溶液中固定,拍照,正常脑组织呈鲜红色,梗死脑组织呈白色。ImageJ软件测定梗死区域面积,每层梗死体积=梗死面积×层厚,总梗死体积为各层梗死体积之和。梗死体积百分比=(梗死区域面积/脑片总面积)×100%。
1.3.5HE染色 多聚甲醛固定的脑组织用石蜡包埋、切片,经过脱蜡、水化后,苏木精染色约10 min,自来水冲洗,再放入1%盐酸乙醇中分化数秒,自来水冲洗,乙醇梯度脱水;0.5%伊红染色约20 s,乙醇梯度脱水,封片,显微镜下观察并拍照。
1.3.6SEM观察纤毛形态 取大鼠右侧第三脑室室管膜细胞周围组织,切片约1.5 mm厚,0.9%氯化钠溶液清洗,2.5%戊二醛二甲砷酸钠固定液固定(2~3)h,乙醇梯度脱水各20 min,CO2临界点干燥,镀膜,SEM观察纤毛结构,并拍照。
1.3.7Western blot检测SPAG6表达 取大鼠右脑皮层组织,RIPA裂解液提取蛋白,BCA试剂盒测蛋白浓度。配置12%的SDS-PAGE分离胶,5%浓缩胶,40 μg蛋白变性后上样,电泳、电转,5%脱脂奶粉封闭2 h,孵育一抗(SPAG6,1 ∶1 000,β-actin,1 ∶10 000),4 ℃冰箱过夜,TBST洗膜后孵育二抗2 h, TBST洗膜后加ECL显影液进行显影,Image J软件进行灰度值分析。
1.3.8免疫荧光分析纤毛形态及SPAG6表达 脑片脱蜡水化后,置于100 ℃ 10 mmol/L柠檬酸盐缓冲液中10 min,冷却后透膜、封闭,湿盒中孵育一抗(SPAG6,1 ∶100;Ac-α-tubulin,1 ∶400)放入4 ℃冰箱过夜;室温避光孵育二抗(Cy3,1 ∶200;FITC,1 ∶100),DAPI核染5 min,甘油封片,激光共聚焦观察并拍照。
2 结果
2.1 脑缺血/再灌注后神经功能评分、梗死体积及脑含水量的变化模型组大鼠成功27只,死亡2只,神经功能评分为0分的1只大鼠除去,造模成功率为90%。Sham组大鼠神经功能评分和脑梗死体积为0;MACO/R组神经功能评分为(2.71±1.05),梗死体积为(19.33±9.55)%,与Sham组相比结果差异均有统计学意义(P<0.05),说明建模成功。见图1A~C。与Sham组相比,差异有统计学意义(P<0.05),说明构建脑缺血再灌注模型成功诱导了脑水肿症状。见图1D、E。

图1 脑缺血/再灌注对大脑形态的影响A:TTC染色;B:脑梗死体积 C:神经功能评分;D:大脑体积;E:脑含水量测定;与Sham组比较:**P<0.01,***P<0.001
2.2 脑缺血/再灌注对脑室管膜细胞运动纤毛的形态学影响HE染色结果显示,Sham组大鼠脑组织结构紧密规则,室管膜细胞的细胞核圆润饱满,未见坏死细胞,运动纤毛排列整齐、结构完整、生长浓密,见图2A;MACO/R模型组脑组织结构松散,室管膜细胞的细胞核皱缩浓染,生成大量坏死细胞,运动纤毛结构紊乱、数量减少、密度降低,且均有统计学意义,见图2B。SEM结果与HE染色结果一致,显示假手术组脑室管膜细胞表面纤毛排列密集、活性高,摆动方向规律一致,见图2C;模型组纤毛数量减少、密度降低,差异有统计学意义,而且活性较差,排列方向杂乱无章,见图2D。
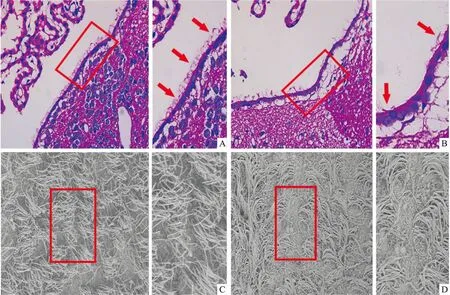
图2 脑缺血/再灌注对大脑第三脑室运动纤毛的影响A:Sham组HE染色×400结果图;B:MCAO/R组HE染色×400结果图;C:Sham组扫描电镜×20 000结果图;D:MCAO/R组扫描电镜×20 000结果图;图中红色箭头指向室管膜细胞上运动纤毛
2.3 脑缺血/再灌注对运动纤毛相关基因SPAG6表达的影响Western blot结果显示,与Sham组相比,MCAO/R组的SPAG6总蛋白表达量略有升高,但结果无统计学差异,见图3A、B。在免疫荧光实验中,通过分析脑室切片每10 mm2区域的平均荧光强度显示,见图3C白色方框,MCAO/R组的SPAG6蛋白荧光表达强度比Sham组略有升高,但结果差异无统计学意义,此结果与Western blot结果一致(图3D);分别对该区域的室管膜细胞和运动纤毛上SPAG6蛋白表达进行荧光强度分析显示,与Sham组对比,MACO/R组的室管膜细胞的平均荧光强度升高,见图3E;运动纤毛上SPAG6蛋白表达量减少,见图3F,且差异均有统计学意义(P<0.05)。通过分析运动纤毛指示蛋白Ac-α-tubulin显示,与Sham组相比,MACO/R组纤毛较数量少,排列杂乱无序,这一结果与HE染色结果一致。MACO/R组的运动纤毛长度较Sham组明显缩短,差异有统计学意义(P<0.05),见图3G。
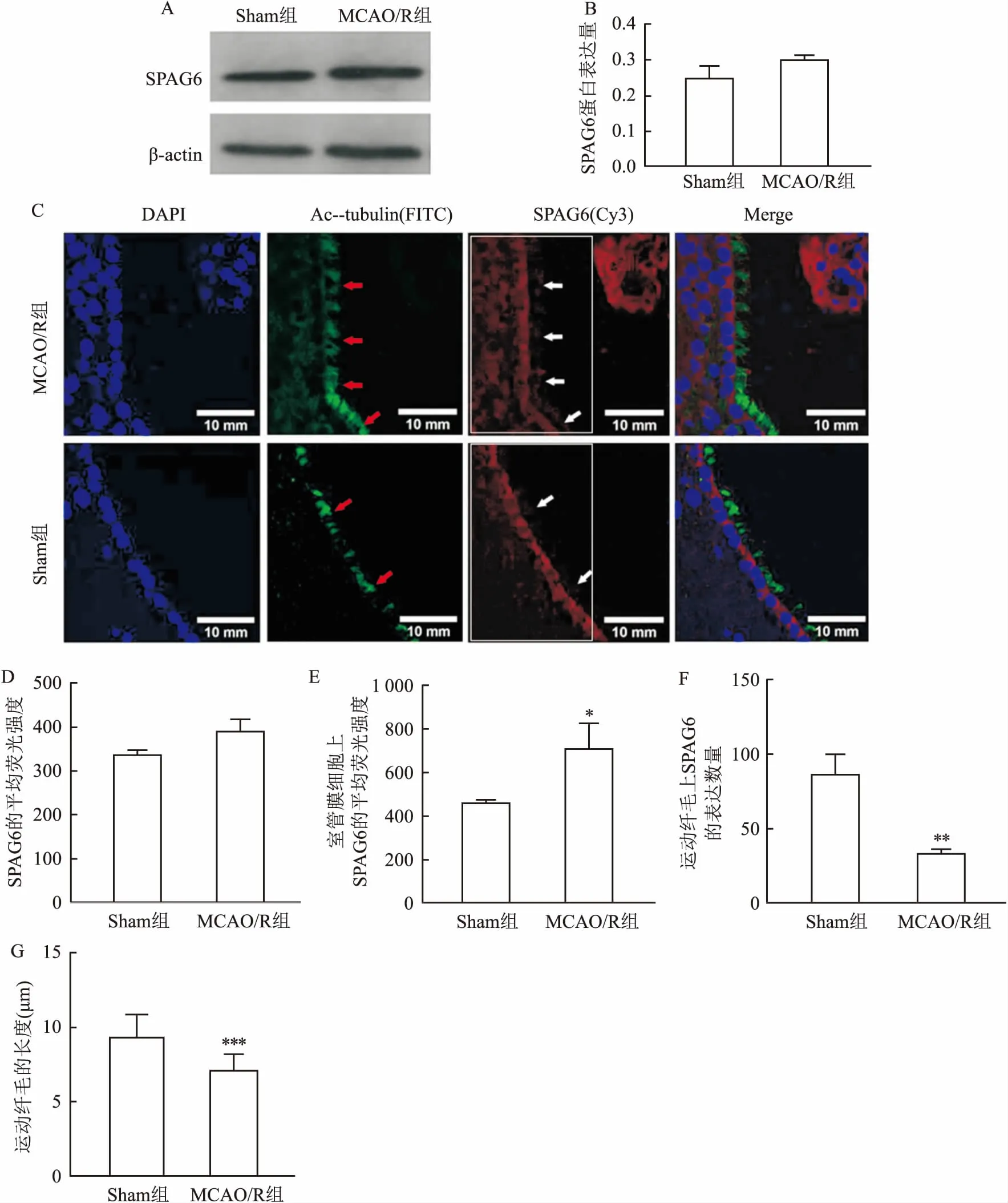
图3 CIS/R对SPAG6及纤毛形态和功能的影响A:Western blot检测纤毛相关蛋白SPAG6蛋白变化;B:SPAG6蛋白表达量;C:免疫荧光观察不同组纤毛形态的变化SPAG6的表达 ×40,红色箭头指向运动纤毛,白色箭头指向SPAG6在运动纤毛上的表达量;D:SPAG6的平均荧光强度分析;E:室管膜细胞上SPAG6的平均荧光强度分析;F:运动纤毛上SPAG6的表达数量分析;G:运动纤毛的长度分析;与Sham组比较:*P<0.05,**P<0.01,***P<0.001
3 讨论
运动纤毛是细胞游离面伸出的能摆动的较长突起,广泛分布在脑室管膜细胞[5]、支气管上皮细胞[6]等组织。纤毛的摆动不仅有利于脑脊液在中央管内的动态混合,同时对脑脊液与脊髓间物质流、能量流、信息流的交换运输和碎片清除,起到积极的配合推动作用[7],以此来维持脑内动态平衡。
小鼠运动纤毛存在一个剪接位点Ccdc39,在脉络丛和室管膜细胞中选择性表达。当Ccdc39发生突变,室管膜细胞运动纤毛变短、微管混乱、缺乏动力蛋白,从而导致脑水肿[8]。而临床发生脑水肿是缺血性脑卒中急性期死亡的主要原因[9]。本研究通过构建脑缺血/再灌注模型引发脑水肿症状,结果显示大鼠脑室运动纤毛的正常结构被破坏,并出现脑水肿,说明CIS继发脑水肿可能与运动纤毛结构和功能异常相关。
哺乳动物的精子相关抗原6(sperm associated antigen 6,SPAG6)是衣藻PF16的同源基因,调节纤毛的运动,在大脑、支气管等多个组织表达[10]。本研究中,当CIS/R发生后,SPAG6蛋白表达有所升高,说明SPAG6参与了缺血性脑卒中/再灌注损伤的发生发展过程。而且SPAG6在室管膜细胞上荧光表达增加,提示CIS/R损伤介导的SPAG6蛋白表达升高主要集中在室管膜细胞部位,这一现象可能是由于急性缺血使得SPAG6在脑室管膜细胞的表达应激性增加,导致荧光强度增大。
既往的研究[11]显示,在缺失Spag6的小鼠中,脑室管膜细胞上的运动纤毛的结构形态出现病理性改变,这说明Spag6对运动纤毛的结构具有重要的调控功能。而本研究CIS/R继发脑水肿的同时,脑室管膜细胞的运动纤毛上Spag6表达显著降低,运动纤毛结构受损。这一现象可能就是因为运动纤毛相关基因Spag6表达异常导致运动纤毛功能障碍,从而抑制了运动纤毛对脑脊液动态混合、能量交换、信息运输的作用,最终导致脑水肿的发生。Sapiro et al[12]的研究也证实,敲除Spag6基因的小鼠约有50%死于脑水肿,表明Spag6与大脑发生脑水肿症状有直接关联。
综上所述,该研究确定了CIS/R下调大脑脑室运动纤毛上SPAG6蛋白表达,影响运动纤毛结构功能,从而发生脑水肿损伤。这为进一步揭示缺血性脑卒中的病理机制,以及临床治疗和相关药物研发提供了可靠依据。大脑脑室运动纤毛的结构和功能是由多个基因来调控和维系的,在缺血性脑卒中继发脑水肿损伤过程中,是否还有其他纤毛相关基因参与,其中的具体分子调控机制如何,仍需进一步探究。

