深部髓质静脉可见性与脑小血管病影像学标志物及总负荷的关系研究
沈娜,牟英峰,巩诗彤,李晴晴,孙浩,耿德勤
既往研究表明,脑小血管病(cerebral small vessel disease,CSVD)与急性脑卒中患者不良预后密切相关[1]。CSVD总负荷评分可以反映CSVD严重程度,预测个体认知功能下降、痴呆及脑卒中发生风险[2]。目前,CSVD的病理机制尚未完全阐明,有尸检报告发现,多数脑白质疏松症患者存在脑室周围的静脉胶原沉积[3]。之后KEITH等[4]研究证实了该病理过程,并发现CSVD中的白质高信号(white matter hypertensities,WMH)与静脉胶原沉积引起的静脉狭窄及闭塞有关,之后静脉胶原病被引入CSVD的研究中。磁敏感加权成像(susceptibility-weighted imaging,SWI)可以显示静脉结构,这就为CSVD与静脉之间的关系研究提供了条件,其中深部髓质静脉(deep medullary veins,DMV)因具有便于观察和结构相对稳定的优势,已成为目前的研究焦点。ZHANG等[5]建立了一个DMV视觉评分系统,结果表明,DMV视觉评分增加与WMH体积增大独立相关,但其与其他影像学标志物的关系尚不清楚。本研究旨在分析DMV可见性与CSVD患者影像学标志物及总负荷评分的关系,现报道如下。
1 对象与方法
1.1 研究对象 选取2019年1月至2021年6月在徐州医科大学附属医院完成颅脑磁共振成像(magnetic resonance imaging,MRI)、SWI、头颈磁共振血管成像(magnetic resonance angiography,MRA)或CT血管造影(CT angiography,CTA)检查的住院患者为初筛对象,最终纳入 238 例CSVD患者,均符合《中国脑小血管病诊治共识》[6]中的CSVD诊断标准。根据本组患者DMV视觉评分中位数将其分为DMV低分组(DMV评分<8分,n=114)和DMV高分组(DMV评分≥8分,n=124)。本研究经徐州医科大学附属医院医学伦理委员会审核批准(审批号:XYFY2018-KL038-01)。
1.2 纳入与排除标准 纳入标准:(1)年龄≥40岁;(2)伴有至少1个动脉粥样硬化的危险因素:吸烟、饮酒、体质指数(body mass index,BMI)>24 kg/m2、高血压、糖尿病、糖耐量受损或空腹血糖(fasting blood glucose,FBG)受损、冠心病、高脂血症、高同型半胱氨酸血症;(3)MRA或CTA检查未见严重的颈内或颅内大动脉狭窄或闭塞。排除标准:(1)临床资料不完整者;(2)合并中枢神经系统感染性疾病、代谢性疾病、自身免疫性疾病、毒性疾病及脱髓鞘疾病者;(3)合并影响DMV视觉评分的缺血性或出血性脑卒中者;(4)伴有颅内占位性病变者;(5)遗传性CSVD者。
1.3 观察指标
1.3.1 临床资料 收集所有患者的临床资料,包括性别、年龄、BMI、既往史(包括高血压病史、糖尿病病史、心房颤动病史、冠心病病史、脑梗死病史)、吸烟史、饮酒史、用药情况(包括抗血小板药、降脂药、降压药、降糖药)、入院时血压(包括收缩压和舒张压)及实验室检查指标〔包括FBG、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、载脂蛋白A(apolipoprotein A,ApoA)、载脂蛋白B(apolipoprotein B,ApoB)、脂蛋白(a)及同型半胱氨酸(homocysteine,Hcy)〕。
1.3.2 影像学标志物 采用德国西门子公司3.0 T超导型磁共振扫描机进行颅脑扫描,成像序列包括T1加权成像(T1 weighted imaging,T1WI)、T2加权成像(T2 weighted imaging,T2WI)、液体抑制反转恢复(fluid attenuated inversion recovery,FLAIR)序列、弥散加权成像(diffusion weighted imaging,DWI)序列及SWI序列,层厚5 mm,层距3 mm。采用德国西门子公司64排螺旋CT扫描机完善头颅血管成像(MRA或CTA)。本研究观察的影像学标志物包括血管源性腔隙、WMH、血管周围间隙(perivascular spaces,PVS)、脑微出血(cerebral microbleeds,CMB)及脑萎缩情况。采用Fazekas量表(0~6分)分别评价脑室旁和深部WMH严重程度。采用4分半定量评分系统[7]评价基底核区和半卵圆中心PVS严重程度,其中0个PVS记为0分、1~10个PVS记为1分、11~20 个PVS记为2分、21~40个PVS记为3分、>40个PVS记为4分。CMB按照解剖区域划分为幕下/深部CMB和脑叶CMB[8]。记录所有患者全脑皮层萎缩(global cortical atrophy,GCA)分级[8],根据脑沟增宽、脑回萎缩伴或不伴脑室扩大将脑萎缩分为0~3级。
1.3.3 CSVD总负荷评分[9]记录所有患者CSVD总负荷评分,其标准如下:血管源性腔隙≥1个记为1分,深部WMH Fazekas量表评分≥2分和/或脑室旁WMH Fazekas量表评分为3分记为1分,深部或幕下CMB≥1处记为1分,基底核区PVS≥11个记为1分。
1.3.4 DMV视觉评分 DMV视觉评分系统是基于SWI序列制定的。为了覆盖大部分DMV,从基底核正上方的脑室水平开始到每个脑室立即消失的水平,连续选取5个侧脑室切片(层厚5 mm),在SWI相位图像上评估DMV。根据区域解剖[5]将双侧大脑的DMV分为6个区域,分别为双侧额叶、顶叶、枕叶。观察每个区域的DMV特征并采用4级评分法进行评估,其中0级:各静脉连续,信号均匀;1级:每条静脉连续,但1条或多条静脉信号不均匀;2级:1条或多条静脉不连续,呈点状低信号;3级:没有观察到连续的静脉。DMV视觉评分范围0~18分,评分越高表明DMV越不明显。图像由两名完全不了解受试者临床数据和疾病状态的神经科医生分别评估,如遇分歧则通过协商解决。
1.4 统计学方法 采用SPSS 26.0统计学软件进行数据处理,符合正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验;不服从正态分布的计量资料以〔M(P25,P75)〕表示,组间比较采用 Mann-Whitney U检验;计数资料以相对数表示,组间比较采用χ2检验。CSVD患者DWV视觉评分与CSVD总负荷评分的相关性分析采用Spearman秩相关分析;CSVD患者DWV视觉评分的影响因素分析采用多因素Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较 两组患者性别、BMI、入院时收缩压、入院时舒张压、FBG、HbA1c、TG、HDL-C、LDL-C、ApoA、脂蛋白(a)及有心房颤动病史、有冠心病病史、有吸烟史、有饮酒史、服用抗血小板药、服用降脂药、服用降糖药者所占比例比较,差异无统计学意义(P>0.05);DMV高分组患者年龄大于DMV低分组,有高血压病史、有糖尿病病史、有脑梗死病史、服用降压药者所占比例及Hcy高于DMV低分组,TC、ApoB低于DMV低分组,差异有统计学意义(P<0.05),见表1。
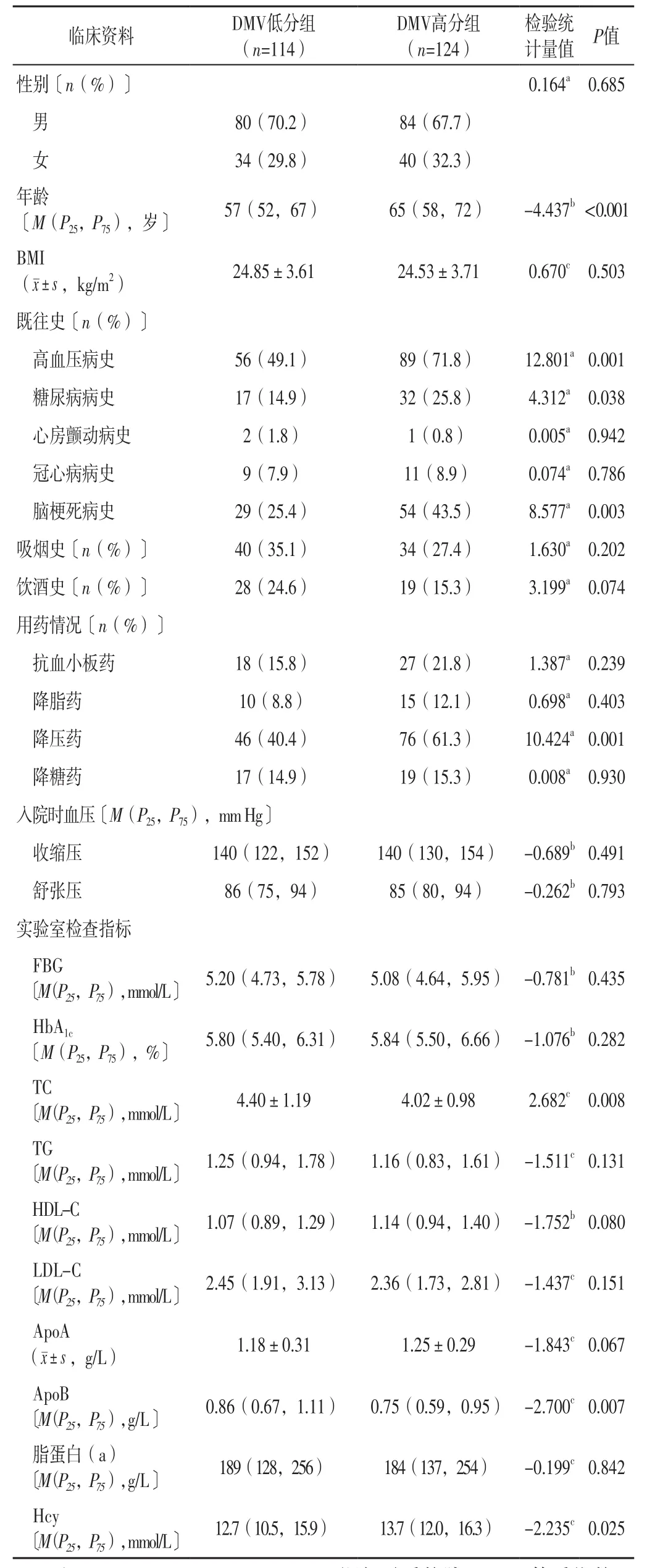
表1 两组患者临床资料比较Table 1 Comparison of clinical data between the two groups
2.2 影像学标志物及CSVD总负荷评分 本组患者发生血管源性腔隙107例(占45.1%)、WMH 223例(占93.7%)、PVS 190例(占79.8%)、CMB 145例(占60.9%)、脑萎缩57例(占23.9%)。两组患者血管源性腔隙发生率、半卵圆孔中心PVS评分及GCA分级比较,差异无统计学意义(P>0.05);DWV高分组患者室旁WMH、深部WMH、脑叶CMB、幕下/深部CMB发生率及基底核区PVS评分、CSVD总负荷评分高于DMV低分组,差异有统计学意义(P<0.05),见表2。
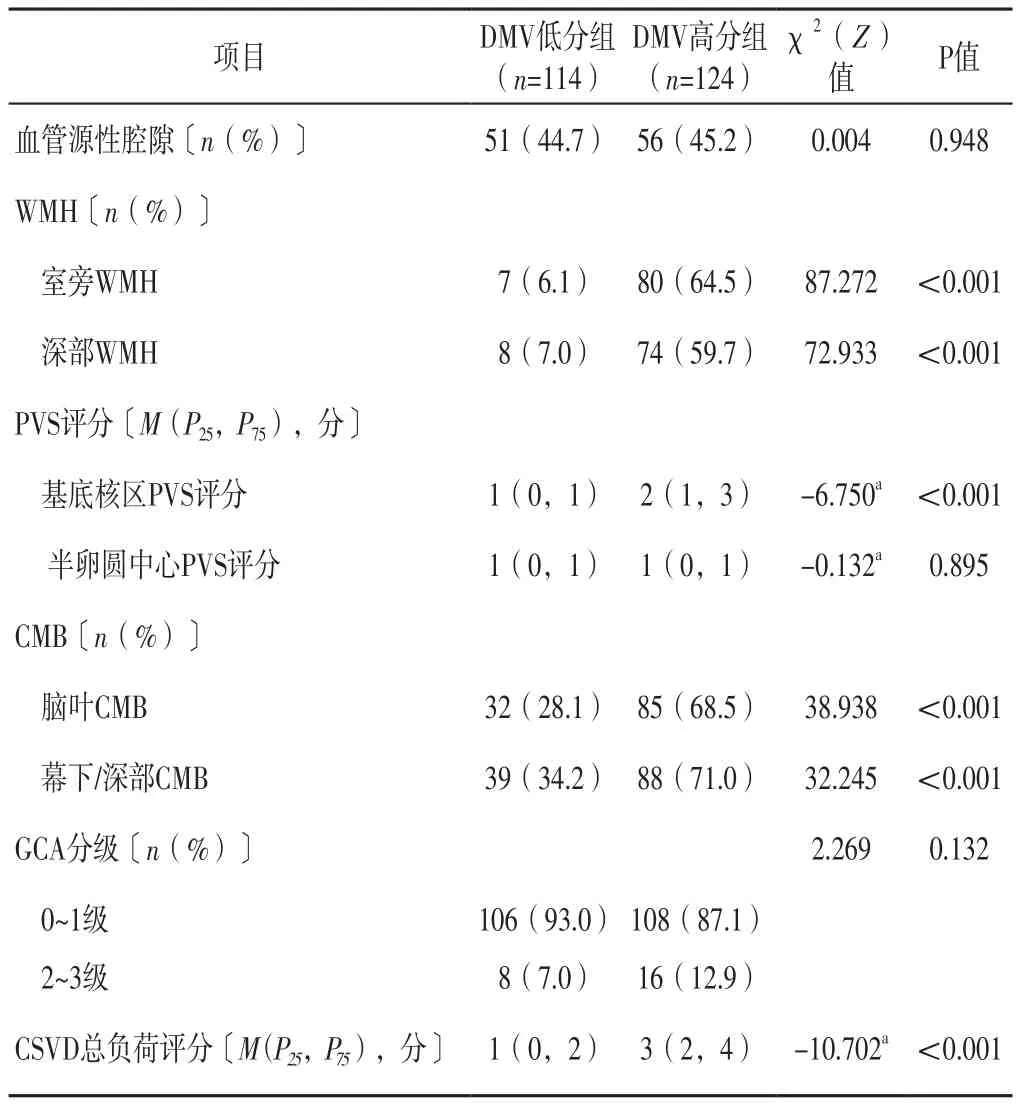
表2 两组患者影像学标志物及CSVD总负荷评分比较Table 2 Comparison of imaging markers and CSVD total load score between the two groups
2.3 相关性分析 Spearman秩相关分析结果显示,CSVD患者DMV视觉评分与CSVD总负荷评分呈正相关(rs=0.717,P<0.001)。
2.4 CSVD患者DMV视觉评分影响因素的多因素Logistic回归分析 以CSVD患者DMV评分为因变量(赋值:<8分=0,≥8分=1),以表1~2中差异有统计学意义的指标作为自变量(降压药与高血压病史存在共线情况,故仅纳入高血压病史),进行多因素Logistic回归分析,结果显示,年龄、室旁WMH、深部WMH、CSVD总负荷评分是CSVD患者DMV视觉评分的独立影响因素(P<0.05),见表3。

表3 CSVD患者DMV视觉评分影响因素的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis on influencing factors of DMV visual score in patients with CSVD
3 讨论
本研究结果显示,CSVD患者DMV视觉评分与CSVD总负荷评分呈正相关,提示DMV可见性越低则发生严重CSVD的可能性越大,原因可能为DMV的可见性降低与静脉血流动力学改变或静脉阻塞后脑血流减少有关,与SHAABAN等[10]研究结果一致;而脑血流动力学改变是CSVD形成及发展的重要原因,故推测DMV可能参与CSVD的形成及发展。
本研究结果还显示,年龄、室旁WMH、深部WMH、CSVD总负荷评分是CSVD患者DMV视觉评分的独立影响因素。年龄是CSVD流行病学中最常见的风险因素,静脉胶原沉积可随年龄增长而增加,进而导致静脉狭窄和闭塞;且老年人存在低灌注和低代谢情况,进一步导致狭窄的DMV血液供应不足,表现为DMV的可见性降低[11]。既往研究表明,脑室周围及深部WMH与DMV可见性降低独立相关,与腔隙、PVS、CMB及脑萎缩严重程度无关[5,8]。病理学研究表明,在WMH区域的DMV存在胶原沉积,而静脉胶原沉积会导致静脉壁增厚、狭窄和闭塞[3]。DMV位于脑白质内,在SWI上显示不连续信号或可见性降低。KEITH等[4]研究发现,DMV可见性降低可能提示静脉胶原病,而静脉胶原病可能是WMH的潜在致病机制。最新研究发现,阿尔茨海默病(Aizheimer's disease,AD)和老年非AD患者脑室周围静脉胶原病与WMH严重程度相关,而DMV可见性降低与认知功能下降和痴呆有关[12]。本研究结果表明,CSVD患者DMV可见性降低与脑白质损伤相关,而脑白质损伤又与认知功能下降密切相关,后续研究可探讨DMV可见性降低导致认知功能下降的潜在机制。
综上所述,CSVD患者DWV可见性与CSVD总负荷评分呈正相关,而室旁WMH、深部WMH及CSVD总负荷可能是其DMV可见性降低的因素,这进一步支持了静脉胶原沉积在WMH发病中的作用。但本研究为横断面研究,DMV变化是一个渐进的过程,且DWV在CSVD发生发展中的作用机制有待进一步研究。
作者贡献:沈娜、牟英峰、巩诗彤、李晴晴、孙浩、耿德勤进行文章的构思与设计;沈娜、牟英峰、耿德勤进行研究的实施与可行性分析;沈娜、巩诗彤、李晴晴、孙浩进行数据收集、整理、分析;沈娜进行结果分析与解释,负责撰写、修订论文;耿德勤负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。

