扶肺固肾饮对慢性阻塞性肺疾病大鼠气道炎症及糖皮质激素受体的影响
梁爱武,吴官柱,龙 馨,赖庆来,李 军,罗珍瑶,韦筱园,李 婷,黄天圆
(1.广西中医药大学附属瑞康医院,广西 南宁 530011;2.广西中医药大学,广西 南宁 530001)
慢性阻塞性肺疾病(chronic obstructive Pulmonary disease,COPD)是一种内科常见的、以持续气流受限和呼吸症状为特征的可防治的异质性疾病[1]。最新的流行病学数据显示,COPD 的全球患病 率 约 为11.7%[2],全 世 界 共 有3.84 亿 人 患 有COPD,其中约有6 500 万人被诊断患有中度至重度COPD[3]。世卫组织预测,至2030 年,COPD 年死亡率可达450 万,成为第三大死亡原因[4]。而中国总患病人数约9 990 万,已造成重大疾病负担[5]。COPD 是慢性肺部和气道炎症性疾病,炎症因子使气道及肺组织炎症反应增强,导致肺功能呈进行性下降[6],并影响糖皮质激素受体(glucocorticoid receptor,GR)的活性[7],部分患者对糖皮质激素(glucocorticoids,GC)治疗不敏感,产生GC 抵抗[8,9]。寻找能有效提高COPD 患者对GC 敏感性的药物成为治疗面临的主要挑战。
前期临床研究表明[10-14],使用扶肺固肾饮联合舒利迭吸入治疗COPD 稳定期重度、极重度患者可明显改善临床证候积分、BODE 指数、减少年发作次数、提高患者生活质量。为探讨扶肺固肾饮的作用机制,本研究用烟熏联合脂多糖、冷空气刺激制造COPD 大鼠模型,予以不同浓度的扶肺固肾饮进行干预,探讨该药对COPD 大鼠气道炎症及糖皮质激素受体的影响。
1 材料与方法
1.1 动物
选取50 只8 周龄Wistar 雄性大鼠,体重180~220 g,适应性饲养7 d。大鼠为长沙市天勤生物技术有限公司提供,动物许可证编号SCXK(湘)20140010。本实验通过广西中医药大学实验动物伦理委员会批准。
1. 2 药物及配制
扶肺固肾饮组成:山萸肉20 g,生地20 g,山药30 g,党参20 g,大枣10 g,陈皮15 g,茯苓25 g,桔梗15 g,苏子15 g,丹皮10 g,泽泻15 g,白术20 g,生姜10 g,姜半夏20 g,丹参10 g,生龙骨30 g,炙甘草10 g。由广西中医药大学附属瑞康医院向江阴天江药业有限公司购入中药颗粒,每付颗粒重量为50 g。
1.3 主要试剂与仪器
真龙牌香烟(烟碱量1.4 mg/盒,焦油量14 mg/盒,由广西卷烟总厂生产);脂多糖,Solarbio 公司;水合氯醛晶体,成都市科隆化学品有限公司;酒精,Solarbio 公司;大鼠肿瘤坏死因子α(TNF-α)、大鼠转化生长因子β1(TGF-β1)、大鼠白介素-17A(IL-17A)、基质金属蛋白酶(MMP-9)、金属蛋白酶抑制剂1(TIMP-1)酶联免疫试剂盒均购于武汉华美生物工程有限公司,RT、PCR、总RNA 提取试剂盒均购于宝生物TaKaRa 公司;DAB 显色试剂盒、SP 免疫组化试剂盒购于北京中杉金桥生物公司;自制大鼠造模烟熏箱:大小为150 cm×80 cm×50 cm,每侧均设有小孔;离心机,吴诺斯生物。
1.4 COPD 大鼠模型的制备及分组
50 只Wistar 雄性大鼠,随机分为5 组:空白对照组、COPD 模型组及扶肺固肾饮高、中、低剂量组,每组10 只,除空白对照组,其余4 组以烟熏联合脂多糖、冷空气刺激制造COPD 大鼠模型:第1、14 天用10%水合氯醛溶液对大鼠进行麻醉,将0.1 mL脂多糖(1 mg/mL)滴入大鼠气管内,将大鼠朝上提起,使脂多糖均匀分布于大鼠的左右两肺。第2~28 天(第14 天除外)将造模组大鼠置于自制烟熏箱内,内熏15 支真龙牌香烟,30 min/次,一天两次。空白对照组于第1、14 天将0.1 mL 的生理盐水注入到大鼠的气管内。造模结束后,随机法处死2 只空白对照组、2 只模型组大鼠,将其全肺组织送至广西中医药大学附属瑞康医院做病理学检测确定已成功造模,将余下大鼠随机分组为模型组和扶肺固肾饮高、中、低剂量组。
造模成功后,空白对照组、COPD 模型组予蒸馏水3 mL/只灌胃,扶肺固肾饮高、中、低剂量组分别予1.02、0.51、0.26 g 中药配方颗粒/100 g/d 灌胃,每日2 次,连续给药28 d。
1.5 给药
造模完成后,给予中药干预,依据药理实验方法学第4 版,按照人和大鼠计量换算系数6.17 计算可得高、中、低剂量中药组每100 g 大鼠所需中药配方颗粒分别为1.02 g/d、0.51 g/d、0.26 g/d。将已加热的蒸馏水(6 mL/只)、中药颗粒混匀,得到各组大鼠1 d 所需的中药量。灌胃给药时,于每日9:00、18:00,分两次,3 mL/次,连续28 d。空白对照组、模型组给予3 mL/次/只蒸馏水。连续28 d。期间需观察实验鼠状态、呼吸、咳嗽、反应速度、进食饮水量、口鼻分泌物及大小便情况,每7 天记录1 次大鼠体重。
1.6 样本采集及处理
1.6.1 血清、肺泡灌洗液制备与处理 各组大鼠灌胃28 d 后采集样本,将大鼠麻醉,把大鼠的腹部脏器拔向一侧,使大鼠腹主动脉充分暴露后采血,采血量约为3 mL/只。取血完成后,使大鼠气管充分暴露,从气管1/2 处用一次性注射器注入2 mL 生理盐水,然后回抽1.5 mL,灌洗3 次。将收集好的血清、右肺泡灌洗液离心后取上清液进行分装放置在-80 ℃冰箱中备用。
1.6.2 肺组织的提取 血清及右肺泡灌洗液(BALF)采集完毕后,将大鼠胸腹部的皮肤剪开,使胸腔、腹腔暴露,快速取出左肺组织并放置于4%甲醛中固定备用。
1.7 指标测定
1.7.1 苏木素-伊红染色观察大鼠肺组织病理形态学的变化 取肺组织切片,行苏木素-伊红染色,中性树胶封片后,用光学显微镜观察组织病理结构。
1.7.2 大鼠血 清及右BALF TNF-α、TGF-β1、IL-17A 以及左肺组织中MMP-9、TIMP-1 的含量检测 采用酶联免疫吸附试验测定实验鼠血清和右BALF TNF-α、TGF-β1、IL-17A 以 及 左 肺组 织 中MMP-9、TIMP-1 的含量,操作遵循试剂盒说明书。反应终止后,立即在450 nm 波长处用酶标仪测定每孔的吸光度(OD 值),通过数据计算TNF-α、TGF-β 1、IL-17A、MMP-9、TIMP-1 的含量。
1.7.3 大鼠肺组织GR mRNA 和蛋白测定 用免疫组织化测定各组大鼠左肺组织中糖皮质激素受体表达水平。采集各组免疫组化切片的图像,使用软件Image-Pro Plus 6.0 对结果进行分析,并求出GR 的平均灰度值。采用RT-PCR 测定各组大鼠左肺组织的GR mRNA 表达水平。
1.8 统计学处理
采用SPSS20.0 统计软件,对各组数据进行分析,计量资料以描述,多组间用单因素方差分析,组间比较用LDS 法(方差齐)或秩和检验(方差不齐),P<0.05 表示差异有统计学意义。
2 结果
2.1 大鼠一般情况比较
空白对照组大鼠整体状态好,皮毛光泽,呼吸平稳,体重增长正常,反应敏捷,进食及摄水量均正常。模型组大鼠整体状态差,毛发无光泽并有明显脱落现象,出现咳嗽、气喘,口鼻可见白色稀薄分泌物,体重增加速度明显变慢,反应变迟钝,进食及摄水量减少。经扶肺固肾饮干预后,大鼠一般情况较模型组均有所好转,中剂量组好转度高于高、低剂量组。造模期间模型组、高剂量中药组、低剂量中药组大鼠各死亡1 只,给药期间3 组中药干预组大鼠各死亡1 只。
2.2 大鼠肺组织病理形态学的变化
空白对照组大鼠支气管黏膜上皮结构相对完整,纤毛排列较整齐,无炎细胞浸润,肺泡壁结构相对完整,泡腔无扩大(图1A)。模型组大鼠支气管黏膜上皮细胞变性、坏死,杯状细胞增生,纤毛黏连、缩短、部分脱落,肺泡壁变薄断裂,大量炎性细胞浸润,出现肺大泡(图1B)。扶肺固肾饮高、中、低剂量组大鼠气道黏膜上皮结构较完整,纤毛排列相对模型组整齐,炎性细胞及肺大泡形成相比模型组少(图1C、D、E);表明扶肺固肾饮可改善COPD 大鼠的气道炎症反应,见图1。
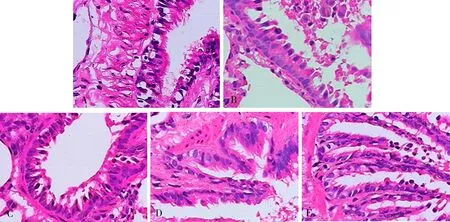
图1 扶肺固肾饮对COPD 大鼠肺组织结构影响(HE,×400)Fig 1 Effect of Fufei Gushen Decoction on organizational structure of lung tissue of COPD rats
2.3 各组大鼠血清及右BALF 中TNF-α、TGF-β1、IL-17A 的含量比较
与空白对照组相比,模型组大鼠血清及右BALF 中TNF-α、TGF-β1、IL-17A 的 含 量 明 显 增加,差异有统计学意义(P<0.01)。与模型组相比,各中药干预组大鼠血清及右BALF 中TNF-α、TGF-β1、IL-17A 的含量均有所减少,差异有统计学意义(P<0.05),其中中剂量组大鼠血清及右BALF中TNF-α、TGF-β1、IL-17A 减少量明显多于高剂量组、低剂量组,差异有统计学意义(P<0.05)。见表1、2。
表1 各组大鼠血清中TNF-α、TGF-β1、IL-17A 含量的比较(pg/mL,)Tab 1 TNF-α,TGF-β1,IL-17A levels in serum of rats(pg/mL,

表1 各组大鼠血清中TNF-α、TGF-β1、IL-17A 含量的比较(pg/mL,)Tab 1 TNF-α,TGF-β1,IL-17A levels in serum of rats(pg/mL,
注:与空白对照组比较,*P<0.01;与模型组比较,#P<0.05,βP<0.01,ΔP<0.001;与中剂量中药组相比,αP<0.05,kP<0.01。
IL-17A 15.21±3.87 24.36±4.85*19.51±3.86#α 16.26±3.91Δ 17.38±4.05βk 5.799 0.001组别空白对照组模型组高剂量中药组中剂量中药组低剂量中药组n 10 98 9 8 FP TNF-α 65.08±12.25 152.47±20.36*110.73±10.49#α 82.27±11.81Δ 97.07±15.74βk 40.149<0.001 TGF-β1 86.58±10.19 210.74±11.63*174.66±12.78#α 120.25±10.98Δ 147.05±12.46βk 129.645<0.001
2.4 各组大鼠左肺组织中MMP-9、TIMP-1 的表达比较
表2 各组大鼠右BALF 中TNF-α、TGF-β1、IL-17A 含量的比较(pg/mL,)Tab 2 TNF-α,TGF-β1,IL-17A levels in right BALF of rats(pg/mL,
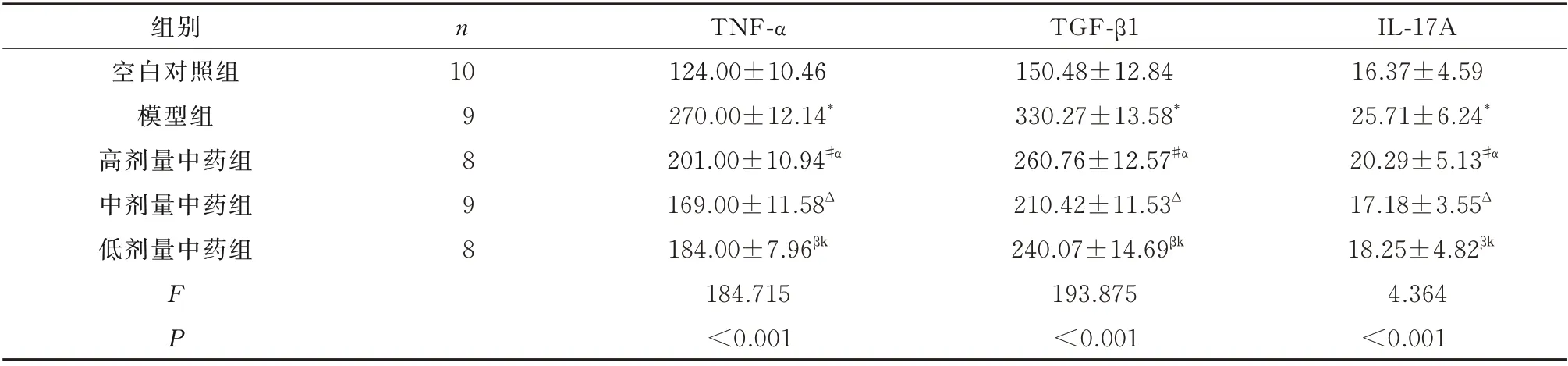
表2 各组大鼠右BALF 中TNF-α、TGF-β1、IL-17A 含量的比较(pg/mL,)Tab 2 TNF-α,TGF-β1,IL-17A levels in right BALF of rats(pg/mL,
注:与空白对照组比较,*P<0.01;与模型组比较,#P<0.05,βP<0.01,ΔP<0.001;与中剂量中药组相比,αP<0.05,kP<0.01。
IL-17A 16.37±4.59 25.71±6.24*20.29±5.13#α 17.18±3.55Δ 18.25±4.82βk 4.364<0.001组别空白对照组模型组高剂量中药组中剂量中药组低剂量中药组n 10 98 9 8 FP TNF-α 124.00±10.46 270.00±12.14*201.00±10.94#α 169.00±11.58Δ 184.00±7.96βk 184.715<0.001 TGF-β1 150.48±12.84 330.27±13.58*260.76±12.57#α 210.42±11.53Δ 240.07±14.69βk 193.875<0.001
与空白对照组相比,模型组大鼠肺组织中MMP-9 的表达明显增加、TIMP-1 的表达明显减少,差异有统计学意义(P<0.05);与模型组相比,各中药干预组大鼠肺组织中MMP-9 的表达均有所减少、TIMP-1 的表达均有所增加,差异有统计学意义(P<0.05);其中扶肺固肾饮中剂量组大鼠肺组织中MMP-9 减少量与TIMP-1 的增加量明显多于高剂量、低剂量组,差异有统计学意义(P<0.05)(表3)。

表3 各组大鼠肺组织匀浆中MMP-9、TIMP-1 的表达(OD 值)Tab 3 MMP-9 and TIMP-1 levels in lung tissue homogenate of rats(OD value)
2.5 各组大鼠左肺组织中GR mRNA 和蛋白水平比较
与空白对照组相比,模型组大鼠肺组织中GR mRNA 和蛋白的表达明显减少,差异有统计学意义(P<0.05)。与模型组相比,各中药干预组大鼠肺组织中GR mRNA 和蛋白的表达均有所增加,差异有统计学意义(P<0.05),其中扶肺固肾饮中剂量组大鼠肺组织中GR mRNA 和蛋白的增加量明显多于高剂量组、低剂量组,差异有统计学意义(P<0.05)(表4)。GR 阳性表达率见图2。
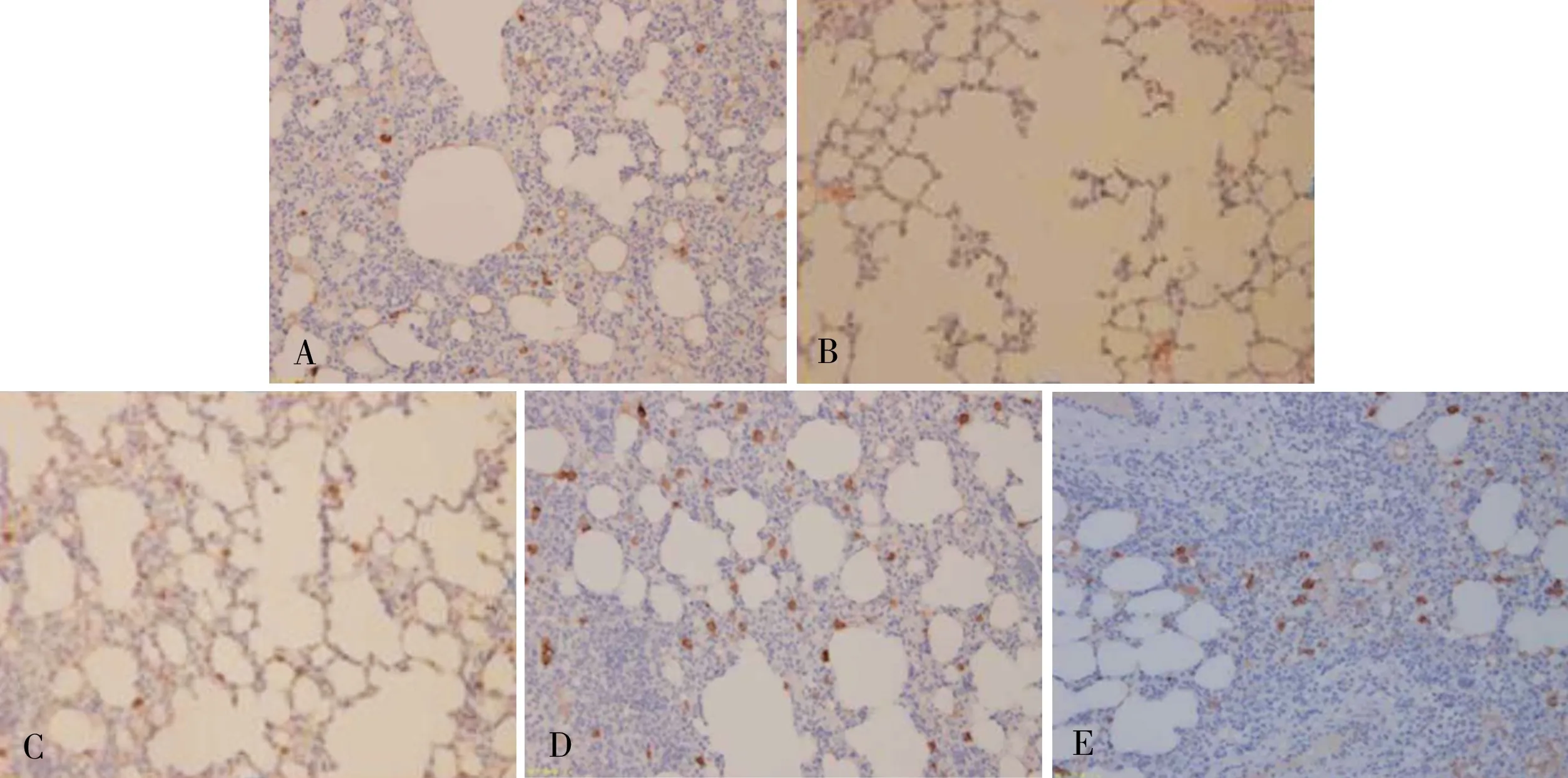
图2 各组大鼠免疫组化GR 表达阳性表达图(光学显微镜,×400)Fig 2 Expression of GR in lung tissue of rats by immunohistochemical method(light microscope,×400)
表4 各组大鼠肺组织GR mRNA 和蛋白水平Tab 4 mRNA and protein expression of GR in lung tissue of rats

表4 各组大鼠肺组织GR mRNA 和蛋白水平Tab 4 mRNA and protein expression of GR in lung tissue of rats
组别空白对照组模型组高剂量中药组中剂量中药组低剂量中药组n 10 98 9 8 FP GR mRNA 0.350±0.037 0.110±0.020 0.363±0.051 0.591±0.038 0.310±0.034 164.735 0.000 GR protein 305.76±23.12 112.62±9.87 386.91±40.53 678.28±50.32 360.65±30.65 276.564 0.000
3 讨论
肺部和气道慢性炎症是COPD 的主要特征,细胞炎症因子损伤为COPD 病情进展的核心机制[15],TGF-β1、蛋白酶-抗蛋白酶失衡对COPD 气道重塑有关键作用[16]。有研究表明,TNF-α、TGF-β1、IL-17A 及MMP-9 表达水平高低均与COPD 损害程度呈正相关[17-20]。其中IL-17A 具有较强的促炎作用,是广泛表达的前炎性细胞因子,参与炎症细胞如TNF-α 的活化过程,并诱导炎症细胞气道浸润[21],气道炎症又是引起TGF-β1 在肺内高表达的根本原因[22],而MMP-9 与TIMP-1 的比例是气道组织破坏与修复平衡的标志[23]。由此可见,有效地降低TNF-α、TGF-β1、IL-17A、MMP-9 表达水平,增加TIMP-1 的表达水平,可在一定程度上减缓COPD病情进展。
糖皮质激素是目前治疗COPD 稳定期患者最为广泛使用的抗炎药物,其抗炎作用表达需要与GR 相结合[24]。但临床中糖皮质激素对COPD 进行性发展的控制效果不佳[25,26],考虑部分COPD 患者存在糖皮质激素抵抗可能性,提高糖皮质激素疗效成了治疗COPD 的切入点。多项研究[27,28]表明中医药在减轻糖皮质抵抗方面疗效显著,本研究也发现COPD 大鼠在加用扶肺固肾饮干预后,其肺组织中GR mRNA 及蛋白的表达较模型组升高,具有一定的提高糖皮质激素疗效的功效。
COPD 归属于中医“肺胀病”,其病位在肺,可致脾肾亏虚,以痰瘀内阻为标,肺脏、脾脏、肾脏亏虚为本[29,30]。本研究基于“补肺固肾,化痰祛瘀”,采用扶肺固肾饮进行治疗。扶肺固肾饮是梁爱武教授依据多年临床治疗COPD 经验以及COPD 的发病特点,以六君子汤合六味地黄丸加减化裁而来。方中党参、山药补肺健脾,山茱萸、生地黄可补益肝肾,此四味君药共同补益肺肾、益气养阴。茯苓、泽泻利湿化浊,丹皮活血化瘀和泻热,三者形成“三泻”之功,加白术以助茯苓健脾祛湿。陈皮、半夏、生姜化痰止咳,桔梗化痰并载药上行至肺,生龙骨、苏子降气止咳平喘,加丹参以祛瘀,大枣可健脾,炙甘草可调诸药。治疗COPD 稳定期病人,扶肺固肾饮可达标本兼治的效果。在本实验中可以观察到COPD 大鼠模型组TNF-α、TGF-β1、IL-17A 等炎症因子明显升高,说明COPD 大鼠气道炎症反应较为明显。而模型组大鼠经扶肺固肾饮干预后,炎症因子水平较前明显下降,同时MMP-9 表达减少,TIMP-1 表达有所增加,尤以中剂量扶肺固肾饮改善效果最佳,证实扶肺固肾饮可作用于不同途径以降低气道炎症反应及减少气道重塑的作用,为有效的治疗药物。
综上所述,扶肺固肾饮可以通过降低大鼠血清和肺泡灌洗液中TNF-α、TGF-β1、IL-17A 的含量,减少肺组织中MMP-9、增加TIMP-1 的表达,最终改善COPD 大鼠气道炎症反应、减少气道重塑。同时可增加肺组织中GR mRNA 及蛋白的表达,以减少糖皮质激素抵抗从而增加糖皮质激素疗效。
本实验主要研究了扶肺固肾饮对慢性阻塞性肺 疾 病 大 鼠TNF-α、TGF-β1、IL-17A 及MMP-9、TIMP-1 表达及糖皮质激素受体的影响,但具体作用靶点及机理未明确,大鼠气道炎症指标也远不仅于此。本研究时间较短,在实验过程中存在误差,可能会影响实验数据的准确性,对研究结果产生一定的偏倚。未来可尝试进一步试验,探讨扶肺固肾饮可能的作用机理及药物的作用靶点,以达到精准治疗,以及进一步研究扶肺固肾饮对慢性阻塞性肺疾病大鼠其他气道炎症指标表达的影响,为中医药有效防治慢性阻塞性肺疾病做出进一步的贡献。

