脑疏宁胶囊对小鼠的急性和长期毒性实验观察
刘庆义,张寰,严云卷,陈彤,杨媛,张梅奎
1 解放军总医院 远程医学中心,北京 100853;2 解放军总医院第二医学中心 神经内科,北京 100853;3 战略支援部队特色医学中心 神经内科,北京 100101
脑疏宁胶囊是解放军总医院中医世家张梅奎主任历经多年临床研究探索出的治疗脑卒中的经验方,临床疗效确切,毒性、不良反应小[1]。该方由益母草、水蛭、三七、川牛膝等8 味中草药组成,具有活血逐瘀,利水通腑之功效,适用于缺血性脑卒中急性期及恢复期,属痰瘀痹阻证,症见半身不遂、口舌歪斜、言语蹇涩或不语、偏身麻木、便干便秘、头晕目眩、痰多而黏、舌质暗红、苔黄腻、脉滑数等[2-4]。前期有效性研究表明,脑疏宁对脑缺血再灌注损伤大鼠恢复神经功能、降低梗死范围、抗脂质过氧化、抑制炎症细胞因子和黏附分子表达、抑制自由基生成和减轻创伤性脑水肿等方面的药理作用[5-11]。前期已完成生产工艺、质量控制体系的研究工作。本研究根据中药新药的申报要求[12],通过开展脑疏宁急性毒性和长期毒性实验研究,为该药的临床前安全性评价、临床剂量设计和临床毒性、不良反应监测提供参考依据。
材料与方法
1 实验动物 健康昆明种小鼠40只,雌雄各半,体质量(20 ± 2) g,由解放军军事科学院军事医学研究院实验动物中心提供,动物许可证号:SCXK-(军)2015-003。健康SD 大鼠120只,雌雄各半,体质量(165 ± 15) g,由解放军总医院实验动物中心提供,动物许可证号:SCXK-(军)2015-001。动物饲养于二级屏障环境内,由获得资格认可的人员饲养。实验期间自由进食饮水。控制环境为温度(23 ± 5)℃,湿度(60 ± 20)%,12 h 照明,12 h 黑暗。每天清洁笼子换垫料1 次。
2 药物及主要仪器 0.9%氯化钠注射液,石家庄四药有限公司,批号H13023200。脑疏宁胶囊(0.5 g/粒) 由北京麦迪海药业有限责任公司制备,批号:050618。本品成品相当于5 g(生药)/1 g(胶囊),临用时用水稀释配制成45%(以胶囊内容物计,取原料药100 mL,稀释至156.4 mL,浓度即为45%)的浓度备用。临床成人日用剂量为4.5 g,按体质量60 kg计,即0.075 g/kg。低温高速离心机(德国Heraeus 公司);日立7020 自动生化分析仪(日本日立公司);SYSMEX XT-2000iv 型全自动血球计数仪(日本Sysmex Corporation 公司);CA1500全自动血凝分析仪(日本SYSMEX 公司);多参数血细胞计数分析仪(美国JT-IR 公司);TDL-5 台式低速大容量离心机(江苏金坛市医疗仪器厂)。
3 急性毒性实验 用最大给药量法进行急性毒性实验[13-14]。选用昆明种小鼠40只,随机分为实验组和对照组,每组20只,雌雄各半,分笼饲养,禁食不禁水16 h后,实验组按最大给药量法灌胃1次,灌胃体积为0.8 mL/20 g,剂量为18 g/kg,此剂量相当于成人用量的240 倍。对照组给予等容量0.9%氯化钠注射液灌胃。观察14 d 内小鼠体质量、活动、行为、饮食、毛色等一般状态及有无死亡,观察主要脏器外观形态有无异常表现。
4 长期毒性实验 按照长期毒性实验的有关技术要求[15-16],将120 只健康SD 大鼠随机分为4组,每组30只,雌雄各半,每天给药1次,连续给药13 周。低剂量组1.8 g/kg、中剂量组3.6 g/kg、高剂量组7.2 g/kg,对照组给予等容量0.9% 氯化钠注射液灌胃。每天观察动物有无死亡及其外观体征、行为活动、腺体分泌、呼吸、毛色、饮食、二便等一般状况,每周称1 次体质量和饲料重。分别于给药结束后24 h 及停药后4周,取血测定血液学指标、血液生化学指标,剖取心、肝、肾、脑等脏器称重计算脏器指数并进行组织病理学观察。最后1 次给药后24 h,每组雌、雄各取10 只脊柱脱臼法处死进行血液学、血液生化、脏器相对质量及组织病理学检查。留下的动物继续观察4 周后同样方法处死,以便了解毒性反应的恢复情况和可能出现的延迟性毒性。
5 统计学方法 使用SPSS23.0 统计学软件对数据进行统计分析。研究资料主要为计量数据,均先行正态性检验。正态计量资料以表示,多组间的比较为单因素方差分析(统计量为F)+两两比较LSD-t检验(统计量为LSD-t)。重复观测资料行重复测量方差分析(统计量为F)+两两组间比较LSD-t检验(统计量为LSD-t)+两两时间比较差值t检验(统计量为t)。统计检验水准α=0.05,均为双侧检验,P<0.05 为差异有统计学意义。重复测量分析及分割检验的多次比较按Bonferroni 校正法进行检验水准调整,α'=0.05/n,n 为多次比较的次数。
结果
1 急性毒性实验 给药后两周内小鼠活动、行为、饮食、毛色等一般状态未见任何异常,无死亡,主要脏器外观未见明显异常。实验组不同时间的体质量变化与对照组差异无统计学意义(P>0.05,表1),说明脑疏宁胶囊对体质量无明显影响。
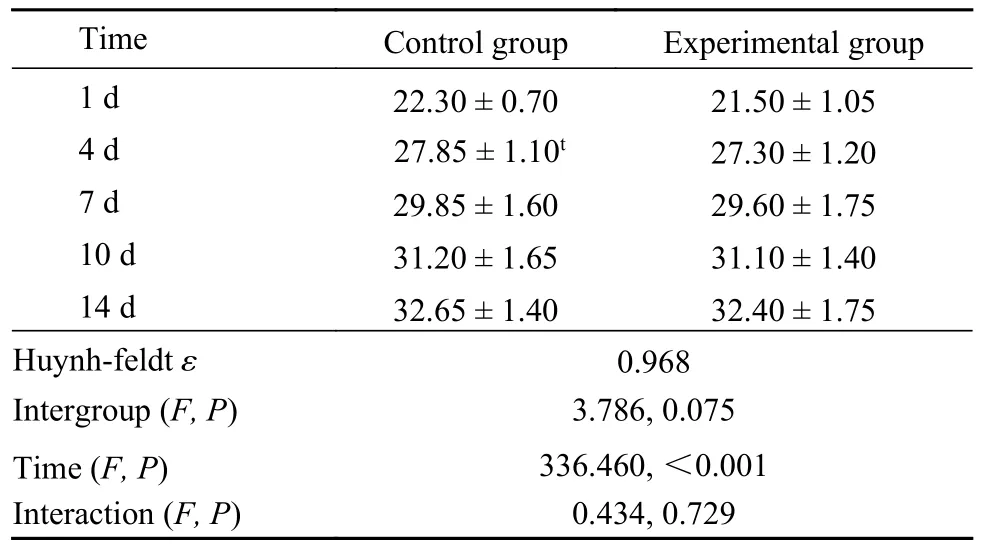
表1 脑疏宁胶囊急性毒性实验小鼠体质量(g,n=20)Tab.1 Body weight of mice in acute toxicity experiment of Naoshuning capsule (g,n=20)
2 长期毒性实验
2.1 一般情况 实验期间对照组和低、中、高3 个剂量组动物一般生理体征、行为活动、外观体征、粪便性状等均无异常。表2 中可以看出,给药组与对照组动物体质量变化总体趋势的差异无统计学意义。

表2 脑疏宁胶囊长期毒性实验动物体质量(g,n=20)Tab.2 Body weight of mice in long-term toxicity test of Naoshuning capsule (g,n=20)
2.2 血液学指标 表3 中可以看出,高剂量组白细胞计数显著升高(P<0.05),但在文献报道检测正常参考范围内(2.08×109/L~ 11.78×109/L)[17]其余指标各剂量组与对照组比较,差异均无统计学意义(P>0.05)。给药组血液学指标与对照组均在正常波动范围。
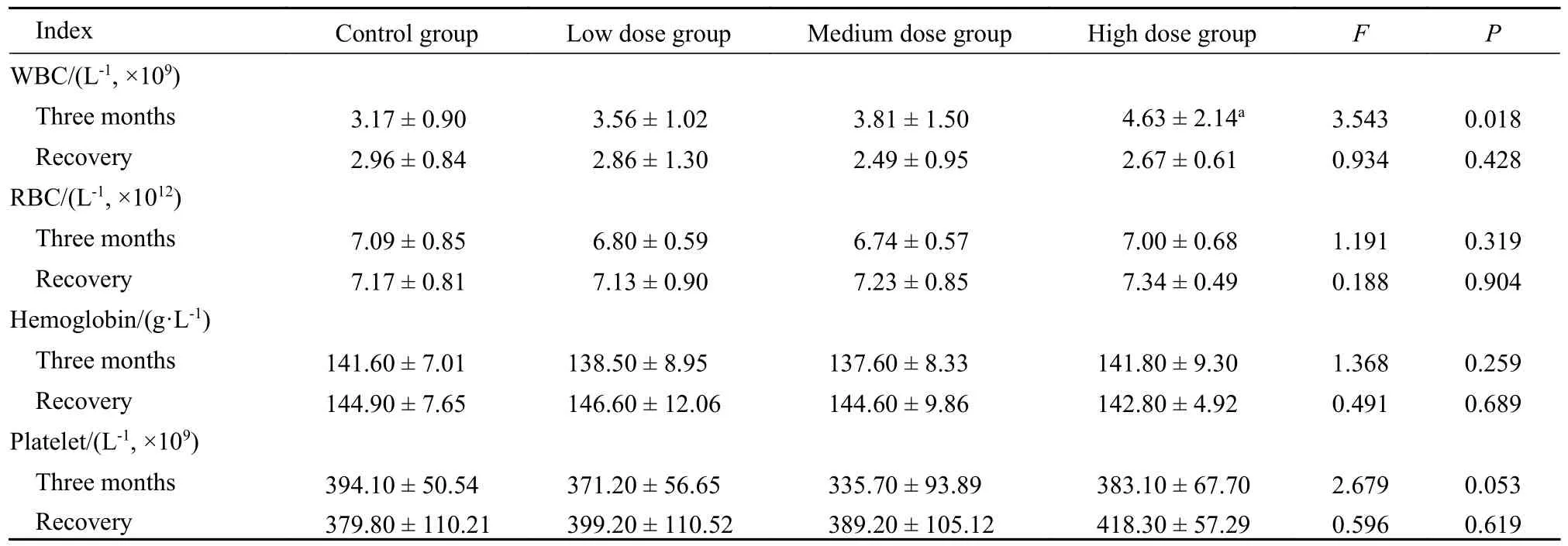
表3 脑疏宁胶囊长期毒性实验血液学指标(g,n=20)Tab.3 Hematologic indexes of long-term toxicity test of Naoshuning capsule (g,n=20)
2.3 血液生化学指示 表4 显示,中剂量组和高剂量组大鼠血液谷草转氨酶(aspartate aminotransferase,AST) 含量降低,高剂量组谷丙转氨酶(alanine aminotransferase,ALT)含量降低,中剂量组肌酐(creatinine,CRE) 含量降低,但波动均在文献报道检测正常参考范围内(雄性AST:144.50~91.42 U/L[18],雌 性AST:136.12~ 92.46 U/L[18],雌性ALT:50.60~ 34.6 U/L[19],雄性CRE:53.8~30.6 µmol/L[20])。各项血液生化指标均未见明显的异常波动。
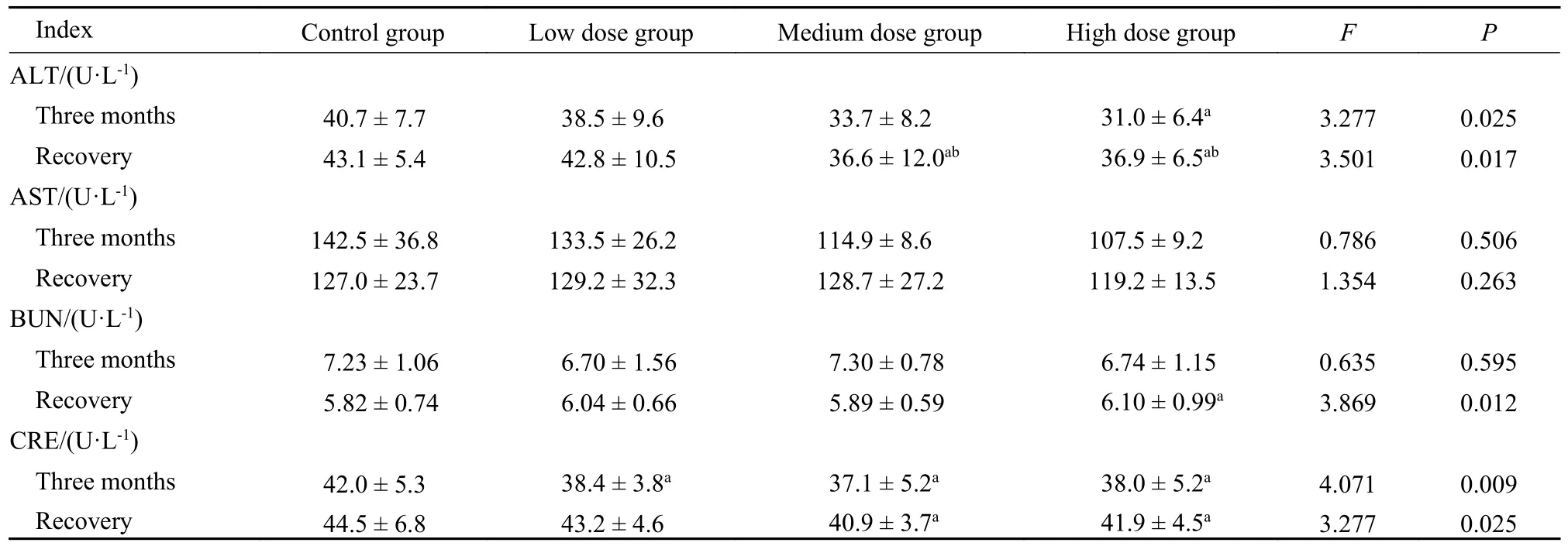
表4 脑疏宁胶囊长期毒性实验血液生化学指标(n=20)Tab.4 Biochemical indexes of long-term toxicity test of Naoshuning capsule (n=20)
2.4 脏器指数 从表5 可以看出,各剂量组脏器指数与对照组比较,差异多数无统计学意义(P>0.05)。脏器指数无明显变化。
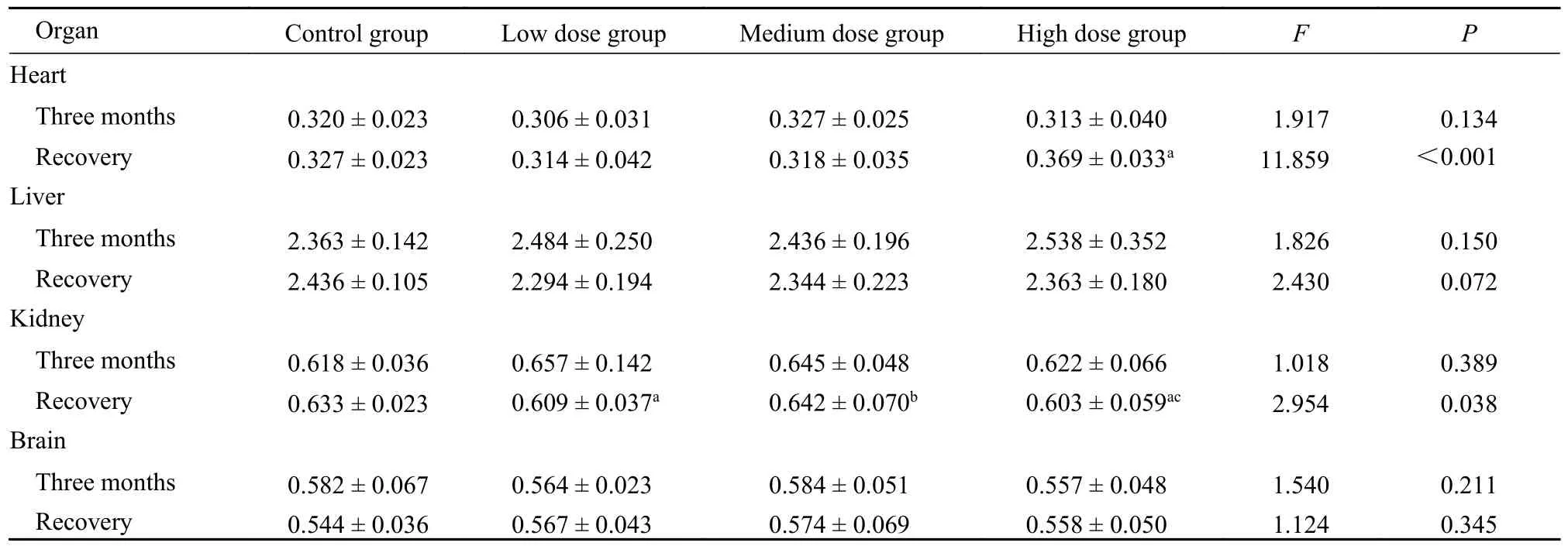
表5 脏器指数变化表(g/100 g 体质量,n=20)Tab.5 Changes of organ indexes (g/100 g body weight,n=20)
2.5 组织病理学检查 在给药结束及恢复期结束时检查动物,未发现眼睑、结膜、角膜、前房、虹膜、瞳孔、晶状体、眼底异常改变。对脏器组织进行病理形态学观察结果,给药组各脏器细胞结构均与对照组相似。
讨论
本实验设置对照组和给药组,急性毒性实验采用单次最大18 g/kg 剂量灌胃,此剂量相当于人拟用剂量的240 倍。关于单次最大给药量的说明:脑疏宁胶囊原料药浓度为1.19 g 浸膏/mL,每克浸膏含生药3.52 g,本品制成的成品相当于5 g(生药)/1 g(胶囊),由此计算,5÷3.52=1.42,即1 g 胶囊相当于1.42 g 浸膏,每毫升中含的胶囊量即为1÷1.42=0.704 g。相当于胶囊内容物配制成了70.4%的浓度(因此,为方便起见,本品的浓度及给药剂量均以胶囊内容物计算),称取一定量的脑疏宁胶囊原料药,逐渐加水稀释至相当于45%左右的浓度时,刚好能够抽入灌胃注射器。大于此浓度时,药液因黏稠而无法抽取,小鼠常规最大给药体积一般控制在0.8 mL/20 g,急性毒性实验胶囊内容物的最大浓度确定为45%,0.8×0.45÷0.02=18,即最大只能以18 g/kg 灌胃给药,相当的生药量为18×5=90,即相当于90 g(生药)/kg(体质量)。本品临床拟用剂量为4.5 g/d,60 kg 体质量人用量为4.5÷60=0.075 g/kg,因此小鼠最大给药剂量18 g/kg 相当于人拟用剂量的倍数为18÷0.075=240 倍。给药后两周内动物活动、行为、饮食、毛色等一般状态未见任何异常,无死亡现象,心、肝、脾、肺、肾及胃肠等主要脏器外观也未见明显异常,体质量变化也与对照组基本一致,各方面均未见明显的急性毒性反应,提示临床剂量安全可靠,并为后续长期毒性实验剂量设计提供参考依据。
长期毒性实验给药途径为灌胃,与人临床拟用途径相同,给药体积以最大给药体积2 mL/100 g 体质量计算。本实验低、中、高剂量分别为1.8 g/kg、3.6 g/kg、7.2 g/kg,分别相当于临床剂量的24 倍、48 倍、96倍,最小剂量大于药效学大剂量,其他剂量等比设计。高剂量组已经达到临床剂量的90 倍以上,以2 mL/100 g 体质量的给药体积灌胃,能够达到在长期大剂量下观察其安全性的目的[21-23]。
给药结束24 h 以及停药后4周,动物外观体征、行为活动、腺体分泌、呼吸、毛色、体质量、饮食、二便等一般状况均未见异常,血液学和血液生化指标检查也未见异常波动,主要脏器外观、湿重指数以及组织病理学观察与对照组比较,差异无统计学意义,表明没有明显的长期毒性反应,安全性较高。因此,脑疏宁胶囊并无明显靶器官毒性。
综上所述,脑疏宁胶囊急性毒性实验和长期毒性实验各方面均未出现明显的毒性反应,表明脑疏宁胶囊按临床拟用剂量长期服用具有较高的安全性,为临床应用的安全性评价、临床剂量设计和临床毒性、不良反应监测提供了科学依据,其适应证是以发病率高、致残率高、病死率高、复发率高和并发症多等为特点的脑卒中[24-25],脑卒中是严重威胁人民健康和生活的三大常见疾病之一。因此,本品有望成为一个具有良好开发前景的中药新药。

