T载体表达蛋白的分子生物学综合实验设计
戴 谷,陶年娇,朱 丹,石 力
(江苏第二师范学院 生命科学与化学化工学院,南京 211222)
分子生物学是生物科学专业的学位主干课之一,作为普通本科院校,如何充分利用有限的资源加强综合性和设计性实验的开展,提高学生的实验技能,是一个迫切需要解决的问题。
利用T载体的α互补现象方便高效地克隆PCR产物,是本科分子生物学一项常规实验,由于目前商品化的T载体一般只能在大肠杆菌中复制,不用于原核和真核表达,如果需要表达该外源基因还需再将该基因片段亚克隆至表达载体中[1-2],这样的实验安排使基因克隆和蛋白表达被人为割裂,缺乏连续性。选用T载体通过蓝白斑检测外源基因的插入虽然直观高效,却并不关注该插入基因的表达情况,学生对蛋白表达时需要保持阅读框的匹配,防止发生移码突变的要求认识不足,这为实验教学留下了遗憾。如果选用表达载体虽然能够连续完成基因克隆和蛋白表达两个实验内容,但筛选目的重组子的方法却不够直观,稍显繁琐。
1 实验设计思路
根据目前现有的一些有关构建T表达载体研究的报道[3-4],以lacZ’作为筛选标记的插入失活型高效T载体pMD18-T设计成兼具基因克隆和蛋白表达双重功能的克隆载体。pMD18-T载体自带乳糖操纵子,其lac启动子在大肠杆菌DH5α中可诱导lacZ’编码的β-半乳糖苷酶N端α-肽的合成,以蓝/白斑方式筛选重组子,虽然其表达量不高,但这一小段α-肽类似标签,与其阅读框匹配的序列可以顺利表达。商品化的pMD18-T载体是以克隆外源基因为目的,其质粒图谱中并不提供详细的阅读框信息,本研究利用此载体中的这一缺憾,引导学生设计3对使阅读框分别相差1位的引物,各自插入载体中构建重组载体,通过鉴定外源基因的表达情况,以试错的方式找到和α-肽阅读框保持匹配的融合蛋白,这样的实验设计可以使学生深入理解三联体密码以及移码突变,为今后从事蛋白表达相关实验时灵活设计实验方案奠定理论基础。
为便于观察和鉴定,选取绿色荧光蛋白(Green fluorescent protein, GFP)基因作为外源插入的目的基因[5],GFP是从发光水母(Aequoreavictoria)中分离获得的一种独特的天然荧光蛋白质,由238个氨基酸残基组成,分子质量约为27 ku的单链多肽,在488 nm激发光下呈现绿色荧光,可作为报告基因在原核和真核宿主中高效表达[6-7],并通过荧光显微镜直接对活体细胞进行观察[8-9]。
2 实验过程
2.1 材料
大肠杆菌DH5α菌株为本实验室保存。限制性内切酶、pMD18-T载体、Marker、Taq酶等常规分子试剂购自TaKaRa公司;抗生素、PCR纯化试剂盒购自上海生工;其他常规化学试剂均为国产分析纯试剂。pMD18-T载体经本实验室筛选,挑取自连环化,没有发生重组的单个蓝色克隆进行培养,获取质粒DNA后,分别用EcoR I和SalI进行单酶切线性化鉴定,证实这两个酶切位点正常。
2.2 方法
2.2.1 PCR 引物设计与合成
根据绿色荧光蛋白基因GFP序列设计4条引物:其中3条上游引物包含起始密码子ATG,其差异主要体现在ATG上游碱基数目分别依次相差一位,第4条为下游引物,包含终止密码子TAA;上游引物设计EcoR I酶切位点,下游引物设计SalI酶切位点,引物由英潍捷基(上海)贸易有限公司合成。
1#EcoRI-forward-1 5′-CCG GAA TTC GCC ACC ATG GTG AGC AAG-3′;
2#EcoRI-forward-2 5′-CCG GAA TTC GC ACC ATG GTG AGC AAG-3′;
3#EcoRI-forward-3 5′-CCG GAA TTC G ACC ATG GTG AGC AAG-3′;
4#SalI-reverse 5′-G CCG CTC GAG TTA CTT GTA CAG CTC GTC-3′。
2.2.2 载体构建
参考分子克隆实验指南[10],以质粒pEGFP-N1为模板,分别用3对特异性引物扩增GFP基因。扩增条件:94 ℃预变性5 min;94 ℃ 变性40 s,55 ℃退火50 s,72 ℃延伸50 s,30个循环;最后72 ℃再延伸8 min。回收纯化3条PCR产物,分别用EcoR I和SalI双酶切pMD18-T载体和3条PCR产物。纯化后将3条PCR产物分别和pMD18-T载体用T4 DNA连接酶连接过夜,连接产物转化DH5α感受态细胞,涂布于含100 μg/mL氨苄青霉素的LB固体培养基中培养12~16 h,利用α-互补进行蓝白菌落的筛选,分别挑选白色的阳性克隆进行酶切鉴定,连接正确者分别对应标记为pMD18-T-GFP-1、pMD18-T-GFP-2、pMD18-T-GFP-3。
2.2.3 GFP的诱导表达和蛋白凝胶电泳检测
分别挑取酶切鉴定正确的pMD18-T-GFP-1、pMD18-T-GFP-2、pMD18-T-GFP-3单菌落,接种于5 mL含100 μg/mL氨苄青霉素的LB培养基中,37 ℃振荡培养过夜。取过夜培养物按1∶50扩大培养,当OD600≈0.6时加IPTG(异丙基-β-D-硫代半乳糖苷)至终浓度为1 mmol/L,继续诱导表达2 h后吸取1 mL菌液制样。
将菌液12 000 r/min离心1 min,去上清液。加入1 mL的PBS(磷酸缓冲盐溶液)重悬,离心后弃上清液,重复清洗两次。在沉淀中加入20 μL的凝胶加样缓冲液,充分混匀,沸水浴5 min,冷却后离心,取10 μL上清液点样,进行SDS-PAGE电泳(十二烷基硫酸钠-聚丙烯酰胺凝胶),之后对凝胶以考马斯亮蓝R-250染液染色过夜,第二天用脱色液洗脱直至背景干净,获得清晰的蛋白条带。
2.2.4 荧光观察
吸取少量菌液于洁净的载玻片上,盖上盖玻片,用荧光显微镜在40×物镜,488 nm 激发光下观察3种目的重组子的荧光表达情况。
2.3 结果与分析
2.3.1 PCR扩增GFP基因
以带有绿色荧光蛋白基因的质粒pEGFP-N1为模板,分别以1#-4#、2#-4#、3#-4#为引物对,用TaqDNA聚合酶进行目的基因扩增,经琼脂糖凝胶电泳,结果显示可以获得长度约为750 bp的GFP基因(图1),分别命名为GFP-1、GFP-2、GFP-3以与各自的引物一一对应。

1: DL2000 DNA Marker; 2: GFP-1; 3: GFP-2; 4: GFP-3。
2.3.2 pMD-19T-GFP重组质粒的鉴定
回收GFP基因并纯化,用T4 DNA连接酶分别将GFP-1、GFP-2、GFP-3片段和pMD18-T载体连接。连接产物转化大肠杆菌DH5α感受态细胞,经蓝白菌落筛选后挑取白色单菌落大量培养,提取质粒后首先通过电泳检测其分子质量大小。目的重组子连接有目的片段,其分子质量大小比对照的空载体大,泳动慢,如图2(a)所示。接着对从阳性克隆中提取的质粒用EcoR I和SalI进行双酶切鉴定,经琼脂糖凝胶电泳显示大约释放出750 bp和2 692 bp两条带,分别与GFP片段和pMD18-T空载体大小一致,如图2(b)所示。证明pMD18-T质粒中确实插入了GFP基因,重组正确的质粒分别依次命名为pMD18-T-GFP-1、pMD18-T-GFP-2、pMD18-T-GFP-3。

(a)重组质粒的分子质量大小鉴定;1:DL10000 DNA Marker;2:pMD18-T-GFP-3;3:pMD18-T-GFP-2;4:pMD18-T-GFP-1;5:pMD19-T。(b)重组质粒的双酶切鉴定;1:DL2000 DNA Marker;2:pMD18-T;3:pMD19-T-GFP-1;4:pMD18-T-GFP-2;5:pMD18-T-GFP-3。
2.3.3 pMD-19T-GFP重组质粒原核表达蛋白的SDS-PAGE检测
经酶切鉴定正确,分别含有pMD18-T-GFP-1、pMD18-T-GFP-2、pMD18-T-GFP-3质粒的DH5α菌株和pMD18-T空载体菌株一起进行原核诱导表达,结果如图3所示。与pMD18-T空载体相比,携带pMD18-T-GFP-3质粒的大肠杆菌中有大小约为27 ku的蛋白质表达(箭头所指处),与GFP蛋白的分子质量接近,推断该质粒中的GFP基因可以顺利表达出蛋白质,而pMD18-T-GFP-1和pMD18-T-GFP-2质粒中虽然插入了GFP基因,但蛋白质电泳图的相应部位并未显示有蛋白质条带,说明插入的GFP基因未能正确表达,由于发生移码突变,可能最终只能形成一段错误的多肽。
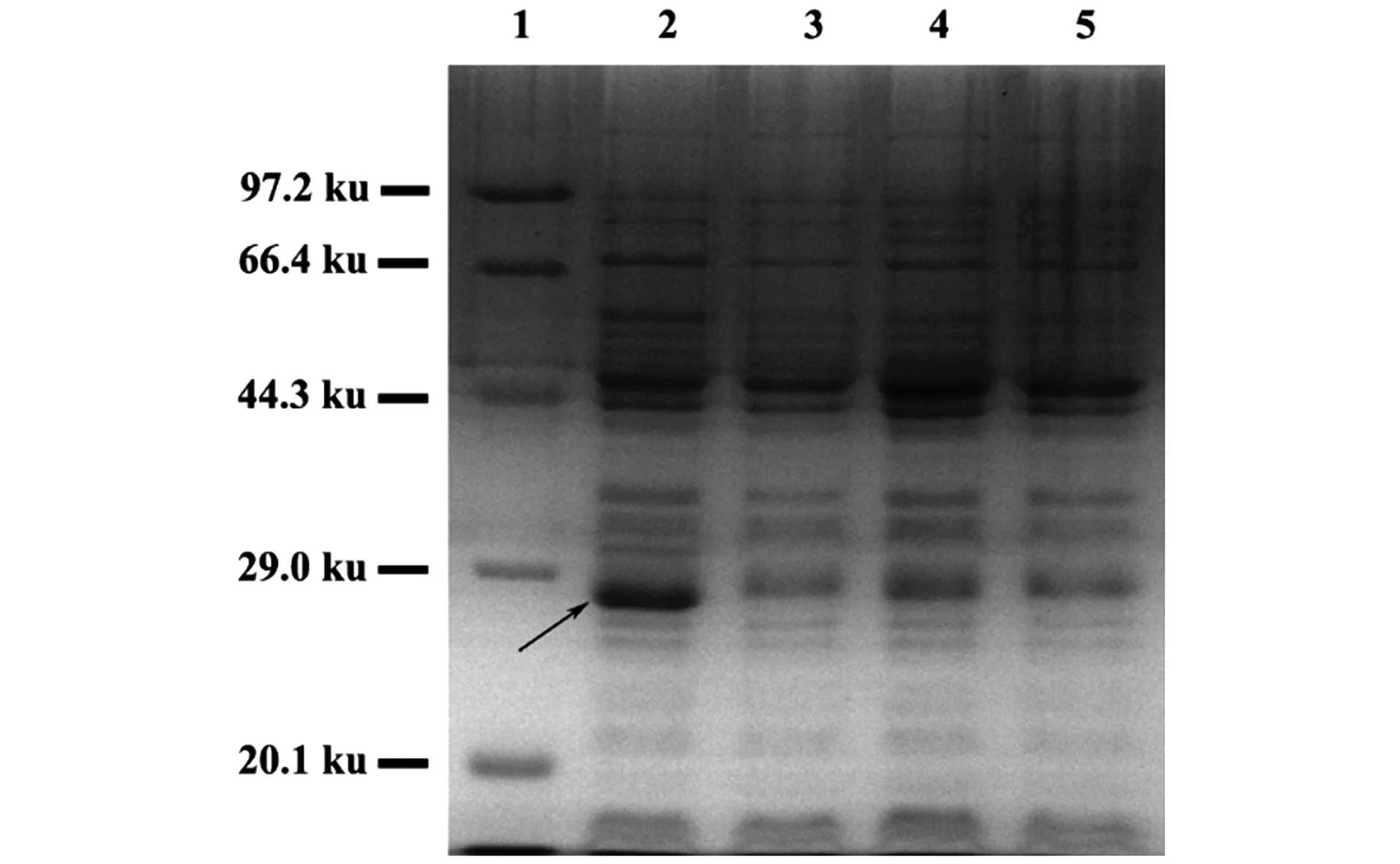
1:Premixed Protein Marker(Low);2:pMD18-T-GFP-3;3:pMD18-T-GFP-2;4:pMD18-T-GFP-1;5:pMD18-T;箭头:目的蛋白。
2.3.4 pMD-19T-GFP重组质粒原核表达蛋白的荧光显微镜检测
为了进一步证明表达的27 ku蛋白质是有功能活性的GFP,分别吸取上述4种菌体于洁净的载玻片上,并在488 nm激发光下进行荧光观察,结果如图4所示。在可见光下,图4(a)(c)(e)(g)显示4种菌体均可以呈现出清晰的杆状形态,但在488 nm激发光下,只有含pMD18-T-GFP-3质粒的菌体呈现出明亮的杆状绿色荧光[图4(h)],而图4(d)和(f)所示的其他两种重组子与图4(b)中的空载体一样,没有荧光产生,表明只有pMD18-T-GFP-3质粒中插入的GFP扩增产物恰好与β-半乳糖苷酶N 端α-肽的阅读框匹配,因此融合基因能够顺利表达,并且GFP蛋白质N端冗余的一小段α-肽片段并不影响GFP折叠形成正确的桶状结构,因而GFP蛋白仍然保持其正常的功能活性,显示出荧光。

(a)(c)(e)(g)明场;(b)(d)(f)(h)488 nm激发光下的荧光。(a)(b)pMD18-T;(c)(d)pMD18-T-GFP-1;(e)(f)pMD18-T-GFP-2;(g)(h)pMD18-T-GFP-3。
3 教学效果分析
3.1 强化理论和实践的融会贯通
基因克隆和蛋白表达是传统分子生物学实验中相对独立的两个实验内容,利用T克隆载体自带的乳糖操纵子,可以实现α-互补以进行蓝/白斑筛选,达到对PCR产物进行高效克隆的目的,但这个实验仅能证实有外源基因插入,无法鉴定插入的外源基因是否能顺利表达出蛋白质,学生对蛋白表达时应避免发生移码突变的要求认识不足。这样的两个独立实验也割裂了基因和蛋白质前后的关联性和整体性,不利于学生对理论知识的掌握和灵活运用分子生物学实验技术。通过尝试在同一个克隆载体上进行基因克隆和蛋白质表达一体化的综合性实验设计,使上一个实验的产物是下一个实验的原材料,环环相扣,让学生更好地掌握中心法则,同时也强化了学生理解蛋白质表达过程中阅读框匹配的重要性,将理论知识和实际应用结合起来。
3.2 拓展设计性和综合性实验教学内容
目前分子生物学实验课程的建设在于逐步增加综合性和自主设计性实验的比例。本实验中,除了常规让学生掌握引物设计的通用规则外,还将学生分组,根据三联体密码的特性,分别引导不同组学生针对GFP基因设计3对碱基序列分别相差1位的特异性上游引物,产生3组不同阅读框的引物对,借助T载体中的lac启动子能够诱导α-肽的合成。最终证实只有1对引物的阅读框和α-肽的阅读框匹配,GFP基因得以顺利表达;另外2对由于发生移码突变,最终只能形成一段错误的多肽。这样的实验设计使常规教学实验带有设计性和探究性的因素,学生由被动接受知识变为主动解决问题,提高了学习的主动性和积极性,这对快速提高学生的实验基本功,激发学生的专业兴趣和科研兴趣,培养独立思考、分析问题、解决问题的能力大有帮助,同时也为学生今后深造和就业打下基础。
3.3 培养严谨的科学思维和良好的科学素养
实验教学是高等教育中的重要实践教学环节,是人才培养的重要组成部分,在本科教学实践中引入科研领域中常用的思维方式,将教学与科研相结合,让学生在学习实验技能的同时深刻认识到科学实验的系统性和严谨性,促进实践教学质量的提高。在本实验的引物设计中,教师可以采用启发式教学法,引导学生进一步思考如下问题:到底应该在酶切位点上游还是下游引入1位碱基;选择载体时,可以让学生讨论如果直接选用线性化的T载体,利用DNA聚合酶在PCR产物的3′末端添加的“A”,与线性化载体两侧3′端添加的“T”,是否能够更加方便快捷地获得稳定的目的重组子,并提醒学生注意如果“A”或者“T”发生随机丢失会对结果造成怎样的影响。通过这些讨论,引导学生发现问题、提出问题并解决实际问题,激发学生的求知欲和创造力,使学生的思维方式和科研素养得到严谨性、科学性和系统性训练,这也是高等学校提高教育质量,培养创新型人才的必然要求[11-12]。
4 结语
本科分子生物学实验教学中,通过合理灵活的教学设计,使T载体兼具基因克隆和蛋白表达一体化的双重功能,在引导学生系统掌握基因工程基本实验原理和操作流程中,既整合了教学内容,避免两次克隆带来的重复性雷同实验内容,又使实验具有关联性和整体性,可以直观看到预期的结果,强化了学生对蛋白质表达过程中阅读框的匹配和防止出现移码突变的理解与掌握,将理论知识和实际应用结合起来,为优化分子生物学实验教学体系,提高生命科学本科实验教学质量做出了积极尝试,也进一步推动了实验教学的改革和创新。

