归芪白术方联合奥沙利铂对胃癌荷瘤小鼠机体免疫炎症分子的影响及抑癌作用①
牛世伟 苏韫③ 龚红霞 张晗 曾元丁 李菲菲
(甘肃中医药大学基础医学院,兰州 730000)
2020 年全球癌症统计数据显示,胃癌的发病率和病死率在全球分别居于第5位和第4位[1]。我国癌症中心2019年的数据显示,我国胃癌的发病率和病死率分别居于第2位和第3位[2]。近年来,运用中医药辅助治疗胃癌被广泛关注,中医药在缓解胃癌临床症状,减轻化疗毒副反应,提高患者免疫力及延长生存时间方面显示出较好的疗效,具有很大优势。本研究选用的归芪白术方出自《普济方》卷的“黄芪汤”加白术而成,课题组前期通过临床研究、细胞实验,从患者症状评分、炎症细胞因子表达水平、肠道菌群变化、胃癌细胞凋亡等方面证实了归芪白术方具有很好的辅助治疗效果[3-7]。在此基础上,本研究拟探讨归芪白术方联合奥沙利铂通过调节IL-6/JAK2/STAT3信号通路对胃癌荷瘤小鼠胃癌细胞的抑瘤作用及免疫炎症的影响,为其辅助治疗胃癌提供依据。
1 材料与方法
1.1 材料
1.1.1 实验细胞及动物MFC小鼠胃癌细胞,批号:PNS-MC-20,购自武汉普诺赛生命科技有限公司。SPF级昆明小鼠60只,雌雄各半,体质量(20±2)g,由甘肃中医药大学SPF级动物实验中心提供;动物合格证号:SCXK(甘)2020-0001。本研究经甘肃中医药大学伦理委员会批准,编号:2020-283。
1.1.2 药物归芪白术方由黄芪20 g、当归10 g、白术10 g、白芍10 g、酒大黄6 g、陈皮6 g、甘草6 g组成。以上药物均购自甘肃中医药大学附属医院。奥沙利铂购自山东罗欣药业集团股份有限公司。
1.1.3 主要试剂RPMI1640培养液(批号:AF29520450)购自美国Gibco公司;胎牛血清(批号:11012-8611)购自杭州四季青生物工程材料有限公司;IL-6 ELISA试剂盒(批号:MM-0163M1)购自江苏菲亚生物科技有限公司;苏木素-伊红(HE)试剂(批号:G1003)购自武汉赛维尔生物科技有限公司;反转录试剂盒(批号:H4104750)、实时荧光定量-PCR试剂盒(批号:H4104620)购自上海翊圣生物有限公司;IL-6抗体(批号:GTX110527)购自GenTex公司;p-JAK2(批号:YP0155)、p-STAT3(批号:YP0250)抗体购自Immunoway公司。
1.1.4 仪器无菌超净工作台购自苏州净化设备有限公司;CO2恒温培养箱购自日本SANYO公司;倒置相差显微镜购自日本Olympus公司;电子天平购自上海精密科学仪器有限公司;IMark酶标分析仪、电泳仪、凝胶成像仪、S1000TM逆转录仪、CFX96TM Optics Module PCR仪均购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养及胃癌荷瘤小鼠模型的建立小鼠MFC胃癌细胞用含10%胎牛血清的RPMI1640完全培养液常规培养于37℃、含5%CO2的孵育箱中。将MFC细胞培养至对数生长期并将密度调整为1×107个/ml,小鼠右侧腋下常规消毒后,接种单细胞悬液0.2 ml/只,制备胃癌荷瘤模型小鼠。接种5~7 d后可触及结节,结节直径长至大于5 mm时,提示造模成功。
1.2.2 动物分组及给药根据随机数字表法将造模成功的荷瘤小鼠随机分为模型组、奥沙利铂组、奥沙利铂加归芪白术方高、中、低剂量组(以下简称联合用药高、中、低剂量组),10只/组。根据小鼠和人体表面积比值0.002 6计算小鼠给药剂量,奥沙利铂为10 mg/(kg·2 d),归芪白术方高、中、低剂量分别为17.68、8.84、4.42 g/(kg·d)。小鼠的灌胃体积和腹腔注射体积为0.2 ml,给药周期为14 d。另选10只健康昆明小鼠作为空白组,空白组和模型组给予等体积生理盐水。
1.2.3 测定抑瘤率及脏器指数末次给药24 h后,小鼠眼球取血,分离血清,冻存备用。颈椎脱臼法处死小鼠后,摘除瘤组织、胸腺及脾脏,称重记录。抑瘤率(%)=(模型组平均瘤质量-药物组平均瘤质量)/模型组平均瘤质量×100%。脏器指数=脏器质量(mg)/小鼠体质量(g)。
1.2.4 检测小鼠血清中炎症因子取新鲜小鼠血清,严格按照ELISA试剂盒说明书检测小鼠血清中IL-6含量。
1.2.5 HE染色观察各组小鼠瘤组织病理将各组小鼠1/2的瘤组织固定于4%多聚甲醛中12~24 h,石蜡包埋,切成3~4 μm的切片。常规脱水后,进行HE染色,中性树胶封片后于光学显微镜下观察。
1.2.6 RT-qPCR定量检测各组小鼠肿瘤组织中IL-6、JAK2、STAT3 mRNA表达Trizol法提取肿瘤组织总RNA,按逆转录反应试剂盒操作说明将mRNA逆转录为cDNA,再以cDNA为模板采用荧光实时定量PCR技术检测基因表达水平。反应条件为:95℃5 min;95℃10 s,55℃20 s,72℃20 s,40个循环,绘制溶解曲线,根据各组Ct值,通过2-ΔΔCt法计算各组IL-6、JAK2、STAT3mRNA相对表达量。实验所用引物均由北京博迈德有限公司合成。IL-6 F:5′-
CATCCAGTTGCCTTCTTG-3',R:5′-TATCCAGTTT⁃GGTAGCATCC-3';JAK2 F:5′-ACAATGAAATGGAGGC-3',R:5′-ACAGGCGTAATACCACAAGC-3';STAT3 F:5′-TGTTGGAGCAGCATCTTC-3',R:5′-GGTCACAGACTGGTTGTTTC-3';GAPDH F:5′-GGTGTGAACGGATTTGG-3',R:5′-GACTCCACGACATACTCAGC-3′。
1.2.7 Western blot检测肿瘤组织中IL-6、p-JAK2和p-STAT3蛋白表达取适量肿瘤组织提取蛋白,BCA法检测蛋白浓度,煮沸变性,-20℃冰箱保存备用。配制SDS-PAGE胶,电泳,将蛋白转移至PVDF膜后于脱脂奶粉中封闭2 h,一抗稀释液4℃冰箱孵育过夜。TBST清洗后于常温摇床二抗孵育2 h,ECL显色曝光,使用Image J软件分析蛋白条带灰度值,与内参GAPDH进行比较,分析相对蛋白表达量。
1.2.8 免疫组化法检测瘤组织中c-Myc、Cyclin D1蛋白表达4%多聚甲醛固定瘤组织,常规石蜡包埋、切片,二甲苯透明,梯度乙醇脱水,柠檬酸抗原修复液修复抗原,PBS洗涤5 min×3次,切片放入3%双氧水溶液中室温避光孵育25 min,BSA室温封闭30 min,滴加一抗4℃湿盒内孵育过夜。第2天PBS洗涤5 min×3次,加相应二抗室温孵育50 min,DAB显色后苏木素复染脱水封片,显微镜观察,Image J软件进行图像分析。
1.3 统计学分析采用SPSS22.0软件分析数据,计量资料用±s表示,组间比较先采用方差齐性检验,方差齐采用单因素方差分析,两两比较采用Q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 药物对胃癌荷瘤小鼠的抑瘤作用与模型组相比,各给药组小鼠瘤体重量显著减轻(P<0.01);与奥沙利铂组相比,联合用药高、中剂量组瘤体重量显著减轻(P<0.01)。奥沙利铂组和联合用药高、中、低剂量组抑瘤率分别为46.23%、57.77%、52.29%、50.07%,见表1。
表1 归芪白术方对MFC胃癌小鼠瘤体重量、抑瘤率的影响(±s,n=10)Tab.1 Effect of Guiqibaizhu Recipe on tumor weight and tumor inhibition rate in MFC gastric cancer mice(±s,n=10)

表1 归芪白术方对MFC胃癌小鼠瘤体重量、抑瘤率的影响(±s,n=10)Tab.1 Effect of Guiqibaizhu Recipe on tumor weight and tumor inhibition rate in MFC gastric cancer mice(±s,n=10)
Note:Compared with model group,1)P<0.01;compared with oxaliplatin group,2)P<0.05,3)P<0.01.
Groups Model Oxaliplatin Combination high-dose Combination medium-dose Combination low-dose Dose/(g/kg)-10×10-3 10×10-3/17.68 10×10-3/8.84 10×10-3/4.42 Tumor weight/g 1.21±0.07 0.65±0.021)0.51±0.031)3)0.58±0.031)2)0.60±0.041)Tumor inhibition rate/%-46.23 57.77 52.29 50.07
2.2 药物对胃癌荷瘤小鼠脏器指数的影响与空白组相比,模型组小鼠的脾指数、胸腺指数降低(P<0.01);与模型组相比,奥沙利铂组小鼠的脾指数、胸腺指数降低(P<0.01);与奥沙利铂组相比,联合用药高剂量组脾指数升高,联合用药高、中剂量组胸腺指数升高(P<0.05,P<0.01),见表2。
表2 归芪白术方对MFC胃癌小鼠脏器指数的影响(±s,n=10)Tab.2 Effect of Guiqibaizhu Recipe on organ index of MFC gastric cancer mice(±s,n=10)
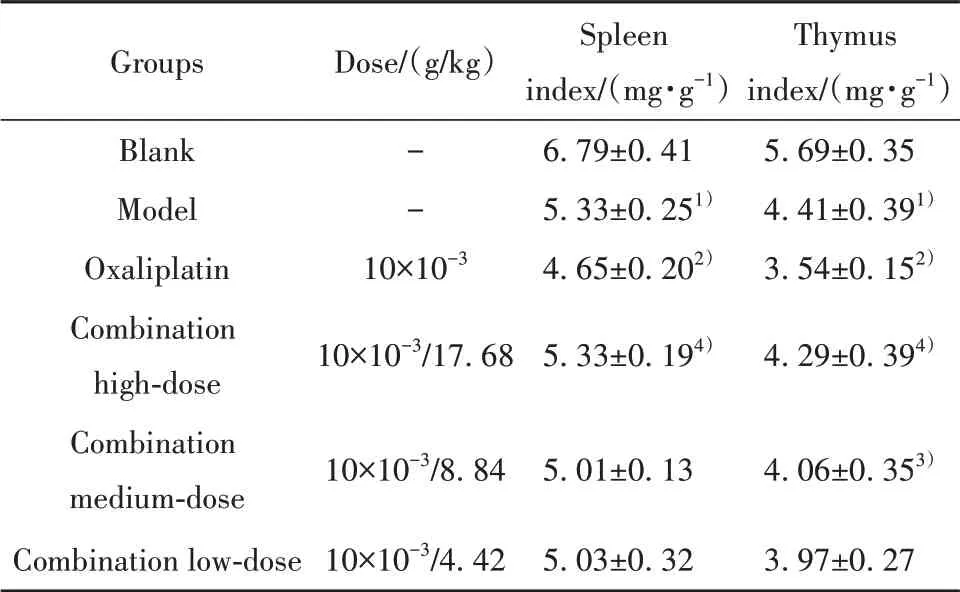
表2 归芪白术方对MFC胃癌小鼠脏器指数的影响(±s,n=10)Tab.2 Effect of Guiqibaizhu Recipe on organ index of MFC gastric cancer mice(±s,n=10)
Note:Compared with blank group,1)P<0.01;compared with model group,2)P<0.01;compared with oxaliplatin group,3)P<0.05,4)P<0.01.
Groups Blank Model Oxaliplatin Combination high-dose Combination medium-dose Combination low-dose Dose/(g/kg)--10×10-3 10×10-3/17.68 10×10-3/8.84 10×10-3/4.42 Spleen index/(mg·g-1)6.79±0.41 5.33±0.251)4.65±0.202)5.33±0.194)5.01±0.13 5.03±0.32 Thymus index/(mg·g-1)5.69±0.35 4.41±0.391)3.54±0.152)4.29±0.394)4.06±0.353)3.97±0.27
2.3 药物对胃癌荷瘤小鼠血清中IL-6的影响与空白组相比,模型组小鼠血清中IL-6含量升高(P<0.01);与模型组相比,各给药组小鼠血清中的IL-6含量降低(P<0.01);与奥沙利铂组相比,联合用药高、中剂量小鼠血清中的IL-6含量均降低(P<0.05,P<0.01),见表3。
表3 各组小鼠血清中IL-6含量(±s,n=10)Tab.3 Content of IL-6 in serum of mice in each group(±s,n=10)

表3 各组小鼠血清中IL-6含量(±s,n=10)Tab.3 Content of IL-6 in serum of mice in each group(±s,n=10)
Note:Compared with blank group,1)P<0.01;compared with model group,2)P<0.01;compared with oxaliplatin group,3)P<0.05,4)P<0.01.
Groups Blank Model Oxaliplatin Combination high-dose Combination medium-dose Combination low-dose Dose/(g/kg)--10×10-3 10×10-3/17.68 10×10-3/8.84 10×10-3/4.42 IL-6/(ng·ml-1)62.33±7.60 119.69±5.621)98.79±5.012)78.57±4.962)4)81.45±4.082)3)85.85±4.722)
2.4 药物对胃癌荷瘤小鼠肿瘤组织病理学影响HE结果显示,模型组小鼠瘤组织肿瘤细胞密集,排列均一,未见明显肿瘤坏死灶。奥沙利铂组及联合用药高、中、低剂量组肿瘤细胞密度降低,分布不均,细胞核固缩、深染,肿瘤细胞数量减少,呈现不同程度的肿瘤坏死灶,上述坏死现象以联合用药高剂量组最为显著,见图1。

图1 各组小鼠肿瘤组织病理形态(HE染色,×100)Fig.1 Pathological morphology of tumor tissues in each group of mice(HE staining,×100)
2.5 药物对胃癌荷瘤小鼠肿瘤组织中IL-6、JAK2、STAT3基因表达的影响与模型组相比,各给药组小鼠的IL-6、JAK2、STAT3mRNA表达均降低(P<0.01);与奥沙利铂组相比,联合用药高、中剂量组IL-6、STAT3mRNA表达均降低(P<0.05,P<0.01),联合用药高剂量组JAK2mRNA表达降低(P<0.05),见表4。
表4 各组MFC胃癌小鼠瘤组织IL-6、JAK2、STAT3基因表达(±s,n=10)Tab.4 Expressions of IL-6,JAK2 and STAT3 genes in tumor tissues of MFC gastric cancer mice in each group(±s,n=10)

表4 各组MFC胃癌小鼠瘤组织IL-6、JAK2、STAT3基因表达(±s,n=10)Tab.4 Expressions of IL-6,JAK2 and STAT3 genes in tumor tissues of MFC gastric cancer mice in each group(±s,n=10)
Note:Compared with model group,1)P<0.01;compared with oxaliplatin group,2)P<0.05,3)P<0.01.
Groups Model Oxaliplatin Combination high-dose Combination medium-dose Combination low-dose IL-6 1.00±0.00 0.72±0.051)0.54±0.051)3)0.63±0.021)2)0.64±0.031)JAK2 1.00±0.00 0.68±0.011)0.58±0.041)2)0.61±0.061)0.67±0.041)STAT3 1.00±0.00 0.63±0.061)0.46±0.021)3)0.53±0.031)2)0.58±0.031)
2.6 药物对胃癌荷瘤小鼠瘤组织中IL-6、p-JAK2、p-STAT3蛋白表达的影响与模型组相比,各给药组小鼠的IL-6、p-JAK2、p-STAT3蛋白表达均降低(P<0.01);与奥沙利铂组相比,联合用药高、中剂量组IL-6、p-JAK2、p-STAT3蛋白表达均降低(P<0.05,P<0.01),见图2、表5。
表5 各组MFC胃癌小鼠瘤组织IL-6、p-JAK2、p-STAT3蛋白表达(±s,n=10)Tab.5 Expressions of IL-6,p-JAK2 and p-STAT3 pro⁃tein in tumor tissues of MFC gastric cancer mice in each group(±s,n=10)
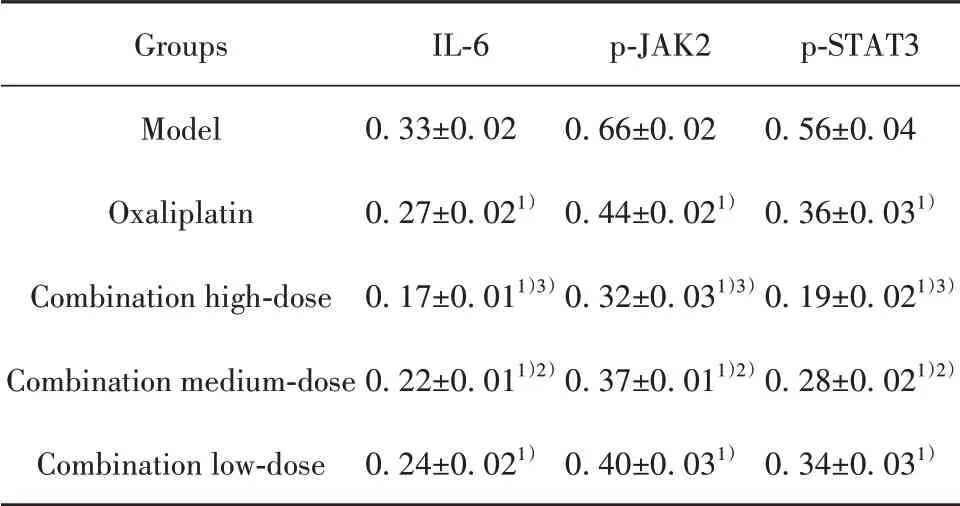
表5 各组MFC胃癌小鼠瘤组织IL-6、p-JAK2、p-STAT3蛋白表达(±s,n=10)Tab.5 Expressions of IL-6,p-JAK2 and p-STAT3 pro⁃tein in tumor tissues of MFC gastric cancer mice in each group(±s,n=10)
Note:Compared with model group,1)P<0.01;compared with oxaliplat⁃in group,2)P<0.05,3)P<0.01.
Groups Model Oxaliplatin Combination high-dose Combination medium-dose Combination low-dose IL-6 0.33±0.02 0.27±0.021)0.17±0.011)3)0.22±0.011)2)0.24±0.021)p-JAK2 0.66±0.02 0.44±0.021)0.32±0.031)3)0.37±0.011)2)0.40±0.031)p-STAT3 0.56±0.04 0.36±0.031)0.19±0.021)3)0.28±0.021)2)0.34±0.031)
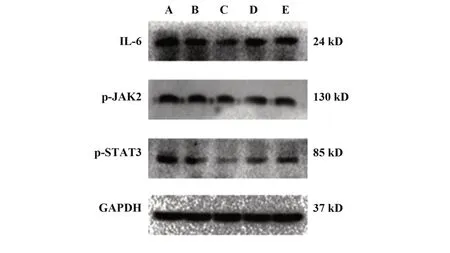
图2 各组MFC胃癌荷瘤小鼠肿瘤组织中蛋白表达水平Fig.2 Protein expression levels in tumor tissues of MFC gastric cancer tumor-bearing mice in each group
2.7 药物对胃癌荷瘤小鼠瘤组织中c-Myc、Cyclin D1蛋白表达的影响c-Myc的阳性表达主要位于细胞核,Cyclin D1的阳性表达主要位于细胞质,少量表达于细胞核,主要表现为棕黄色或棕褐色颗粒。与模型组相比,各给药组小鼠的c-Myc、Cyclin D1蛋白表达均降低(P<0.01);与奥沙利铂组相比,联合用药高、中剂量组c-Myc、Cyclin D1蛋白表达均降低,联合用药低剂量组Cyclin D1蛋白表达降低(P<0.05,P<0.01),见图3、表6。
表6 归芪白术方对MFC胃癌小鼠瘤组织中c-Myc、Cyclin D1蛋白表达的影响(±s,n=10)Tab.6 Effect of Guiqibaizhu Recipe on expressions of c-Myc and Cyclin D1 protein in tumor tissues of MFC gastric cancer mice(±s,n=10)
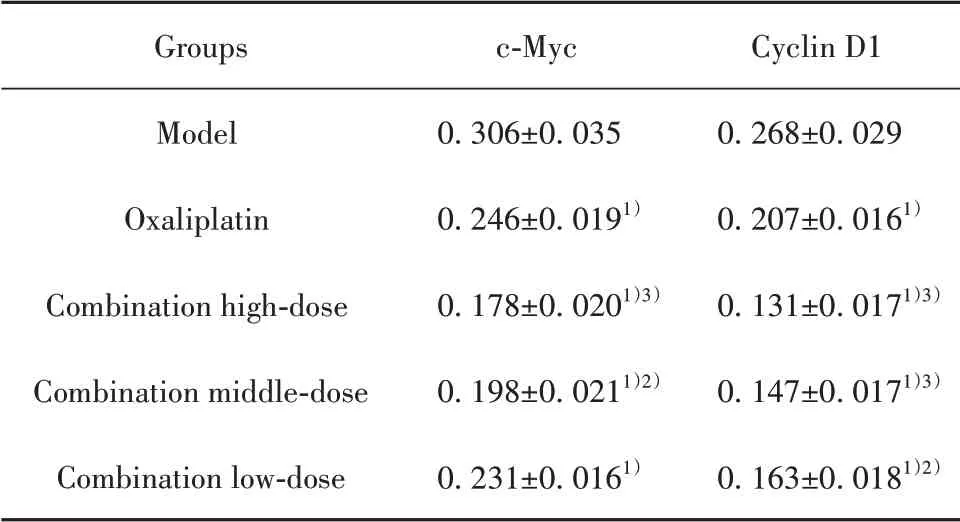
表6 归芪白术方对MFC胃癌小鼠瘤组织中c-Myc、Cyclin D1蛋白表达的影响(±s,n=10)Tab.6 Effect of Guiqibaizhu Recipe on expressions of c-Myc and Cyclin D1 protein in tumor tissues of MFC gastric cancer mice(±s,n=10)
Note:Compared with model group,1)P<0.01;compared with oxaliplatin group,2)P<0.05,3)P<0.01.
Groups Model Oxaliplatin Combination high-dose Combination middle-dose Combination low-dose c-Myc 0.306±0.035 0.246±0.0191)0.178±0.0201)3)0.198±0.0211)2)0.231±0.0161)Cyclin D1 0.268±0.029 0.207±0.0161)0.131±0.0171)3)0.147±0.0171)3)0.163±0.0181)2)
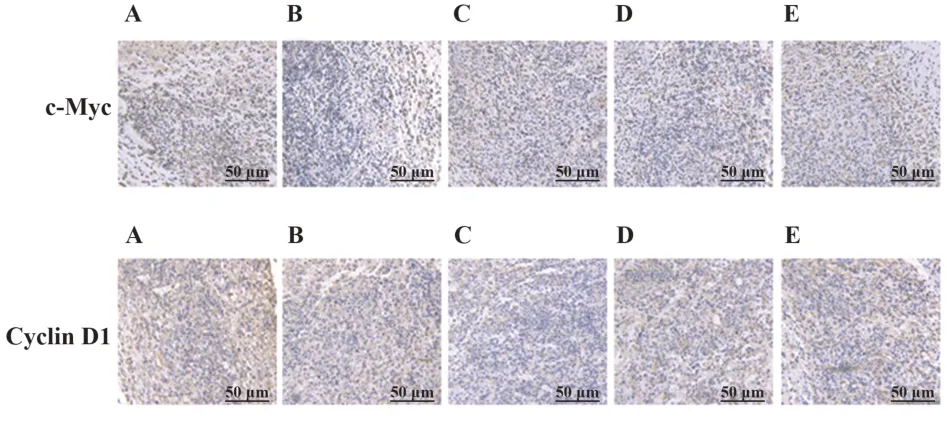
图3 免疫组化染色观察各组小鼠瘤组织中c-Myc、Cyclin D1蛋白表达(×200)Fig.3 Immunohistochemical staining to observe expres⁃sions of c-Myc and Cyclin D1 protein in tumor tissues of each group of mice(×200)
3 讨论
胃癌属于中医学中“胃脘痛”“噎膈”“反胃”“伏梁”等范畴[8]。胃癌的病因病机为本虚标实,本虚以脾胃虚弱为主,标实则以血瘀、痰凝、气滞等为主[9]。目前运用中医药辅助治疗胃癌被广泛关注,中药能改善各种类型胃癌的临床症状,减轻患者化疗后的不良反应,增强免疫,提高治疗率,延长生存时间[10-11]。
归芪白术方由明•朱橚等《普济方》卷二七二之“黄芪汤”加味白术变化而来,全方由黄芪、白术、当归、大黄(酒)、芍药(白芍)、陈皮、甘草(炒)组成。该方具有攻补兼施、扶正祛邪、健脾化瘀的功效。课题组前期从细胞实验及临床研究证实了归芪白术方对于抑制胃癌细胞的增殖及临床辅助治疗胃癌具有一定作用[3-7]。
IL-6/JAK2/STAT3信号通路在胃肠道肿瘤发生的过程中高度特异性激活,从促炎、促增殖、免疫调节等多个方面促进肿瘤发生发展[12]。有学者表明IL-6在恶性肿瘤中可引起细胞因子风暴,免疫效应细胞被过度激活,细胞因子大量释放,加重癌症进展[13]。IL-6与IL-6R结合后可活化JAK蛋白酪氨酸激酶,作为上游激酶活化后募集胞浆中的STAT3单体,使无活性的STAT3分子酪氨酸磷酸化而形成有活性的二聚体,转移入细胞核,结合DNA,导致特定靶基因的开启,如参与下游基因c-Myc和Cyclin D1等的转录及表达,进而通过影响细胞的增殖、分化、炎症免疫等促进肿瘤的发生和发展(图4)[14-15]。半夏泻心汤可通过影响IL-6/JAK2/STAT3信号通路相关蛋白表达,进而抑制胃癌细胞增殖[16]。张刚等[17]通过细胞实验表明,延龄草总皂苷可通过抑制IL-6/STAT3信号通路下调胃癌细胞的侵袭和迁移能力。以上研究表明,IL-6/JAK2/STAT3信号通路与胃癌的发生发展关系密切。
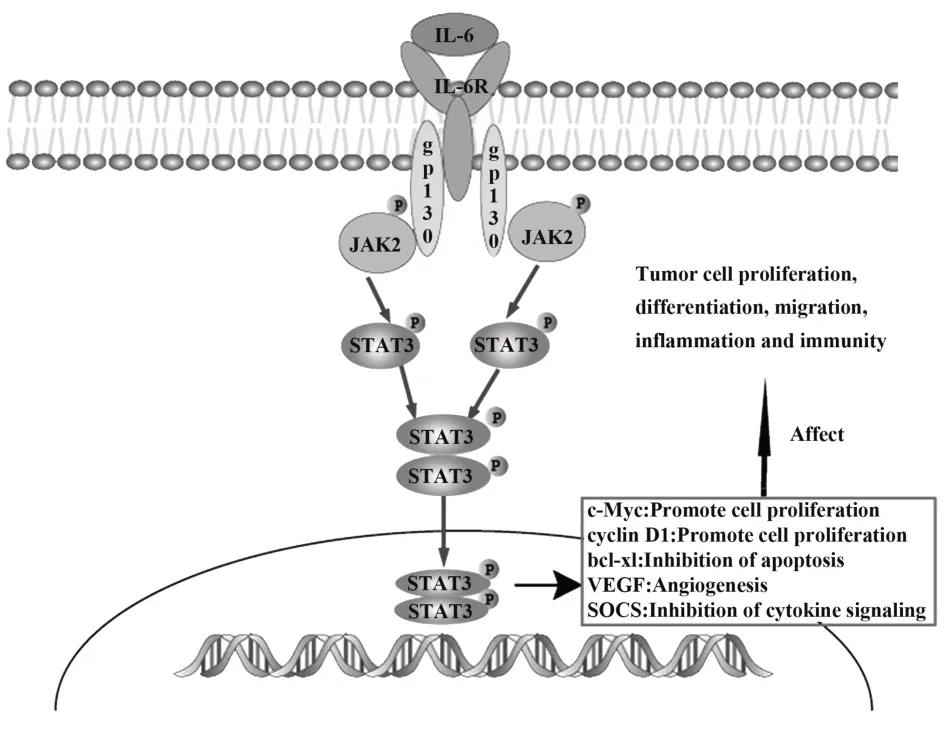
图4 IL-6/JAK2/STAT3活化途径信号通路图Fig.4 IL-6/JAK2/STAT3 activation pathway signal path⁃way diagram
本实验建立胃癌荷瘤小鼠模型,通过奥沙利铂及中药归芪白术方联合干预验证小鼠机体免疫炎症分子的影响及抑癌作用,结果表明与模型组相比,各给药组小鼠瘤体重量显著减轻,且病理坏死程度显著加重;与奥沙利铂组相比,奥沙利铂联合归芪白术方可提高抑瘤率,提高小鼠的脾指数和胸腺指数,降低小鼠血清中炎症因子IL-6的表达,降低瘤组织中的IL-6、JAK2、STAT3mRNA水平和IL-6、p-JAK2、p-STAT3、c-Myc、Cyclin D1蛋白水平,说明联合用药可抑制免疫炎症反应,降低炎症因子含量,调节IL-6/JAK2/STAT3信号通路相关蛋白表达,从而抑制胃癌细胞增殖,提示归芪白术方可能通过调控IL-6/JAK2/STAT3信号通路辅助奥沙利铂发挥抑瘤作用。