应用整合药理学方法探讨甘姜苓术汤治疗类风湿关节炎的机制①
陈少波 位佳琳 何蕊邢春来 初洪波 位鸿
(长春中医药大学药学院,长春130117)
类风湿关节炎(rheumatoid arthritis,RA)是一种全身性疾病,主要表现为慢性对称性关节炎[1-2]。一般认为RA是感染引发的自身免疫反应,临床研究表明RA发生与环境、家族遗传、感染以及性激素失调有关,特征为关节滑膜组织、软骨和骨骼炎症变化,导致以滑膜炎为基础的关节病变,晚期可引起关节强直、畸形和功能严重受损,最终导致残疾和死亡[3-5]。RA可发生于任何年龄,60岁以上患者明显多于30岁以下者,女性发病率普遍高于男性,严重影响患者健康和生活质量[6]。临床上RA治疗方式主要为糖皮质激素、非甾体类抗炎药等,虽缓解疼痛效果明显,但副作用较大,故采用传统中药进行多靶点治疗是更好的选择[7-9]。
甘姜苓术汤(Ganjianglingzhu Decoction,GJLZ)即肾着汤,出自汉代张仲景所著《金匮要略》,由甘草、白术、干姜、茯苓四味药材组成[10]。近年研究表明,GJLZ应用广泛,除可治疗肾着病(寒湿附着肾经而见腰部寒冷沉重的病证),在RA、寒湿腰痛、膝骨关节痛等临床治疗方面也有较好疗效[11]。
网络药理学基于系统生物学对疾病发展过程进行阐释,再采用一系列网络观念认识药物与机体的相互作用,可通过寻找药物和疾病间有意义的共同靶点系统揭示中药产品在分子水平上的治疗机制,对RA防治具有现实指导意义,为临床应用提供实验基础[12]。
本研究采用液质联用技术与网络药理学分析及体外实验结合的模式,更全面地研究药物作用机制[13]。应用超高液相色谱-串联四级杆飞行时间质谱仪联用技术(UPLC-Q-TOF/MS)指认出复方中关键成分,再采用网络药理学对GJLZ的成分靶点和疾病靶点、生物学过程及途径进行预测,采用CCK-8和ELISA实验验证小鼠单核巨噬细胞白血病细胞(RAW264.7)的炎症反应,初步阐明GJLZ作用于RA的机制,为RA治疗提出新的见解,为临床深入研究RA提供新思路[14]。
1 材料与方法
1.1 材料干姜、茯苓、白术、甘草经长春中医药大学肖井雷教授鉴定均符合规定;对照品甘草苷(批号:111610-201607)、甘草酸(批号:111847-201505)、β-谷甾醇(批号:110851-201608)、常春藤皂苷元(批号:111733-201205)、麦角甾醇(批号:111845-201604)、月桂酸(批号:111774-201602)、白术内酯Ⅱ(批号:111976-201501)、棕榈酸(批号:111733-201607)均购于中国食品药品检定研究院,质量分数均>95%;乙腈(色谱纯,4 L,美国Thermo Fisher Scientific公司);小鼠单核巨噬细胞白血病细胞(RAW264.7)来源于中国科学院上海细胞生物研究所细胞库;胎牛血清(美国Clark);青霉素-链霉素双抗(100 ml,定州百克赛斯生物科技有限公司);DMEM培养基(500 ml,美国Gibco);CCK-8溶液(500 T,大连美仑生物技术有限公司);脂多糖(LPS,上海懋康生物科技有限公司);VEGF、IL-17 ELISA检测试剂盒(鼠源,48 T,中国黄石科研)。
1.2 方法
1.2.1 药材提取和溶液制备按处方量取甘草28.0 g、干姜56.0 g、茯苓56.0 g、白术28.0 g(共168.0 g),加1 000 ml水浸泡30 min,武火煎煮至沸腾,转文火煎煮至600 ml,冷冻干燥,粉碎,得到提取物粉末。对照品溶液制备:分别称取各对照品约2.0 mg置于10 ml量瓶,加甲醇定容至刻度,摇匀,得到单一对照品溶液(0.2 mg/ml)。分别精密吸取各对照品溶液适量,混合,得到混合对照品溶液(2 μg/ml)。供试品溶液制备:称取粉末约0.1 g,精密称定,置于10 ml量瓶,加70%乙醇8 ml,超声处理40 min(250 W,40 kHz),放冷,70%乙醇水溶液稀释至刻度定容,摇匀,离心,0.45 μm滤膜过滤[15]。
1.2.2 UPLC-Q-TOF/MS筛选有效成分采用UPLC-Q-TOF/MS进行有效成分筛选,色谱柱:OOD-4475-AN C18(2.1 mm×100 mm,1.7 μm);波长:237 nm;流速:0.3 ml/min;柱温:30℃;进样量:8 μl;流动相:0.1%甲酸水(A)-乙腈(B);梯度洗脱见表1。采用电喷雾离子源(ESI),负离子检测模式,喷雾电压3.8 kV,气体温度350℃,雾化器40psig,干燥气体(氮气)流速为10.0 L/min,碎片器175 V,撇油器电压65 V,全扫描范围m/z50~1 000。根据对照品鉴定精确相对分子量及保留时间确定化学成分。
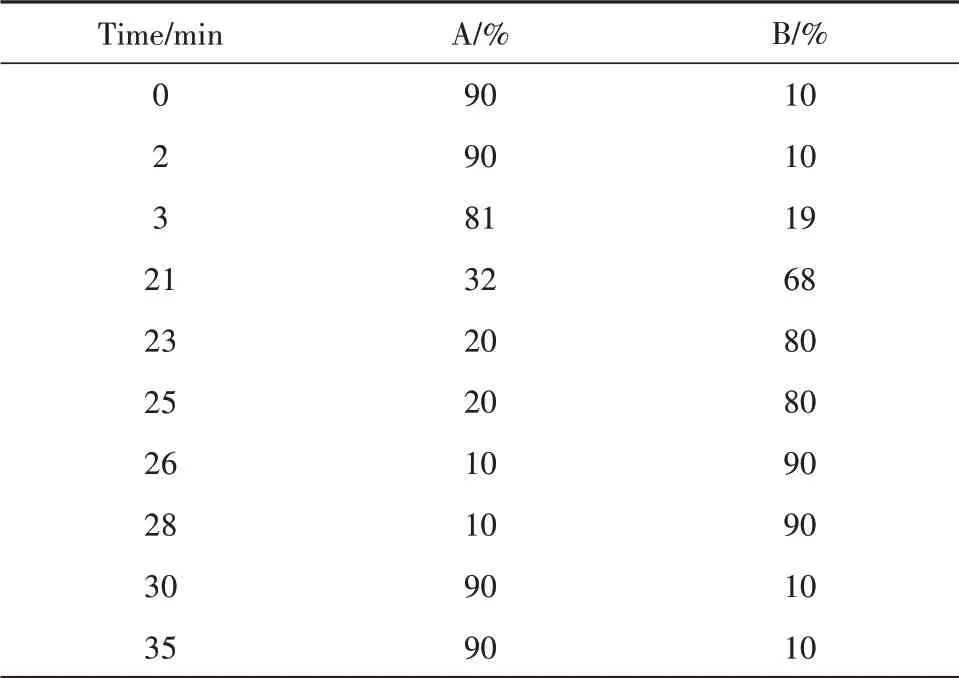
表1 梯度洗脱Tab.1 Gradient elution
1.2.3 药物靶点和疾病靶点收集取1.2.2中获取的成分输入中药系统药理学数据库分析平台(TCMSP,http://tcmspw.com/tcmsp.php)、中医药整合药理学研究平台(http://www.tcmip.cn/TCMIP/index.php/Home/Login/login.html)和SwissTargetPrediction平台(http://swisstargetprediction.ch/)中,以口服生物利用度(OB)≥30%、药物相似度(DL)≥0.18为条件,物种设置为“Homo sapiens”,收集成分靶点,筛重,获得药物靶点。以“Rheumatoid arthritis”为关键词,在Drugbank数据库(https://www.drugbank.ca/)中进行检索,获得靶点,筛重,通过Uniprot数据库将靶点蛋白名称转化成基因名称,获得疾病靶点。
1.2.4 疾病-成分-靶点网络构建将疾病、药物成分、靶点导入Cytoscape3.8.0软件,以三者为节点,选用Merge功能,相互关系分别用边相连,构建“疾病-药物成分-靶点”网络。为进一步研究GJLZ治疗RA的靶点,将RA和GJLZ蛋白靶点上传至venny(https://bioinfogp.cnb.csic.es/tools/venny/index.html)软件,绘制药物靶点和疾病靶点韦恩图(veen),得到成分和疾病的交集靶点,采用Cytoscape3.8.0软件构建“疾病-药物成分-交集靶点”网络图。
1.2.5 交集靶点的GO生物功能分析和KEGG通路富集分析将1.2.3获得的交集靶点输入至String Versio软件绘制PPI网络图,采用Cytoscape3.8.0软件对其进行可视化分析。将得到的共同靶标导入R语言软件,基于GO和KEGG分析,结合富集计算(GO:Count≥2,P≤0.05;KEGG:P≤0.01)确定交集靶点参与的生物学过程和通路,根据P值进行降序排列,选择前20位生物学功能和通路,采用Cyto⁃scape3.8.0软件绘制“疾病-药物成分-靶点-信号通路”网络图,阐明核心靶点在信号通路中的作用,得到GJLZ抗RA的主要作用通路及初步机制。
1.2.6 分子对接验证选取生物利用度较高的3个成分与3个核心靶点进行对接,将Gingerenone-A、Glycyrol、Gingerenone-B输 入PubChem[PubChem(nih.gov)]平台,下载化合物2D结构,通过Autodock vina 1.1.2软件将其转化为PDBQT格式配体。从Protein DataBank(RCSB PDB:Homepage)网站获取小分子受体,采用Pymol软件去除水和有机配体,采用Autodock vina 1.1.2软件对受体蛋白和小分子进行对接。结合能<0时表明配体和受体亲和力较强,选择亲和力最好的作为对接构象,Pymol分析作图。
1.2.7 细胞培养及药物毒性检测RAW264.7细胞采用含10%胎牛血清的DMEM培养基培养,37℃、5%CO2。将对数生长期的RAW264.7细胞悬液接种于96孔板(8×104个/ml),100 μl/孔,设置对照组(细胞+培养基)、GJLZ组(100、50、25、12.5、6.25、3.125 μg/ml),各组设6个复孔,加药培养24 h,加入10 μl CCK-8溶液,在CO2培养箱中培养2h,酶标仪检测450 nm处各孔吸光度(A)值。
1.2.8 ELISA检测细胞因子IL-17、VEGF含量将RAW264.7细胞悬液接种于6孔板(1×105个/ml),2 ml/孔,贴壁后设置对照组(NOR)、LPS模型组(MOL)、LPS+GJLZ低、中、高剂量组,培养24 h后取培养基,离心(2 500 r/min),取上清,采用ELISA试剂盒检测IL-17、VEGF含量。
2 结果
2.1 GJLZ化学成分鉴定与确认将液质联用分析结果与化学数据库进行比对[16],共得到15种化学成分(东莨菪醇、月桂酸、甘草苷、白术内酯Ⅱ、棕榈酸、姜烯酮-C、甘草酸、常春藤皂苷元、β-谷甾醇、甘草素B、麦角甾醇、姜烯酮-A、甘草酚、姜烯酮-B、12-姜辣素),将15种成分的出峰时间、化学名称、分子式、分子量及加合物进行汇总,结果见附图1、附表1(www.immune99.com)。
2.2 药物靶点和疾病靶点收集通过Swiss Target Prediction和TCMSP数据库得到15种化学成分靶点,筛选后(OB>30,DL>0.18)得到177个成分靶点。从GeneCards数据库获取RA疾病靶点,筛选后(置信度得分>5.0分)得到2 048个疾病靶点,置信度得分>5.0分表明该靶点与RA密切相关(图1A)。
2.3 疾病-成分-靶点网络及PPI构建将筛选出的15种成分、疾病、相关靶点构建“成分-疾病-靶点”网络图(图1C)。为进一步研究RA,采用R软件制作成分靶点和疾病靶点veen图,得到GJLZ和RA交集靶点19个(图1A)。采用Cytoscape3.8.0软件绘制“疾病-成分-交集靶点”网络图并进行可视化分析(图1C)。通过网络图可观察到15个成分中甘草素B连接12个交集靶点,甘草酚连接8个交集靶点,姜烯酮-A、姜烯酮-B、姜烯酮-C分别连接5个交集靶点,12-姜辣素连接2个交集靶点,其余成分连接1个或1个以上靶点。PPI显示34个节点,144条边,置信度得分最高的(置信度得分>0.9分)节点包括AKT1、HSP90AA1、NOS3、KDR、MAPK14,均高度参与细胞炎症、细胞周期及增殖过程(图1B)。
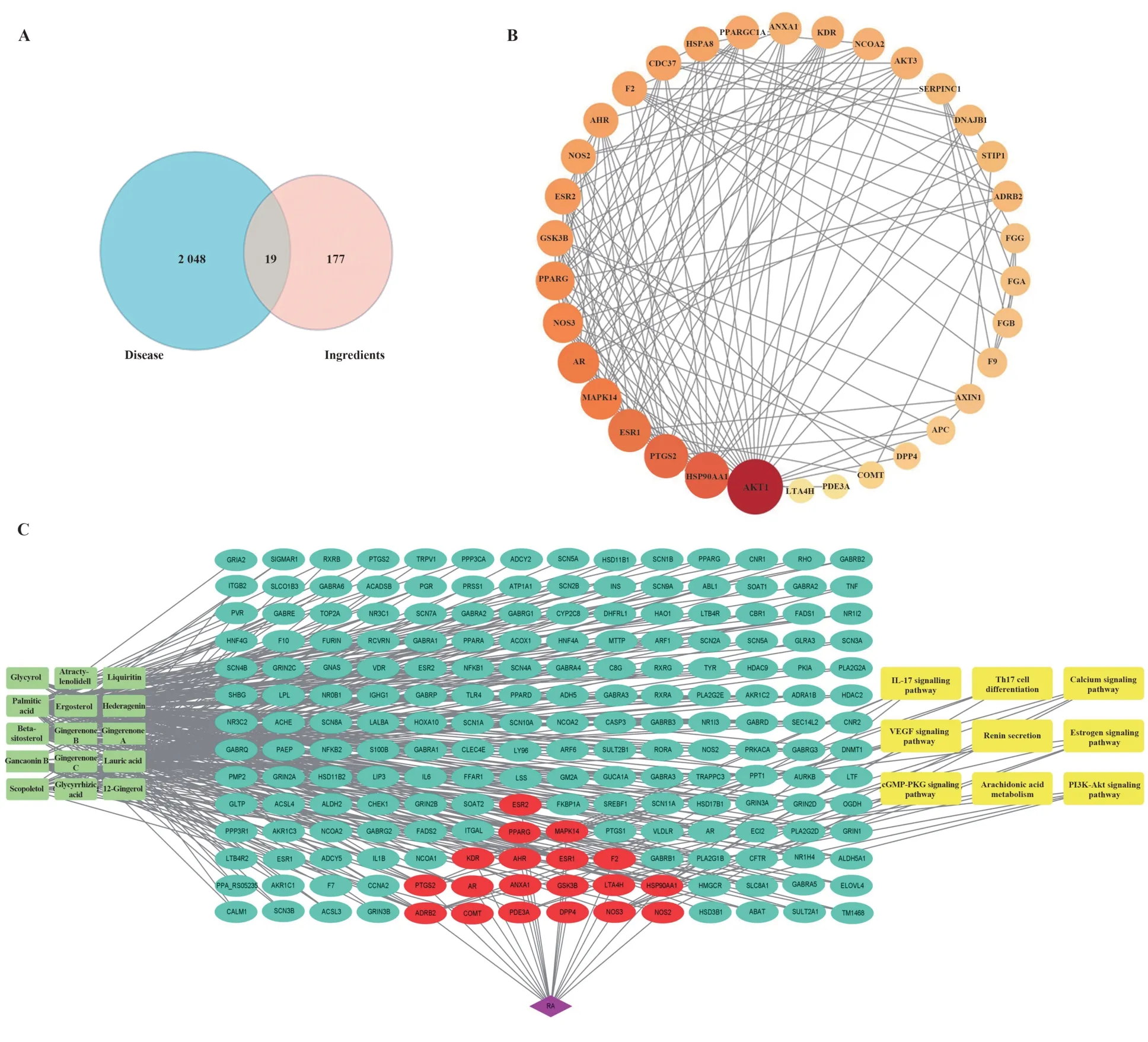
图1 GJLZ调控RA的靶基因分析Fig.1 Analysis of GJLZ target genes regulating RA
2.4 GO分析和KEGG分析GO功能分析根据P<0.05筛选出前20条结果,绘制条形图进行对比(图2A),交集靶标主要与炎症、增殖、肿瘤及生长周期相关,交集靶点主要参与核受体活性、配体激活的转录因子活性、类固醇激素受体活性、RNA聚合酶Ⅱ一般转录起始因子结合、一般转录起始因子结合等生物学功能。与交集靶基因连接密切的有核受体活性及配体激活的转录因子活性,分别连接5个靶点,类固醇激素受体活性与4个靶点相连,其余生物功能分别与3个或3个以上靶点基因相连,同一个靶点蛋白也同时参与多个生物学功能。
KEGG通路分析根据P<0.05筛选出前20条有显著意义的通路,绘制KEGG条形图(图2B),主要包括化学致癌作用-受体激活、血管内皮生长因子信号通路、催乳素信号通路、IL-17信号通路、辅助性T细胞17细胞分化、cGMP-PKG信号通路、PI3K-Akt信号通路等,以上通路主要与细胞炎症、增殖、生长周期有关。NOS3参与5条通路,HSP90AA1参与4条通路,KDR和MAPK14分别参与3条通路,其余靶点参与1条或1条以上通路(图2B)。
2.5 分子对接网络药理学分析GJLZ治疗RA的相关基因,NOS3、HSP90AA1和KDR连接通路最多,是最重要的蛋白靶点,对“药物成分、疾病、交集靶点”绘制的网络图进行拓扑分析,姜烯酮A、姜烯酮B、甘草酚排名较高,且姜烯酮A与HSP90AA1、姜烯酮B与NOS3、甘草酚与KDR相关,故分别以这3种成分为配体,蛋白靶点为受体进行刚性对接,姜烯酮B和NOS3的对接能量为-7.8 kJ/mol,甘草酚和KDR的对接能量为-7.5 kJ/mol,姜烯酮A和HSP90AA1的对接能量为-3.6 kJ/mol,结合能均为负值,表明结合活性好(附表2、附图2,www.immune99.com)。
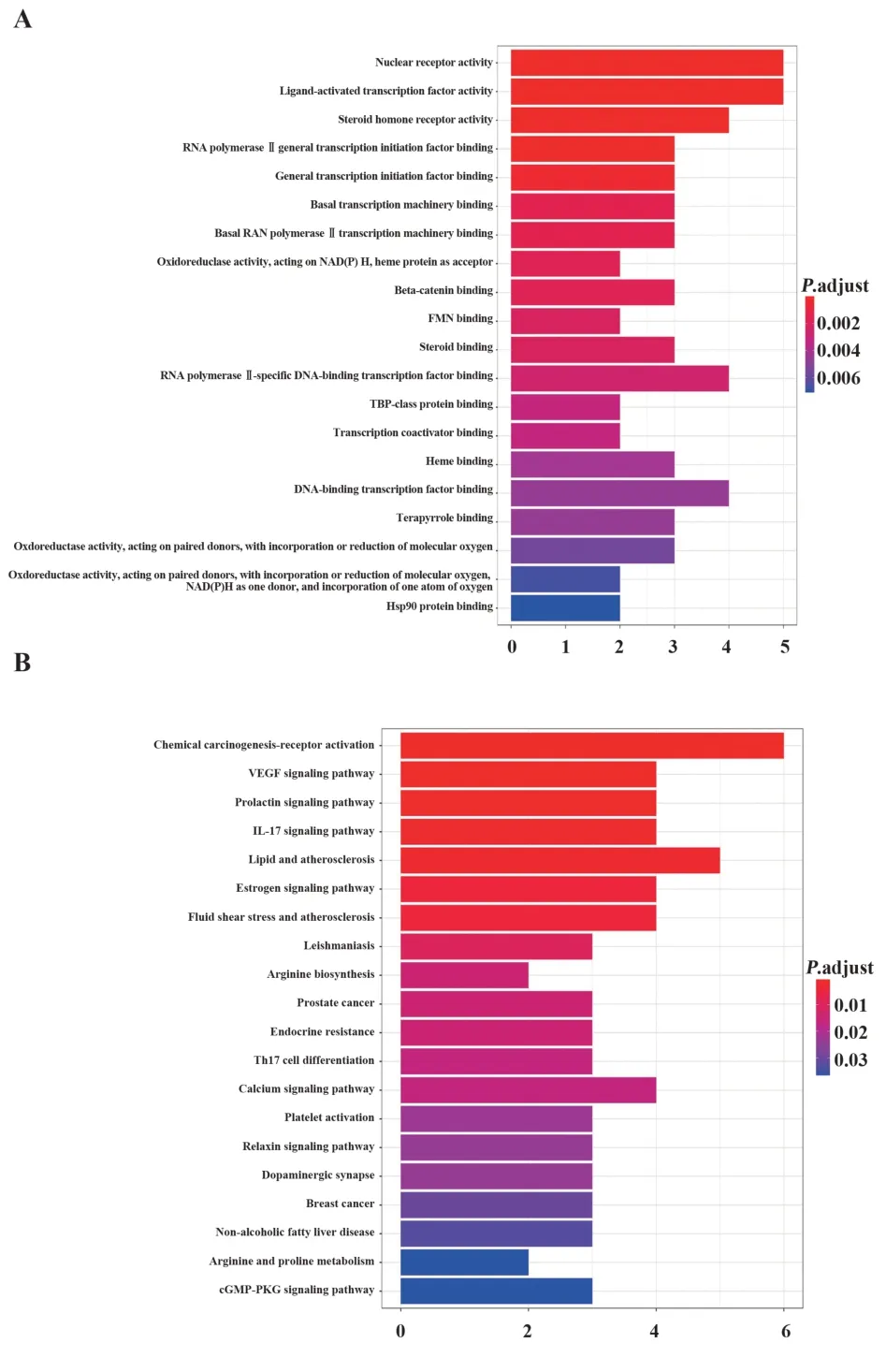
图2 核心靶点的GO分析和KEGG分析图Fig.2 GO analysis and KEGG analysis diagram of core target
2.6 体外细胞实验结果与正常组相比,GJLZ(12.5、25、50、100 μg/ml)组细胞活力增强,且随药物浓度增加对细胞无毒害作用。故选择GJLZ(25、50、100 μg/ml)低、中、高3个剂量组进行实验(图3)。ELISA测定细胞炎症因子证实网络药理学预测,即GJLZ通过抑制炎症因子释放治疗RA。与空白组相比,LPS刺激下,模型组细胞中IL-17、VEGF表达水平明显升高;与模型组相比,药物组以浓度依赖的方式抑制IL-17、VEGF产生,表明药物治疗后,促炎因子水平下调,阻止RA进展(图4)。
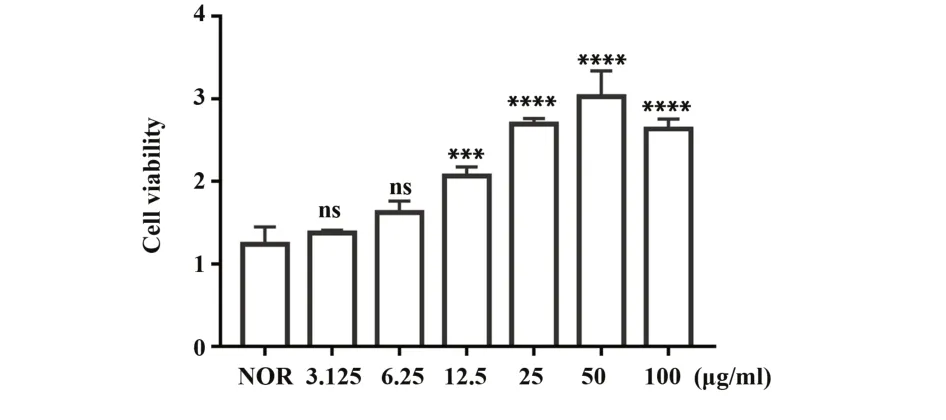
图3 不同浓度GJLZ对细胞活力的影响Fig.3 Effects of different concentrations of GJLZ on cell viability
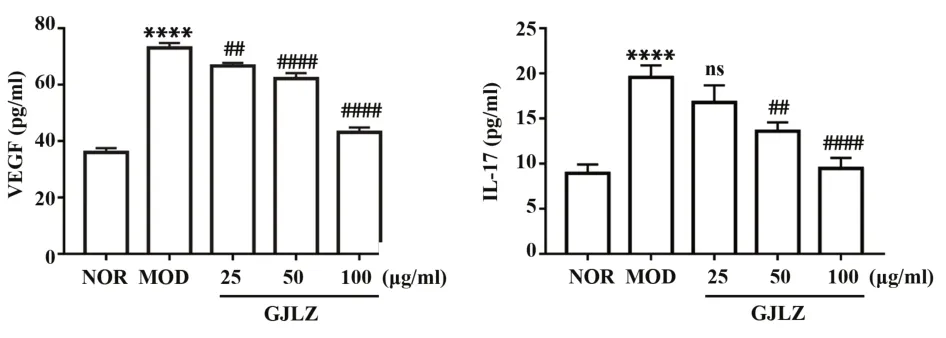
图4 GJLZ对VEGF、IL-17表达的影响Fig.4 Effect of GJLZ on expressions of VEGF and IL-17
3 讨论
RA发病机制复杂,主要与炎症、非炎症性免疫细胞、细胞炎症因子及受体信号通路有关[17-18]。文献报道,GJLZ可用于RA治疗,但机制尚不清楚,故本研究通过网络药理学预测并初步探讨GJLZ治疗RA的机制。
本研究质谱分析结果发现,GJLZ含有15种化学成分,包含甘草酚、姜烯酮-A、姜烯酮-B等。甘草酚是一种新型免疫抑制剂,CIA模型研究显示,甘草酚通过调节固有免疫和降低IL-17表达抑制RA发展[19]。SUK等[20]用肥胖小鼠进行体内体外实验,结果表明姜烯酮-A可预防肥胖,还可通过降低促炎因子活性抑制巨噬细胞炎症。综上,复方中的关键成分可通过作用于不同炎症因子和信号通路抑制炎症发生,故预测GJLZ在RA治疗方面疗效显著。
通过venny软件获得韦恩图,显示药物和疾病交集靶点为19个,将药物成分、疾病和交集靶点绘制网络图后得到GJLZ治疗RA的关键成分。根据质谱分析得到的15个化学成分,最终确认GJLZ和RA共有蛋白靶点34个,通过String软件构建PPI网络图,分析高度连接节点,其中AKT1、HSP90AA1、NOS3、KDR、MAPK14的置信度得分>0.9分,与其他靶点蛋白相互作用显著,表明这些靶点在RA生物学过程中非常重要。GO和KEGG通路分析显示,GJLZ治疗RA的靶点主要涉及VEGF、IL-17、Th17细胞分化、cGMP-PKG、PI3K-Akt等信号通路。VEGF、IL-17是重要的炎症因子,可通过体内诱导血管增生和增加内皮促炎因子产生导致炎症反应。PI3K-Akt是经典的信号通路,IL-17通过PI3K-Akt途径并以此作为媒介引发RA[21-22]。CIA大鼠研究发现,VEGF表达随关节炎指数升高而增加[23]。
分子对接结果表明,细胞炎症相关核心基因分子结合能均小于-3 kJ/mol,表明成分和蛋白靶点对接构象较好,结合活性较好,核心成分可直接与AKT1、HSP90AA1、KDR、NOS3相互作用,从而调节细胞炎症和增殖,以进一步筛选GJLZ治疗RA的相关机制[24]。研究表明,AKT1在CIA小鼠体内外实验中均为抑制炎症的直接靶标,可通过促进AKT1表达 减 轻CIA小 鼠 关节 炎症 和 损 伤[25]。ZAICHKO等[26]采用ELISA检测36例女性RA患者血清NOS3浓度,结果显示患者血清中NOS3含量显著降低,NOS3与炎症因子分泌呈负相关。KDR在血管生成和炎症中起重要作用,PCR和ELISA结果显示RA患者KDR水平显著高于健康志愿者[27-28]。HSP90AA1核心蛋白与NOS3相关,均参与破骨细胞分化、细胞代谢过程,与RA病理生理过程密切相关[29-30]。WANG等[31]发现,HSP90AA1是参与炎症的核心基因,可通过IL-17和TNF通路治疗疾病,且是通过VEGF通路抑制相关疾病的重要蛋白[32]。ZHU等[33]通过大鼠实验结合网络药理学证明,NOS3、TNF等治疗靶点通过IL-17、RA相关通路治疗疾病。核心蛋白间相互作用表现出高度连通性,直接或间接改变基因表达,最终抑制炎症发生。
经过质谱鉴定、网络药理学预测及分子模拟对接初步验证后,通过CCK-8和ELISA进一步证明GJLZ可显著下调LPS模型细胞IL-17及VEGF表达,抑制炎症反应发生,阻止RA发展。SUN等[34]通过ELISA检测IL-17含量,结果表明与对照组相比,RA高活动组和低活动组IL-17等炎症因子表达显著上调[35-36]。临床Meta分析发现,VEGF是血管生成和炎症的有效介质,与RA发病机制密切相关[37]。
综上,本研究通过UPLC-Q-TOF/MS和网络药理学对GJLZ治疗RA的机制进行预测,通过分子对接进行初步验证,再用细胞实验进一步验证,结果发现GJLZ治疗RA的机制与抑制IL-17和VEGF表达有关,为临床治疗RA提供了理论依据,为更好地研究GJLZ治疗RA提供了科学基础,具有重要研究价值。